Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1
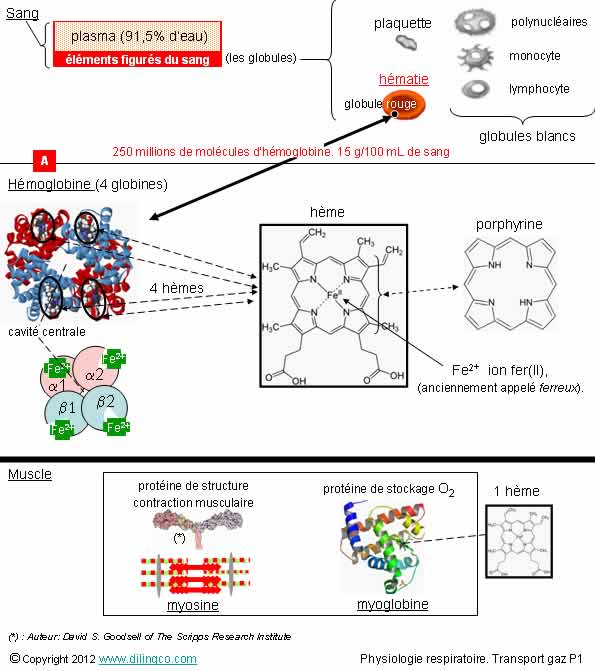
Sang. Plasma. Hémoglobine
Sélectionnez
les deux affirmations exactes :
1- « plasma » désigne les éléments figurés du sang
2- [A] :
myoglobine
3-
L’hémoglobine est une protéine à structure quaternaire formée de 4 chaînes
« globine » identiques 2 à 2 (2 alpha, 141 AA, et 2 bêta, 146 AA)
4- Chaque
globine contient un groupe hème. Un ion fe2+ est présent dans chaque hème
5- Le
globule rouge est un lymphocyte
Les
affirmations 3 et 4 sont exactes.
Révision : Biochimie, Biomolécules, protéines
Affirmation
1
Non.
Le plasma est la partie liquide du sang.
Le plasma est principalement composé d'eau
On y trouve des substances organiques, des
déchets, des éléments minéraux, des gaz dissous, des hormone et des
anticorps.
Les éléments figurés du sang
sont :
- les globules rouges ou hématies ou érythrocytes,
Le nombre d'hématies est normalement de :
- 5 millions
/ mm³ (4,5 à 5,5) chez l'homme adulte,
- 4,5 millions / mm³ (3,9 à 5,0) chez la femme adulte et l'enfant.
- les globules blancs ou leucocytes,
- les plaquettes.
Un globule rouge contient environ 250 millions de molécules d’hémoglobines.
Le taux d'hémoglobine (Hb) du sang est normalement de :
15 g/100 mL (13,5 à 16) chez l'homme
adulte,
13,5 (11,5 à 15) g/100 mL chez la femme adulte et l'enfant.
Affirmation 2
Non.
L’hémoglobine
contient un hème dans chaque une de ses quatre chaînes. C’est un exemple d’hétéroprotéine
à structure quaternaire.
La
myoglobine, apparentée à l’hémoglobine, est un monomère (formée d’une seule
sous unité composée de 153 acides aminés et d’un hème).
De part
l’affinité à l’oxygène :
-
L’hémoglobine est une protéine de transport.
- La
myoglobine est une protéine de stockage.
Rappels :
Révision : Biochimie, Biomolécules, protéines
Les
protéines peuvent être classées suivant leurs compositions.
Deux
grands types :
Les
« Holoprotéines », les
protéines ne contenant que des acides aminés.
Les « hétéroprotéines », protéines avec :
- une partie protéine (l’apoprotéine), et
- une partie non protéique (exemple : hème et ion Fe2+).
Ne pas
confondre :
- La myosine,
Protéine de structure, composée de deux chaînes polypeptidiques d’environ 2000
acides aminés. Par les modifications de sa structure, la
myosine
est à la base des mécanismes de contraction musculaire
(voir chapitre anatomie, introduction, muscle),
- La myoglobine,
Protéine globulaire des cellules musculaires, elle est apparentée à
l’hémoglobine (la myoglobine est un monomère alors que l’hémoglobine est un
tétramère).
La myoglobine est une hétéroprotéine contenant un hème.
A cause
de sa trop grande affinité à l’oxygène, la
myoglobine n’est pas, comme l’hémoglobine, une molécule de transport, mais plutôt une molécule de
stockage de l’oxygène dans les muscles.
Révision : Biochimie, Biomolécules, protéines
Page 2
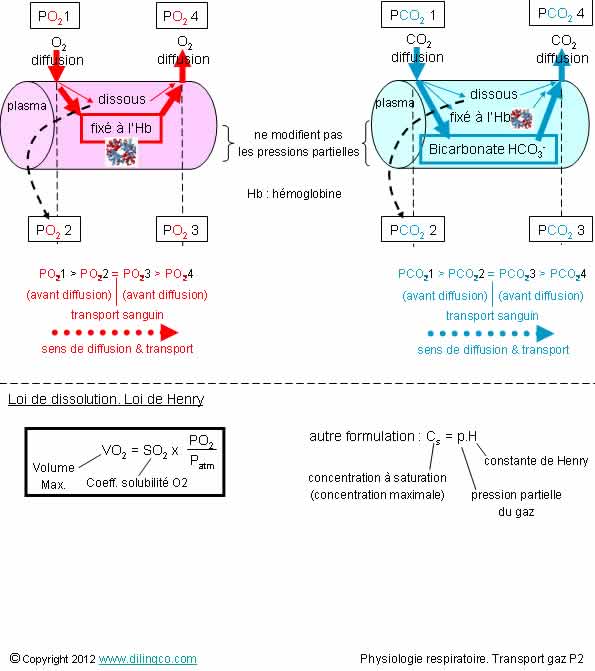
Modes de transport
Sélectionnez
les deux affirmations exactes :
1- O2
dans le sang = [fixé à l’hémoglobine] + [dissous]
2- La
dissolution de l’oxygène dans le sang est le mode principal de transport de
l’oxygène dans le sang
3- CO2
dans le sang = [combiné (bicarbonates)] + [dissous] + [fixé à l’hémoglobine]
4- La
dissolution dans le sang ou la fixation O2 et CO2 à l’hémoglobine sont
irréversibles
5- Les
concentrations de gaz dissous et leurs pressions partielles ne sont pas liées
6- La loi
de Henry s’applique aussi aux gaz combinés, ou aux gaz liés à l’hémoglobine
Les
affirmations 1 et 3 sont exactes.
Affirmation
1
Oui.
Deux modes de transport de l’oxygène dans le sang :
- dissous,
- liée à l’hémoglobine
(Hb :
hémoglobine)
Affirmation
4
Si.
La dissolution ou la fixation de l’oxygène et du dioxyde de carbone dans le sang
sont réversibles grâce aux pressions partielles.
Affirmation
5
Si.
La loi de
Henry dit que la concentration maximale, le volume maximal, d’un gaz dissous dans un liquide (le sang) est :
- proportionnelle à sa pression partielle dans le
liquide,
- dépend d’une constante ; constante liée à
la solubilité du gaz dans le liquide et à la température.
La concentration dissoute est une fonction linéaire de la pression
partielle.
La concentration maximale est dite « concentration à
saturation ».
Affirmation
6
Non.
Les gaz
inclus dans des structures moléculaires ne participent pas aux pressions
partielles.
Même si les proportions de gaz dissous sont faibles par rapport au total des gaz
transportés dans le sang, les gaz dissous sont
très importants : ils créent des différences de pressions qui permettent
les diverses diffusions.
Page 3
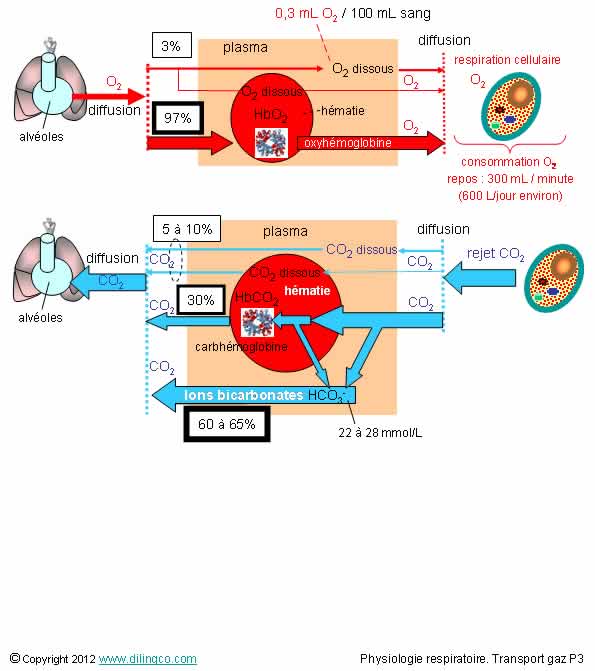
Pourcentages de gaz
transportés
Sélectionnez
l’affirmation exacte :
1- La
dissolution est le mode principal de transport de l’oxygène dans le sang
2- Le CO2
est transporté dans le sang sous forme d’ions bicarbonates (HCO3-), de
carbhémoglobine, et sous forme dissoute
3-
L’hémoglobine peut transporter l’oxygène mais pas le CO2
4- Les
diffusions alvéoles pulmonaires/capillaires et capillaires/cellules ne dépendent
pas des diverses pressions partielles
L’affirmation
2 est exacte.
Affirmation
1
Non.
1- L’oxygène combiné à l’hémoglobine est le mode principal
(97%) de transport de l’oxygène dans le sang
Affirmation
2
Oui.
Le CO2
est transporté sous forme :
- Ions bicarbonate HCO3- : 60 à 65%
-
carbhémoglobines fixées à l’hémoglobine des hématies : 20 à 30%
-
dissous : 5 à 10%
Page 4
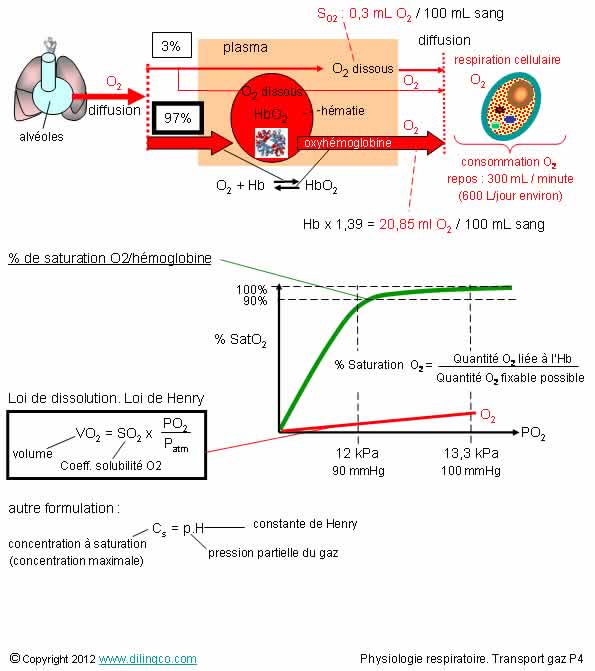
Transport de l’oxygène
Sélectionnez
les deux affirmations exactes :
1- L’oxygène
entre en compétition avec le CO2 pour son transport par l’hémoglobine
2- La concentration
d’oxygène dans l’hémoglobine n’est pas constante. Elle dépend de la pression
partielle de l’oxygène dans le sang
3- Pour
la pression artérielle partielle habituelle PaO2, la saturation de l’oxygène
dans l’hémoglobine, SatO2 est : 95 à 100%
4-
L’oxygène est transporté principalement sous forme dissoute dans le plasma
5- Le %
d’O2 dissous est si faible qu’il n’a pas de fonction physiologique
6- Le
pouvoir oxyphorique est la quantité d’oxygène qu’un gramme d’hémoglobine peut
fixer
Les
affirmations 2, 3 et 6 sont exactes.
Affirmation
1
Non.
Le
transport de l’oxygène par l’hémoglobine n’entre pas en compétition avec celle
du CO2 par l’hémoglobine :
- O2 se fixe sur un hème,
- CO2 sur un site d’acides aminés ne
faisant pas partie de l’hème.
Affirmations
2 et 3
Oui.
La courbe de pourcentage d’hémoglobine ayant fixé de l’O2 en
fonction de la pression partielle O2 est une sigmoïde.
Pression
partielle O2, PaO2 : 73 à 100 mmHg
(Dépend
de l’age, de la température du sujet, de l’altitude)
Saturation
artérielle de l’hémoglobine en oxygène, SatO2 :
95 à 100%
Affirmation
5
Si.
Même
faible, la dissolution O2 dans le sang est primordiale :
- elle
définie les pressions partielles,
-
pressions partielles qui permettent les diffusions.
Pas de diffusion = Pas de transport d’oxygène (dissous ou fixé
à l’hémoglobine).
Affirmation
6
Oui.
Le
pouvoir oxyphorique est la quantité d’oxygène qu’un gramme d’hémoglobine peut
fixer
Pouvoir oxyphorique
théorique : 1,39
(1 gr d’Hb => environ 1,39 mL d’oxygène)
En
réalité, 1 gr d’Hb fixe 1, 34 mL d’oxygène à cause d’HB incapables de fixer l’O2
(Hb dites anormales).
Un globule rouge
contient environ 250 millions de
molécules d’hémoglobines.
Le taux d'hémoglobine (Hb)
du sang est normalement de :
15 g/100 mL (13,5 à 16) chez l'homme
adulte,
13,5 (11,5 à 15) g/100 mL chez la femme adulte et l'enfant.
Page 5
Modifications l’affinité O2
de l’Hb
Sélectionnez
l’affirmation exacte :
1- La
pression partielle CO2 et le pH sont les seuls facteurs qui modifient
l’affinité de l’hémoglobine pour l’O2
2- [B] :
L’affinité de l’hémoglobine pour O2 augmente
3- [C] :
L’affinité de l’hémoglobine pour O2 augmente
4- [A] :
Les effets du CO2 et du pH sur l’affinité O2 de l’Hb s’opposent
L’affirmation
2 est exacte.
Affirmation
1
Non.
Facteurs
modifiants l’affinité de l’hémoglobine pour le CO2 :
- Température,
- pH,
(pH :
potentiel Hydrogène ; concentration des ions H+)
-
Pression partielle CO2,
-
Concentration en 2,3 DPG
(Plus de
DPG : moins d’affinité)
DPG :
diphosphoglycérate
Affirmation
2
Oui.
Effet Bohr : la PCO2 influence l’affinité O2 de
l’hémoglobine.
Si la PCO2 est basse, à PO2 donnée, l’hémoglobine fixe plus d’O2
(Cas des capillaires pulmonaires)
Affirmation
4
Non.
Les effets du CO2 et du pH sur l’affinité O2 de
l’Hémoglobine sont indissociables et vont dans le même sens :
-
augmentation PCO2 = augmentation de concentration CO2,
-
augmentation CO2 = augmentation H2CO3
(acide carbonique très instable)
-
augmentation H2CO3 = augmentation HCO3-
et augmentation H+
- augmentation H+
= pH diminue (L’acidité augmente)
Augmentation PCO2 = diminution pH = forte diminution de l’affinité O2
Rappels :
Détails : Chimie, Réactions chimiques, couple acide base
Un acide est un donneur de protons H+.
Une base est un accepteur de protons H+.
L’acide
(souvent noté «AH»), est un élément
chimique qui se dissocie en solution aqueuse pour donner
une base (A-) et un proton H+
(Le
proton ne n’existe pas en solution, il se solvate en ion oxonium H3O+).
Exemple d’acide : l’acide carbonique H2CO3
Définition
de Bronsted
Un acide est toute espèce qui peut libérer un ou plusieurs protons H.
Un acide
«AH» versé dans l’eau :
AH + H2O
<-> A- + H3O+
La base
découlant de la dissociation de l’acide, notée A-
dans cette équation générique, est chargée négativement.
H3O+
: un ion oxonium.
Note :
- La base
découle de la dissociation de l’acide et lui est propre :
Chaque acide a une base associée (et chaque base a un acide
associé).
Exemple de base : l’ion HCO3-
Acide.
Définition de Lewis
La
définition de Lewis est plus large que la définition de Bronsted.
Un acide
de Lewis est un accepteur de doublet.
Un des
atomes possède une lacune électronique (une de ses orbitales est vide).
Un acide de Lewis est un électrophile
(a = acide = aime/attire
les électrons).
Base.
Définition de Lewis
Une base de Lewis est un donneur de doublets
(Ayant au
moins un doublet libre).
Exemple :
Un
donneur d’ion O2- (riche en électrons) est une base.
Page 6
Transport du dioxyde de
carbone
Sélectionnez
l’affirmation exacte :
1- Le
transport du CO2 dans le sang se fait principalement dans les globules rouges
2-
[A] : La concentration du CO2 dans le sang est inférieure à la concentration
O2 dans le sang
3- Si le CO2
augmente : l’acide carbonique augmente et les protons H+ augmentent
4- La
pression/concentration CO2 et le pH n’influencent pas la dissociation de
l’oxyhémoglobine et la formation de carbhémoglobine
L’affirmation
3 est exacte.
Affirmation
1
Non.
Le transport du CO2 dans le sang se fait principalement
dans le plasma (60 à 65%).
Le CO2
est transporté sous trois formes :
- Ions bicarbonate HCO3- (forme
principale),
- carbhémoglobines fixées à un
AA de l’hémoglobine des hématies,
- dissoute
Note :
Les ions bicarbonates proviennent :
- d’une réaction lente CO2/H20, dans le plasma
- d’une réaction rapide CO2/H20, dans les hématies
(Car accélérée par une enzyme anhydrase carbonique)
- Les ions bicarbonates des globules rouges retraversent la
membrane cytoplasmique des hématies pour rejoindre le plasma.
Affirmation
2
Non.
- SCO2 :
0, 58 mL par 100 mL
- SO2 :
0, 3 mL par 100 mL
Note :
Ne pas
confondre concentration/volume et constante de solubilité de la formule
d’Henry.
Constante
de solubilité dans le sang :
O2 :
0,024
CO2 :
0,57 (environ
20 fois supérieure à celle de l’O2)
CO :
0,018
N (azote):
0,012
He
(helium) : 0,008
Affirmation
4:
Si.
(Voir page précédente « Modifications de l’affinité O2 de l’Hb »)
Les effets du CO2 et du pH sur l’affinité O2 de
l’Hémoglobine sont indissociables et vont dans le même sens :
-
augmentation PCO2 = augmentation de concentration CO2,
-
augmentation CO2 = augmentation H2CO3
(acide carbonique très instable)
-
augmentation H2CO3 = augmentation HCO3-
et augmentation H+
- augmentation H+
= pH diminue (L’acidité augmente)
Augmentation PCO2 = diminution pH = forte diminution de l’affinité O2
Rappels :
Détails : Chimie, Réactions chimiques, couple acide base
Un acide est un donneur de protons H+.
Une base est un accepteur de protons H+.
L’acide
(souvent noté «AH»), est un élément
chimique qui se dissocie en solution aqueuse pour donner
une base (A-) et un proton H+
(Le
proton n’existe pas en solution, il se solvate en ion oxonium H3O+).
Exemple d’acide : l’acide carbonique H2CO3
Définition
de Bronsted
Un acide est toute espèce qui peut libérer un ou plusieurs protons H.
Un acide
«AH» versé dans l’eau :
AH + H2O
<-> A- + H3O+
La base
découlant de la dissociation de l’acide, notée A-
dans cette équation générique, est chargée négativement.
H3O+
: un ion oxonium.
Note :
- La base
découle de la dissociation de l’acide et lui est propre :
Chaque acide a une base associée (et chaque base a un acide
associé).
Exemple de base : l’ion HCO3-
Acide.
Définition de Lewis
La
définition de Lewis est plus large que la définition de Bronsted.
Un acide
de Lewis est un accepteur de doublet.
Un des
atomes possède une lacune électronique (une de ses orbitales est vide).
Un acide de Lewis est un électrophile
(a = acide = aime/attire
les électrons).
Base.
Définition de Lewis
Une base de Lewis est un donneur de doublets
(Ayant au
moins un doublet libre).
Exemple :
Un
donneur d’ion O2- (riche en électrons) est une base.
H2CO3 :
acide carbonique
HCO3- : ion bicarbonate
CO32-
: ion carbonate
Sel
carbonate de sodium : Na2CO3
Sel
carbonate de potassium : K2CO3
Page 7.
Biochimie de transport
CO2
Sélectionnez
les deux affirmations exactes :
1- La
réaction du CO2 avec l’eau est plus rapide dans le plasma que dans les hématies
2 – Pas d’enzyme anhydrase carbonique dans le plasma ;
abondantes dans le cytoplasme des globules rouges
3-
[A] : Effet Hamburger : équilibre électrique par échange d’ions
chlores et d’ions bicarbonates (ions bicarbonates s’ajoutent à ceux déjà dans
le plasma)
4- Les
ions H+ ne font pas partie des ligands de l’hémoglobine
5- Le CO2
et l’oxygène se fixent sur le même site de l’hémoglobine
Les
affirmations 2 et 3 sont exactes.
Affirmation
1
Non.
La
réaction du CO2 :
- très
lente dans le plasma,
- très accélérés par l’enzyme anhydrase carbonique dans les
hématies.
Affirmation
4
Si.
Ligands
de l’hémoglobine :
- CO2,
- O2,
- H+
- CO (très
grande affinité de l’hémoglobine)
- 2,3 DPG
- …
Notes:
- L’hémoglobine absorbe, « tamponne » les protons H+
- Très
grande affinité de l’hémoglobine pour le CO.
Malheureusement,
une fois fixé, l’oxyde de carbone devient presque indélogeable = intoxication à
l’oxyde de carbone.
Affirmation
5
Non.
L’oxygène
se fixe sur l’ion Fe2+ de l’hème,
Le CO2 se fixe avec les groupements
terminaux NH2.
Page 8.
Fonction transport de
l’hémoglobine
Sélectionnez
les deux affirmations exactes :
1-
[A] : L’hémoglobine est une protéine à structure quaternaire formée de 4
chaînes « globine » identiques 2 à 2 (2 alpha, 141 AA, et 2 bêta, 146
AA)
2- L’hémoglobine
est une protéine de stockage de l’O2 (comme la myoglobine)
3- Le pH
agit sur la configuration spatiale de la molécule d’hémoglobine et sur son
affinité au dioxyène ou au dioxyde de carbone
4- Déoxyhémoglobine
= molécule d’hémoglobine chargée en O2
5- Une
molécule d’hémoglobine peut fixer plus de 4 molécules d’oxygène (plus d’une par
ion fe2+)
Les
affirmations 1 et 3 sont exactes.
Affirmation
2
Non.
L’hémoglobine est une protéine de transport :
- de l’O2,
ou
- du CO2
& H+
A cause
de sa trop grande affinité à l’oxygène, la
myoglobine n’est pas, comme l’hémoglobine
(affinité O2 variable en fonction du pH), une molécule de transport.
La myoglobine est plutôt une molécule de stockage de l’oxygène dans les muscles.
Affirmation
5
Non.
Le
maximum est de 4 oxygènes (1 par hème).
En
général 1 oxygène est fixé par hémoglobine.
Explications :
Le rôle
principal de l’hémoglobine est le transport du
dioxygène O2 vers les tissus.
L’hémoglobine
permet aussi l’évacuation des ions H+
et du CO2.
Les sels ferreux (Fe2+)
s'oxydent/se réduisent rapidement en fonction du pH, et en présence d'oxygène servent au transport O2.
La conformation spatiale du plan que prend l’anneau de
porphyrine explique les affinités de la molécule d’hémoglobine.
Forme
R, relaxée
Dans
cette forme relaxée :
- La
molécule d’hémoglobine n’est pas chargée,
- La
cavité centrale est réduite,
- La
molécule d’hémoglobine a une forte affinité pour O2
(Et
faible pour CO2 et H+).
Chargement
en dioxygène
Figure
(1)
La
capture d’un O2 par une globine augmente l’affinité des autres
globines pour l’O2 : il y a interaction
coopérative entre globines et réaction en cascade accélérant la capture des dioxygènes.
Passage
de la forme R à la forme T, tendue
Figure
(2)
A
l’approche d’une cellule à pH bas, les hélices alpha des globines se modifient,
la cavité centrale s’agrandie, la position spatiale du Fe par rapport au plan
de l’anneau de porphyrine change.
L’affinité de l’hémoglobine pour l’oxygène diminue.
Changement
de chargement
Figure
(3)
L’oxygène est libéré et capté par la cellule qui en a besoin.
Le pH de la cellule réceptrice d’oxygène augmente ; l’hémoglobine se charge en CO2 et ions H+
Libération
du CO2
Figure
(4)
Le CO2
de la molécule, alors appelée déoxyhémoglobine, est libérée dans les alvéoles
pulmonaires
Voir : Anatomie, système respiratoire ou Physiologie,
respirations).
L’hémoglobine
reprend sa forme relaxée, lui permettant de se recharger en O2.
Note :
- Le CO2 se connecte aux extrémités N-terminales
des globines et il est facilement libérable.
- L’ion H+ se lie à des résidus des chaînes protéiques.
- En présence de monoxyde de carbone
CO, l’hémoglobine se charge en CO.
Le CO se fixe sur le fer, et, avec une
affinité beaucoup plus élevée que l’O2, est
difficile à déloger = intoxication.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1
Sang. Plasma. Hémoglobine

Sélectionnez les deux affirmations exactes :
1- « plasma » désigne les éléments figurés du sang
2- [A] : myoglobine
3- L’hémoglobine est une protéine à structure quaternaire formée de 4 chaînes « globine » identiques 2 à 2 (2 alpha, 141 AA, et 2 bêta, 146 AA)
4- Chaque globine contient un groupe hème. Un ion fe2+ est présent dans chaque hème
5- Le globule rouge est un lymphocyte
Les affirmations 3 et 4 sont exactes.
Révision : Biochimie, Biomolécules, protéines
Affirmation 1
Non.
Le plasma est la partie liquide du sang.
Le plasma est principalement composé d'eau
On y trouve des substances organiques, des
déchets, des éléments minéraux, des gaz dissous, des hormone et des
anticorps.
Les éléments figurés du sang
sont :
- les globules rouges ou hématies ou érythrocytes,
Le nombre d'hématies est normalement de :
- 5 millions
/ mm³ (4,5 à 5,5) chez l'homme adulte,
- 4,5 millions / mm³ (3,9 à 5,0) chez la femme adulte et l'enfant.
- les globules blancs ou leucocytes,
- les plaquettes.
Un globule rouge contient environ 250 millions de molécules d’hémoglobines.
Le taux d'hémoglobine (Hb) du sang est normalement de :
15 g/100 mL (13,5 à 16) chez l'homme
adulte,
13,5 (11,5 à 15) g/100 mL chez la femme adulte et l'enfant.
Affirmation 2
Non.
L’hémoglobine
contient un hème dans chaque une de ses quatre chaînes. C’est un exemple d’hétéroprotéine
à structure quaternaire.
La myoglobine, apparentée à l’hémoglobine, est un monomère (formée d’une seule sous unité composée de 153 acides aminés et d’un hème).
De part l’affinité à l’oxygène :
- L’hémoglobine est une protéine de transport.
- La myoglobine est une protéine de stockage.
Rappels :
Révision : Biochimie, Biomolécules, protéines
Les protéines peuvent être classées suivant leurs compositions.
Deux grands types :
Les « Holoprotéines », les protéines ne contenant que des acides aminés.
Les « hétéroprotéines », protéines avec :
- une partie protéine (l’apoprotéine), et
- une partie non protéique (exemple : hème et ion Fe2+).
Ne pas confondre :
- La myosine,
Protéine de structure, composée de deux chaînes polypeptidiques d’environ 2000 acides aminés. Par les modifications de sa structure, la
myosine est à la base des mécanismes de contraction musculaire
(voir chapitre anatomie, introduction, muscle),
- La myoglobine,
Protéine globulaire des cellules musculaires, elle est apparentée à
l’hémoglobine (la myoglobine est un monomère alors que l’hémoglobine est un
tétramère).
La myoglobine est une hétéroprotéine contenant un hème.
A cause de sa trop grande affinité à l’oxygène, la myoglobine n’est pas, comme l’hémoglobine, une molécule de transport, mais plutôt une molécule de stockage de l’oxygène dans les muscles.
Révision : Biochimie, Biomolécules, protéines
Page 2
Modes de transport

Sélectionnez les deux affirmations exactes :
1- O2 dans le sang = [fixé à l’hémoglobine] + [dissous]
2- La dissolution de l’oxygène dans le sang est le mode principal de transport de l’oxygène dans le sang
3- CO2 dans le sang = [combiné (bicarbonates)] + [dissous] + [fixé à l’hémoglobine]
4- La dissolution dans le sang ou la fixation O2 et CO2 à l’hémoglobine sont irréversibles
5- Les concentrations de gaz dissous et leurs pressions partielles ne sont pas liées
6- La loi de Henry s’applique aussi aux gaz combinés, ou aux gaz liés à l’hémoglobine
Les affirmations 1 et 3 sont exactes.
Affirmation 1
Oui.
Deux modes de transport de l’oxygène dans le sang :
- dissous,
- liée à l’hémoglobine
(Hb : hémoglobine)
Affirmation 4
Si.
La dissolution ou la fixation de l’oxygène et du dioxyde de carbone dans le sang sont réversibles grâce aux pressions partielles.
Affirmation 5
Si.
La loi de Henry dit que la concentration maximale, le volume maximal, d’un gaz dissous dans un liquide (le sang) est :
- proportionnelle à sa pression partielle dans le liquide,
- dépend d’une constante ; constante liée à la solubilité du gaz dans le liquide et à la température.
La concentration dissoute est une fonction linéaire de la pression partielle.
La concentration maximale est dite « concentration à saturation ».
Affirmation 6
Non.
Les gaz inclus dans des structures moléculaires ne participent pas aux pressions partielles.
Même si les proportions de gaz dissous sont faibles par rapport au total des gaz transportés dans le sang, les gaz dissous sont très importants : ils créent des différences de pressions qui permettent les diverses diffusions.
Page 3
Pourcentages de gaz transportés

Sélectionnez l’affirmation exacte :
1- La dissolution est le mode principal de transport de l’oxygène dans le sang
2- Le CO2 est transporté dans le sang sous forme d’ions bicarbonates (HCO3-), de carbhémoglobine, et sous forme dissoute
3- L’hémoglobine peut transporter l’oxygène mais pas le CO2
4- Les diffusions alvéoles pulmonaires/capillaires et capillaires/cellules ne dépendent pas des diverses pressions partielles
L’affirmation 2 est exacte.
Affirmation 1
Non.
1- L’oxygène combiné à l’hémoglobine est le mode principal (97%) de transport de l’oxygène dans le sang
Affirmation 2
Oui.
Le CO2 est transporté sous forme :
- Ions bicarbonate HCO3- : 60 à 65%
- carbhémoglobines fixées à l’hémoglobine des hématies : 20 à 30%
- dissous : 5 à 10%
Page 4
Transport de l’oxygène

Sélectionnez les deux affirmations exactes :
1- L’oxygène entre en compétition avec le CO2 pour son transport par l’hémoglobine
2- La concentration d’oxygène dans l’hémoglobine n’est pas constante. Elle dépend de la pression partielle de l’oxygène dans le sang
3- Pour la pression artérielle partielle habituelle PaO2, la saturation de l’oxygène dans l’hémoglobine, SatO2 est : 95 à 100%
4- L’oxygène est transporté principalement sous forme dissoute dans le plasma
5- Le % d’O2 dissous est si faible qu’il n’a pas de fonction physiologique
6- Le pouvoir oxyphorique est la quantité d’oxygène qu’un gramme d’hémoglobine peut fixer
Les affirmations 2, 3 et 6 sont exactes.
Affirmation 1
Non.
Le transport de l’oxygène par l’hémoglobine n’entre pas en compétition avec celle du CO2 par l’hémoglobine :
- O2 se fixe sur un hème,
- CO2 sur un site d’acides aminés ne faisant pas partie de l’hème.
Affirmations 2 et 3
Oui.
La courbe de pourcentage d’hémoglobine ayant fixé de l’O2 en
fonction de la pression partielle O2 est une sigmoïde.
Pression partielle O2, PaO2 : 73 à 100 mmHg
(Dépend de l’age, de la température du sujet, de l’altitude)
Saturation artérielle de l’hémoglobine en oxygène, SatO2 : 95 à 100%
Affirmation 5
Si.
Même faible, la dissolution O2 dans le sang est primordiale :
- elle définie les pressions partielles,
- pressions partielles qui permettent les diffusions.
Pas de diffusion = Pas de transport d’oxygène (dissous ou fixé à l’hémoglobine).
Affirmation 6
Oui.
Le pouvoir oxyphorique est la quantité d’oxygène qu’un gramme d’hémoglobine peut fixer
Pouvoir oxyphorique théorique : 1,39
(1 gr d’Hb => environ 1,39 mL d’oxygène)
En réalité, 1 gr d’Hb fixe 1, 34 mL d’oxygène à cause d’HB incapables de fixer l’O2 (Hb dites anormales).
Un globule rouge
contient environ 250 millions de
molécules d’hémoglobines.
Le taux d'hémoglobine (Hb)
du sang est normalement de :
15 g/100 mL (13,5 à 16) chez l'homme
adulte,
13,5 (11,5 à 15) g/100 mL chez la femme adulte et l'enfant.
Page 5
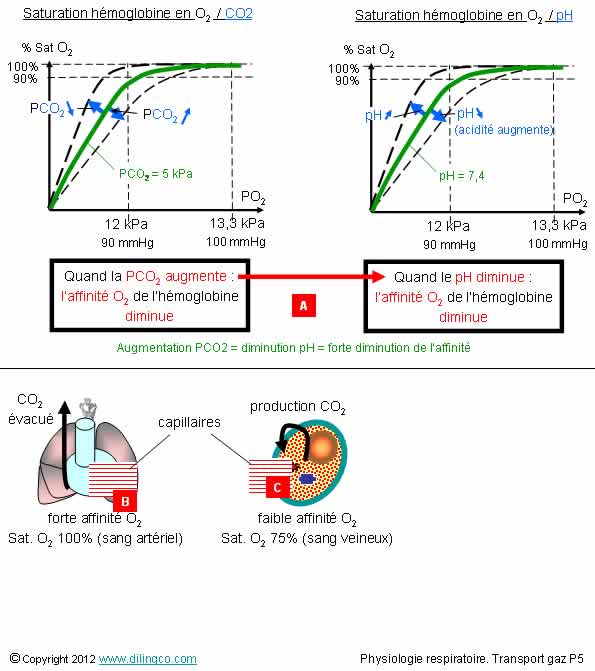
Modifications l’affinité O2 de l’Hb

Sélectionnez l’affirmation exacte :
1- La pression partielle CO2 et le pH sont les seuls facteurs qui modifient l’affinité de l’hémoglobine pour l’O2
2- [B] : L’affinité de l’hémoglobine pour O2 augmente
3- [C] : L’affinité de l’hémoglobine pour O2 augmente
4- [A] : Les effets du CO2 et du pH sur l’affinité O2 de l’Hb s’opposent
L’affirmation 2 est exacte.
Affirmation 1
Non.
Facteurs modifiants l’affinité de l’hémoglobine pour le CO2 :
- Température,
- pH,
(pH : potentiel Hydrogène ; concentration des ions H+)
- Pression partielle CO2,
- Concentration en 2,3 DPG
(Plus de DPG : moins d’affinité)
DPG : diphosphoglycérate
Affirmation 2
Oui.
Effet Bohr : la PCO2 influence l’affinité O2 de l’hémoglobine.
Si la PCO2 est basse, à PO2 donnée, l’hémoglobine fixe plus d’O2
(Cas des capillaires pulmonaires)
Affirmation 4
Non.
Les effets du CO2 et du pH sur l’affinité O2 de l’Hémoglobine sont indissociables et vont dans le même sens :
- augmentation PCO2 = augmentation de concentration CO2,
- augmentation CO2 = augmentation H2CO3 (acide carbonique très instable)
- augmentation H2CO3 = augmentation HCO3- et augmentation H+
- augmentation H+ = pH diminue (L’acidité augmente)
Augmentation PCO2 = diminution pH = forte diminution de l’affinité O2
Rappels :
Détails : Chimie, Réactions chimiques, couple acide base
Un acide est un donneur de protons H+.
Une base est un accepteur de protons H+.
L’acide (souvent noté «AH»), est un élément chimique qui se dissocie en solution aqueuse pour donner une base (A-) et un proton H+
(Le proton ne n’existe pas en solution, il se solvate en ion oxonium H3O+).
Exemple d’acide : l’acide carbonique H2CO3
Définition de Bronsted
Un acide est toute espèce qui peut libérer un ou plusieurs protons H.
Un acide «AH» versé dans l’eau :
AH + H2O <-> A- + H3O+
La base découlant de la dissociation de l’acide, notée A- dans cette équation générique, est chargée négativement.
H3O+ : un ion oxonium.
Note :
- La base découle de la dissociation de l’acide et lui est propre :
Chaque acide a une base associée (et chaque base a un acide associé).
Exemple de base : l’ion HCO3-
Acide. Définition de Lewis
La définition de Lewis est plus large que la définition de Bronsted.
Un acide de Lewis est un accepteur de doublet.
Un des atomes possède une lacune électronique (une de ses orbitales est vide).
Un acide de Lewis est un électrophile
(a = acide = aime/attire les électrons).
Base. Définition de Lewis
Une base de Lewis est un donneur de doublets
(Ayant au moins un doublet libre).
Exemple :
Un donneur d’ion O2- (riche en électrons) est une base.
Page 6
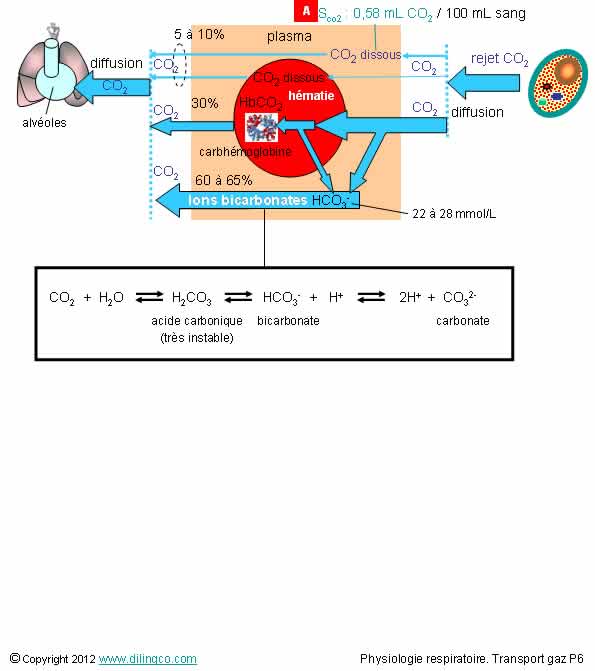
Transport du dioxyde de carbone

Sélectionnez l’affirmation exacte :
1- Le transport du CO2 dans le sang se fait principalement dans les globules rouges
2- [A] : La concentration du CO2 dans le sang est inférieure à la concentration O2 dans le sang
3- Si le CO2 augmente : l’acide carbonique augmente et les protons H+ augmentent
4- La pression/concentration CO2 et le pH n’influencent pas la dissociation de l’oxyhémoglobine et la formation de carbhémoglobine
L’affirmation 3 est exacte.
Affirmation 1
Non.
Le transport du CO2 dans le sang se fait principalement dans le plasma (60 à 65%).
Le CO2 est transporté sous trois formes :
- Ions bicarbonate HCO3- (forme
principale),
- carbhémoglobines fixées à un
AA de l’hémoglobine des hématies,
- dissoute
Note :
Les ions bicarbonates proviennent :
- d’une réaction lente CO2/H20, dans le plasma
- d’une réaction rapide CO2/H20, dans les hématies
(Car accélérée par une enzyme anhydrase carbonique)
- Les ions bicarbonates des globules rouges retraversent la membrane cytoplasmique des hématies pour rejoindre le plasma.
Affirmation 2
Non.
- SCO2 : 0, 58 mL par 100 mL
- SO2 : 0, 3 mL par 100 mL
Note :
Ne pas confondre concentration/volume et constante de solubilité de la formule d’Henry.
Constante de solubilité dans le sang :
O2 : 0,024
CO2 : 0,57 (environ 20 fois supérieure à celle de l’O2)
CO : 0,018
N (azote): 0,012
He (helium) : 0,008
Affirmation 4:
Si.
(Voir page précédente « Modifications de l’affinité O2 de l’Hb »)
Les effets du CO2 et du pH sur l’affinité O2 de l’Hémoglobine sont indissociables et vont dans le même sens :
- augmentation PCO2 = augmentation de concentration CO2,
- augmentation CO2 = augmentation H2CO3 (acide carbonique très instable)
- augmentation H2CO3 = augmentation HCO3- et augmentation H+
- augmentation H+ = pH diminue (L’acidité augmente)
Augmentation PCO2 = diminution pH = forte diminution de l’affinité O2
Rappels :
Détails : Chimie, Réactions chimiques, couple acide base
Un acide est un donneur de protons H+.
Une base est un accepteur de protons H+.
L’acide (souvent noté «AH»), est un élément chimique qui se dissocie en solution aqueuse pour donner une base (A-) et un proton H+
(Le proton n’existe pas en solution, il se solvate en ion oxonium H3O+).
Exemple d’acide : l’acide carbonique H2CO3
Définition de Bronsted
Un acide est toute espèce qui peut libérer un ou plusieurs protons H.
Un acide «AH» versé dans l’eau :
AH + H2O <-> A- + H3O+
La base découlant de la dissociation de l’acide, notée A- dans cette équation générique, est chargée négativement.
H3O+ : un ion oxonium.
Note :
- La base découle de la dissociation de l’acide et lui est propre :
Chaque acide a une base associée (et chaque base a un acide associé).
Exemple de base : l’ion HCO3-
Acide. Définition de Lewis
La définition de Lewis est plus large que la définition de Bronsted.
Un acide de Lewis est un accepteur de doublet.
Un des atomes possède une lacune électronique (une de ses orbitales est vide).
Un acide de Lewis est un électrophile
(a = acide = aime/attire les électrons).
Base. Définition de Lewis
Une base de Lewis est un donneur de doublets
(Ayant au moins un doublet libre).
Exemple :
Un donneur d’ion O2- (riche en électrons) est une base.
H2CO3 : acide carbonique
HCO3- : ion bicarbonate
CO32- : ion carbonate
Sel carbonate de sodium : Na2CO3
Sel carbonate de potassium : K2CO3
Page 7.
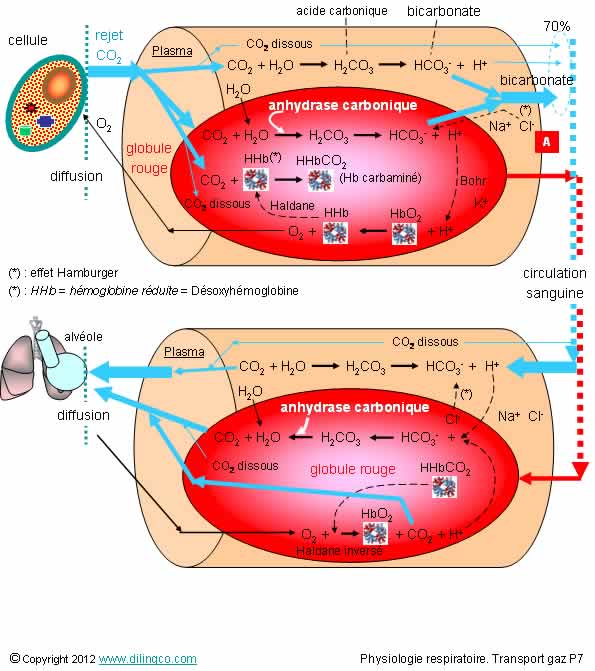
Biochimie de transport CO2

Sélectionnez les deux affirmations exactes :
1- La réaction du CO2 avec l’eau est plus rapide dans le plasma que dans les hématies
2 – Pas d’enzyme anhydrase carbonique dans le plasma ; abondantes dans le cytoplasme des globules rouges
3- [A] : Effet Hamburger : équilibre électrique par échange d’ions chlores et d’ions bicarbonates (ions bicarbonates s’ajoutent à ceux déjà dans le plasma)
4- Les ions H+ ne font pas partie des ligands de l’hémoglobine
5- Le CO2 et l’oxygène se fixent sur le même site de l’hémoglobine
Les affirmations 2 et 3 sont exactes.
Affirmation 1
Non.
La réaction du CO2 :
- très lente dans le plasma,
- très accélérés par l’enzyme anhydrase carbonique dans les hématies.
Affirmation 4
Si.
Ligands de l’hémoglobine :
- CO2,
- O2,
- H+
- CO (très grande affinité de l’hémoglobine)
- 2,3 DPG
- …
Notes:
- L’hémoglobine absorbe, « tamponne » les protons H+
- Très grande affinité de l’hémoglobine pour le CO.
Malheureusement, une fois fixé, l’oxyde de carbone devient presque indélogeable = intoxication à l’oxyde de carbone.
Affirmation 5
Non.
L’oxygène se fixe sur l’ion Fe2+ de l’hème,
Le CO2 se fixe avec les groupements terminaux NH2.
Page 8.
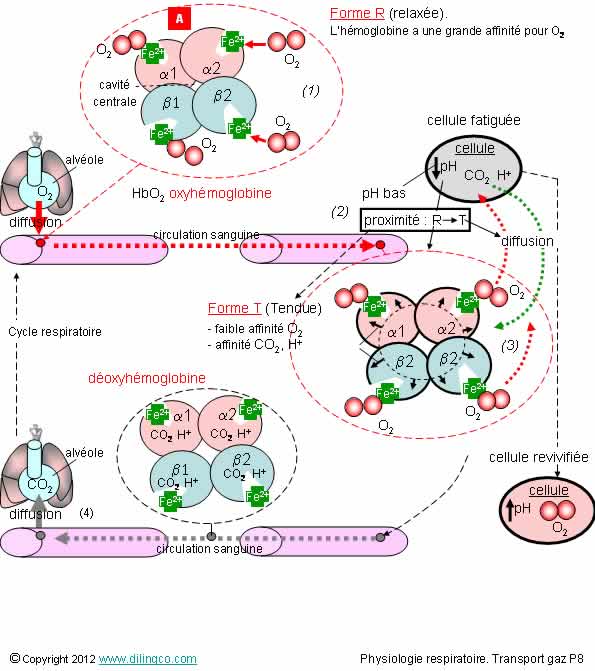
Fonction transport de l’hémoglobine

Sélectionnez les deux affirmations exactes :
1- [A] : L’hémoglobine est une protéine à structure quaternaire formée de 4 chaînes « globine » identiques 2 à 2 (2 alpha, 141 AA, et 2 bêta, 146 AA)
2- L’hémoglobine est une protéine de stockage de l’O2 (comme la myoglobine)
3- Le pH agit sur la configuration spatiale de la molécule d’hémoglobine et sur son affinité au dioxyène ou au dioxyde de carbone
4- Déoxyhémoglobine = molécule d’hémoglobine chargée en O2
5- Une molécule d’hémoglobine peut fixer plus de 4 molécules d’oxygène (plus d’une par ion fe2+)
Les affirmations 1 et 3 sont exactes.
Affirmation 2
Non.
L’hémoglobine est une protéine de transport :
- de l’O2, ou
- du CO2 & H+
A cause
de sa trop grande affinité à l’oxygène, la
myoglobine n’est pas, comme l’hémoglobine
(affinité O2 variable en fonction du pH), une molécule de transport.
La myoglobine est plutôt une molécule de stockage de l’oxygène dans les muscles.
Affirmation 5
Non.
Le maximum est de 4 oxygènes (1 par hème).
En général 1 oxygène est fixé par hémoglobine.
Explications :
Le rôle principal de l’hémoglobine est le transport du dioxygène O2 vers les tissus.
L’hémoglobine permet aussi l’évacuation des ions H+ et du CO2.
Les sels ferreux (Fe2+) s'oxydent/se réduisent rapidement en fonction du pH, et en présence d'oxygène servent au transport O2.
La conformation spatiale du plan que prend l’anneau de porphyrine explique les affinités de la molécule d’hémoglobine.
Forme R, relaxée
Dans cette forme relaxée :
- La molécule d’hémoglobine n’est pas chargée,
- La cavité centrale est réduite,
- La molécule d’hémoglobine a une forte affinité pour O2
(Et faible pour CO2 et H+).
Chargement en dioxygène
Figure (1)
La capture d’un O2 par une globine augmente l’affinité des autres globines pour l’O2 : il y a interaction coopérative entre globines et réaction en cascade accélérant la capture des dioxygènes.
Passage de la forme R à la forme T, tendue
Figure (2)
A l’approche d’une cellule à pH bas, les hélices alpha des globines se modifient, la cavité centrale s’agrandie, la position spatiale du Fe par rapport au plan de l’anneau de porphyrine change.
L’affinité de l’hémoglobine pour l’oxygène diminue.
Changement de chargement
Figure (3)
L’oxygène est libéré et capté par la cellule qui en a besoin.
Le pH de la cellule réceptrice d’oxygène augmente ; l’hémoglobine se charge en CO2 et ions H+
Libération du CO2
Figure (4)
Le CO2 de la molécule, alors appelée déoxyhémoglobine, est libérée dans les alvéoles pulmonaires
Voir : Anatomie, système respiratoire ou Physiologie, respirations). L’hémoglobine reprend sa forme relaxée, lui permettant de se recharger en O2.
Note :
- Le CO2 se connecte aux extrémités N-terminales
des globines et il est facilement libérable.
- L’ion H+ se lie à des résidus des chaînes protéiques.
- En présence de monoxyde de carbone
CO, l’hémoglobine se charge en CO.
Le CO se fixe sur le fer, et, avec une
affinité beaucoup plus élevée que l’O2, est
difficile à déloger = intoxication.