Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1
Pression atmosphérique
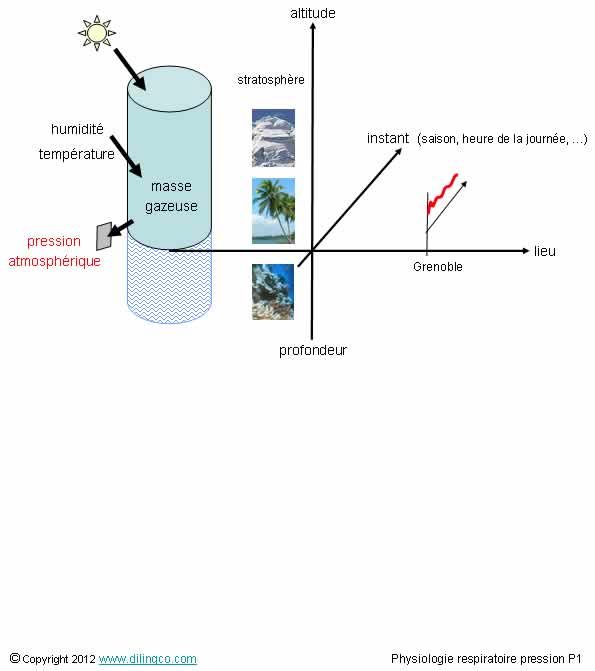
Sélectionnez
l’affirmation exacte :
1- La
pression atmosphérique est liée au nombre d’impacts moléculaire qu’exerce le
mélange gazeux atmosphérique sur une surface
2- La
pression atmosphérique au niveau de la mer est identique en tous les points de
la terre
3- La
pression atmosphérique s’élève avec l’altitude (il faut un scaphandre pour
supporter la pression stratosphérique)
4- La
pression atmosphérique ne dépend pas de l’humidité ou de la température
L’affirmation
1 est exacte.
Affirmation
1
Oui.
La pression d’un gaz est liée au nombre d’impacts que les
molécules de ce gaz ont sur la surface.
La
température accroît l’agitation moléculaire donc la pression, l’augmentation de
concentration du gaz aussi.
Affirmation
4
Si.
La
pression due à la vapeur d’eau diminue relativement la pression
d’oxygène ; pression d’oxygène primordiale pour la respiration.
Page 2
Unités de pression
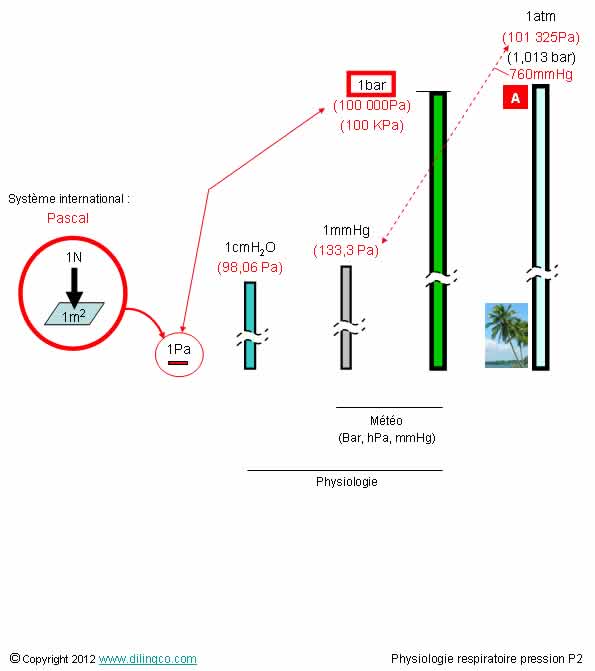
Sélectionnez
l’affirmation exacte :
1-
Pression atmosphérique moyenne au niveau de la mer est d’environ 1 KPa
2-
[A] : 1 atm = 101325 Pa / 133,3 = 760 mm de mercure ; (1mmHg = 133,3 PA)
3- En
physiologie, l’unité de pression la plus utilisée est l’atm (atmosphère)
4-
L’unité internationale de pression est le bar
L’affirmation
2 est exacte.
Affirmation
1
Non.
Pression
atmosphérique moyenne au niveau de la mer est d’environ 100 KPa
Pour
convertir en unité internationale (à retenir):
1kPa = 7,5mmHG
1mmHg = 0,133 kPa
Affirmation
3
Non.
cmH2O : Pressions
mécaniques dans l’appareil respiratoire.
kPa (ou
en mmHg) : Pressions des gaz dans le sang.
mmHg, cmHg : Pressions dans les vaisseaux
Affirmation
4
Non.
L’unité
internationale de pression est le Pascal.
Pour convertir en unité internationale (à retenir):
1kPa = 7,5mmHG
1mmHg = 0,133 kPa
Page 3
Exemples
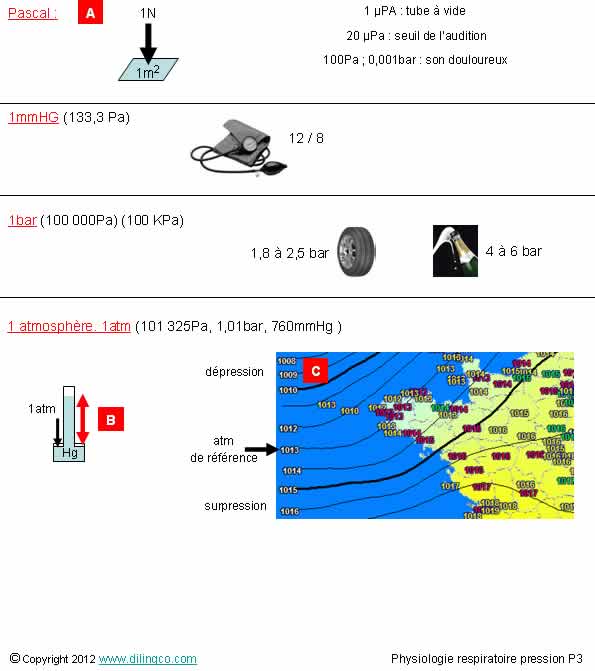
Sélectionnez
les deux affirmations exactes :
1- La
pression dans un pneu de voiture gonflé est inférieure à la pression
atmosphérique
2- La
pression artérielle (force que le sang exerce sur la paroi), s’exprime
généralement en bar. Exemples : 12/8
3- Le
« centimètre d’eau », cmH2O, ou le mmH2O, ne sont pas utilisés en
médecine
4- [B] :
Sous l’effet de la pression atmosphérique, le mercure monte (au niveau de la
mer), de 760 mm dans le tube à vide
5-
[C] : exemple de pressions atmosphériques exprimées en hecto Pascals
6-
[C] : zone d’anticyclone
Les
affirmations 4 et 5 sont exactes.
Affirmation
1
Non,
supérieure.
(Égale à
la pression atmosphérique si crevé)
Rappels :
1 atm =
101325 Pa (1,013 bar)
Pneu gonflé à 2 bars a une pression supérieure à la pression atmosphérique.
Affirmation
2
Non.
La pression artérielle s’exprime généralement en cmHg
(Centimètres
de mercure).
Exemple :
12/8
- 12 cmHg de pression systolique ; pression
au moment de la contraction du cœur,
- 8 cmHg de pression diastolique lors du
relâchement cardiaque.
Note :
120/80,
graduations des appareils de mesure => mmHg.
Affirmation
3
Si.
Le cmH2O,
peut être, comme le mmHg, l’unité de mesure de pression :
- des
veines,
- du
cerveau,
- du
liquide céphalo-rachidien,
« Chez
l’homme couché en position latérale, la pression
du LCR varie entre 100 et 200 mmH2O »
- de la
ventilation respiratoire,
- ….
Affirmation
5
Oui.
1 atm
= 1 bar = 760 mmHg, 101 KPa = 1013 hectos Pa
Affirmation
6
Non.
Zone de
basse pression ; dépression par rapport à l’atm de référence.
Un anticyclone est une zone de
circulation atmosphérique autour d'un centre de haute pression.
Page 4
Composition de l’air
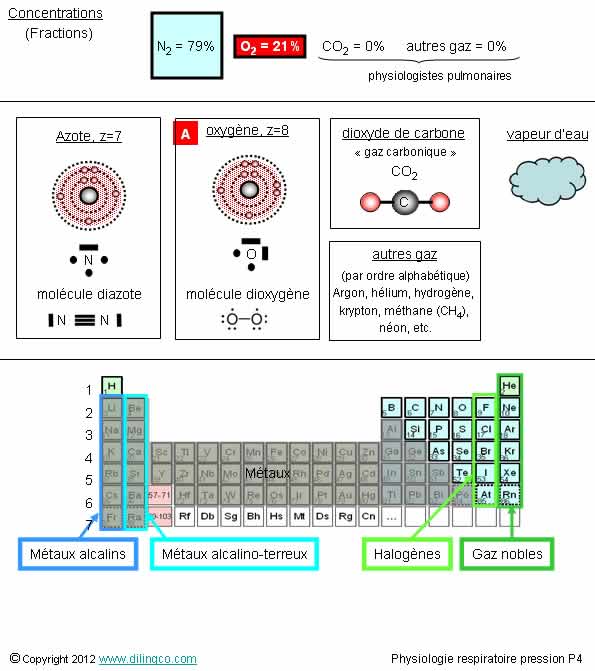
Sélectionnez
l’affirmation exacte :
1-
[A] : Atome d’oxygène. Numéro atomique : z=8
2- Il n’y
a pas de vapeur d’eau dans l’atmosphère
3- La
Fraction la plus importante de gaz dans l’air est celle de l’oxygène (F O2 =
79%)
4-
L’hydrogène et l’hélium sont des halogènes
L’affirmation
1 est exacte.
Affirmation
1
Oui.
La
molécule d’oxygène, ou simplement « oxygène », est le dioxygène O2.
Affirmation
2
Si.
L’atmosphère
est un mélange de divers gaz et de vapeur d’eau.
Affirmation
3
Non.
À savoir par cœur :
F N2 = 79%
F O2 = 21 %
F CO2 = 0% et autres gaz
(Pour les
physiologistes = considérée négligeable)
Page 5
Pressions partielles
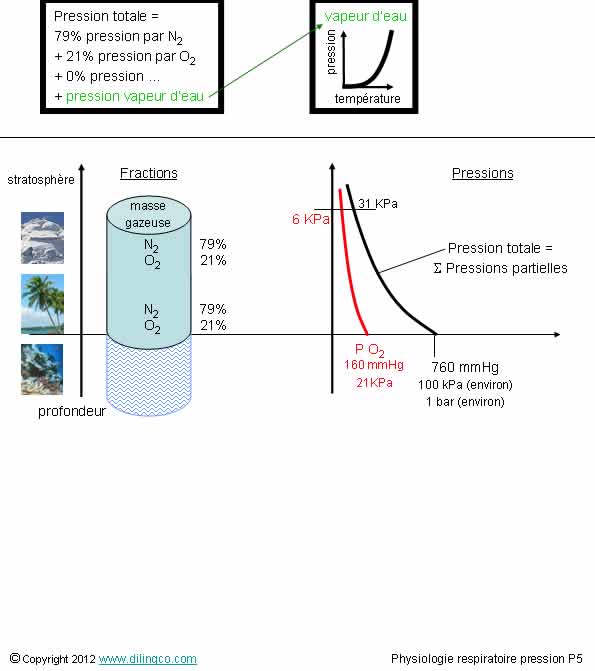
Sélectionnez
les deux affirmations exactes :
1- La
pression atmosphérique augmente de manière exponentielle avec l’altitude
2- Niveau
mer, la pression atmosphérique, 760 mmHg environ, 100 KPa environ, 1013 hectos
Pascal
3- En
première approximation, les fractions gazeuses ne varient pas avec l’altitude
(ne pas confondre fraction et concentrations gazeuses)
4- La
pression partielle due à l’oxygène au niveau de la mer est d’environ 760 mmHg
5- Au
niveau de la mer, la pression due à l’azote est d’environ 200 mmHg
6- La
pression atmosphérique ne dépend pas de l’humidité ; l’humidité n’a pas
d’impact sur la respiration
Les
affirmations 2 et 3 sont exactes.
Affirmation
1
Non.
La pression atmosphérique diminue avec l'altitude de manière exponentielle selon la
formule du nivellement barométrique.
Niveau de
la mer, la pression atmosphérique :
1
atmosphère, 760 mmHg, soit 1013 hectos Pa, soit 1,013 bar,
à 1 000 m :
674 mmHg,
898 hectos Pa,
au niveau
de l’Everest :
236 mmHg,
314 hectos Pa.
Affirmation
3
Exact.
La fraction gazeuse d’un gaz est le pourcentage d’un gaz dans un
mélange.
La fraction
gazeuse d’un gaz peut être la même avec l’altitude, mais la concentration de ce
gaz va diminuer si la concentration globale du mélange diminue avec l’altitude.
La
pression est liée à la concentration car due aux impacts moléculaires sur une
surface.
La pression atmosphérique diminue avec la diminution de la concentration du
mélange gazeux atmosphérique en altitude ; les fractions gazeuses,
pourcentages des divers gaz, en ne considérant pas les fluctuations, peuvent
être considérées globalement constantes.
Affirmation
4 et 5
Non.
Pression
O2 = 21% de 760 = 160 mmHg
Pression
N2 = 79% de 760 = 600 mmHg
Affirmation
6
Si.
Pression
totale = Pressions partielles gazeuses + pression
partielle vapeur d’eau
La
pression partielle de l’oxygène diminue dans un air plus humide : plus
difficile de respirer.
Rappels :
- Les gaz
sont des molécules en mouvement.
- La pression est due à la collision des molécules gazeuse
avec la surface considérée.
- Loi de
Dalton : la pression totale est la somme des
pressions partielles.
- Tenir compte des fractions gazeuses pour
déterminer la pression due à un gaz du mélange.
Page 6
Concentration,
température, humidité
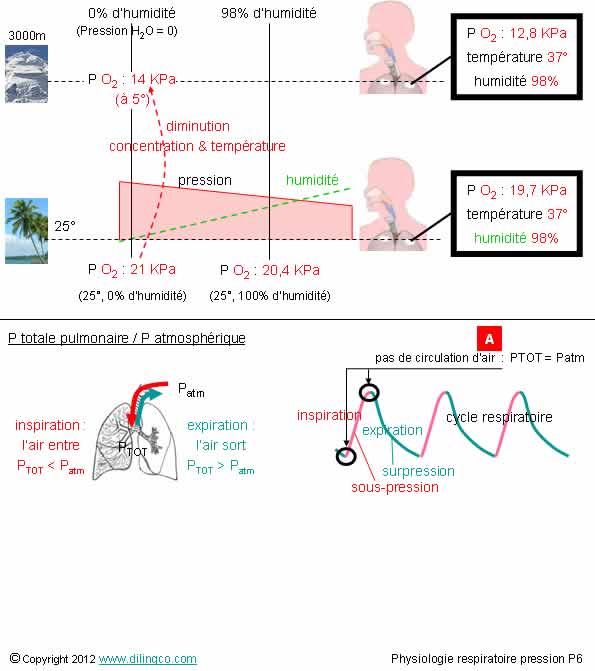
Sélectionnez
les deux affirmations exactes :
1- La
pression partielle de l’oxygène dans les alvéoles pulmonaires est constante
2- Les
pressions partielles de l’oxygène dans les alvéoles pulmonaires et dans
l’environnement externe sont identiques
3- La
pression partielle de l’oxygène dépend de la température et de l’humidité
4- à
autres paramètres égaux, il est plus facile de respirer dans de l’air humide
5-
[A] : en fin d’expiration et en fin d’inspiration, le débit d’air
s’annule : le gradient de pression entre l’intérieur des poumons et
l’environnement est nul
Les affirmations
3 et 5 sont exactes.
Affirmations
1 & 2
Non.
Même si
elle est tributaire des pressions partielles externes, la pression partielle de
l’oxygène à l’intérieur des alvéoles pulmonaires subie l’effet du
conditionnement de l’air, température et humidité, apporté par les voix
aérienne supérieures.
La
pression partielle de l’oxygène diminue avec le
passage de l’air dans les VAS (Les cornets des cavités nasales joue
le rôle de radiateur et d’humidificateur).
VAS :
voix aérienne supérieures.
Affirmation
3
Oui.
Pas de valeur
d’eau : pas de pression partielle
Exemples
de pressions partielles pour de la vapeur d’eau en saturation 100% :
0m,
25°C : 3 KPa
0m, 37°C : 6 KPa (normal, l’agitation thermique
accroît les impacts moléculaire sur la surface considérée)
Affirmation
4
Non.
La
fraction de la vapeur d’eau diminue relativement celle de l’oxygène : une
fraction de la valeurs d’eau plus importante diminue d’autant celle de
l’oxygène.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1
Pression atmosphérique

Sélectionnez l’affirmation exacte :
1- La pression atmosphérique est liée au nombre d’impacts moléculaire qu’exerce le mélange gazeux atmosphérique sur une surface
2- La pression atmosphérique au niveau de la mer est identique en tous les points de la terre
3- La pression atmosphérique s’élève avec l’altitude (il faut un scaphandre pour supporter la pression stratosphérique)
4- La pression atmosphérique ne dépend pas de l’humidité ou de la température
L’affirmation 1 est exacte.
Affirmation 1
Oui.
La pression d’un gaz est liée au nombre d’impacts que les molécules de ce gaz ont sur la surface.
La température accroît l’agitation moléculaire donc la pression, l’augmentation de concentration du gaz aussi.
Affirmation 4
Si.
La pression due à la vapeur d’eau diminue relativement la pression d’oxygène ; pression d’oxygène primordiale pour la respiration.
Page 2
Unités de pression

Sélectionnez l’affirmation exacte :
1- Pression atmosphérique moyenne au niveau de la mer est d’environ 1 KPa
2- [A] : 1 atm = 101325 Pa / 133,3 = 760 mm de mercure ; (1mmHg = 133,3 PA)
3- En physiologie, l’unité de pression la plus utilisée est l’atm (atmosphère)
4- L’unité internationale de pression est le bar
L’affirmation 2 est exacte.
Affirmation 1
Non.
Pression atmosphérique moyenne au niveau de la mer est d’environ 100 KPa
Pour convertir en unité internationale (à retenir):
1kPa = 7,5mmHG
1mmHg = 0,133 kPa
Affirmation 3
Non.
cmH2O : Pressions mécaniques dans l’appareil respiratoire.
kPa (ou en mmHg) : Pressions des gaz dans le sang.
mmHg, cmHg : Pressions dans les vaisseaux
Affirmation 4
Non.
L’unité
internationale de pression est le Pascal.
Pour convertir en unité internationale (à retenir):
1kPa = 7,5mmHG
1mmHg = 0,133 kPa
Page 3
Exemples

Sélectionnez les deux affirmations exactes :
1- La pression dans un pneu de voiture gonflé est inférieure à la pression atmosphérique
2- La pression artérielle (force que le sang exerce sur la paroi), s’exprime généralement en bar. Exemples : 12/8
3- Le « centimètre d’eau », cmH2O, ou le mmH2O, ne sont pas utilisés en médecine
4- [B] : Sous l’effet de la pression atmosphérique, le mercure monte (au niveau de la mer), de 760 mm dans le tube à vide
5- [C] : exemple de pressions atmosphériques exprimées en hecto Pascals
6- [C] : zone d’anticyclone
Les affirmations 4 et 5 sont exactes.
Affirmation 1
Non, supérieure.
(Égale à la pression atmosphérique si crevé)
Rappels :
1 atm =
101325 Pa (1,013 bar)
Pneu gonflé à 2 bars a une pression supérieure à la pression atmosphérique.
Affirmation 2
Non.
La pression artérielle s’exprime généralement en cmHg
(Centimètres de mercure).
Exemple : 12/8
- 12 cmHg de pression systolique ; pression au moment de la contraction du cœur,
- 8 cmHg de pression diastolique lors du relâchement cardiaque.
Note :
120/80, graduations des appareils de mesure => mmHg.
Affirmation 3
Si.
Le cmH2O, peut être, comme le mmHg, l’unité de mesure de pression :
- des veines,
- du cerveau,
- du liquide céphalo-rachidien,
« Chez l’homme couché en position latérale, la pression du LCR varie entre 100 et 200 mmH2O »
- de la ventilation respiratoire,
- ….
Affirmation 5
Oui.
1 atm = 1 bar = 760 mmHg, 101 KPa = 1013 hectos Pa
Affirmation 6
Non.
Zone de basse pression ; dépression par rapport à l’atm de référence.
Un anticyclone est une zone de circulation atmosphérique autour d'un centre de haute pression.
Page 4
Composition de l’air

Sélectionnez l’affirmation exacte :
1- [A] : Atome d’oxygène. Numéro atomique : z=8
2- Il n’y a pas de vapeur d’eau dans l’atmosphère
3- La Fraction la plus importante de gaz dans l’air est celle de l’oxygène (F O2 = 79%)
4- L’hydrogène et l’hélium sont des halogènes
L’affirmation 1 est exacte.
Affirmation 1
Oui.
La molécule d’oxygène, ou simplement « oxygène », est le dioxygène O2.
Affirmation 2
Si.
L’atmosphère est un mélange de divers gaz et de vapeur d’eau.
Affirmation 3
Non.
À savoir par cœur :
F N2 = 79%
F O2 = 21 %
F CO2 = 0% et autres gaz
(Pour les physiologistes = considérée négligeable)
Page 5
Pressions partielles

Sélectionnez les deux affirmations exactes :
1- La pression atmosphérique augmente de manière exponentielle avec l’altitude
2- Niveau mer, la pression atmosphérique, 760 mmHg environ, 100 KPa environ, 1013 hectos Pascal
3- En première approximation, les fractions gazeuses ne varient pas avec l’altitude (ne pas confondre fraction et concentrations gazeuses)
4- La pression partielle due à l’oxygène au niveau de la mer est d’environ 760 mmHg
5- Au niveau de la mer, la pression due à l’azote est d’environ 200 mmHg
6- La pression atmosphérique ne dépend pas de l’humidité ; l’humidité n’a pas d’impact sur la respiration
Les affirmations 2 et 3 sont exactes.
Affirmation 1
Non.
La pression atmosphérique diminue avec l'altitude de manière exponentielle selon la formule du nivellement barométrique.
Niveau de la mer, la pression atmosphérique :
1 atmosphère, 760 mmHg, soit 1013 hectos Pa, soit 1,013 bar,
à 1 000 m :
674 mmHg, 898 hectos Pa,
au niveau de l’Everest :
236 mmHg, 314 hectos Pa.
Affirmation 3
Exact.
La fraction gazeuse d’un gaz est le pourcentage d’un gaz dans un
mélange.
La fraction
gazeuse d’un gaz peut être la même avec l’altitude, mais la concentration de ce
gaz va diminuer si la concentration globale du mélange diminue avec l’altitude.
La
pression est liée à la concentration car due aux impacts moléculaires sur une
surface.
La pression atmosphérique diminue avec la diminution de la concentration du
mélange gazeux atmosphérique en altitude ; les fractions gazeuses,
pourcentages des divers gaz, en ne considérant pas les fluctuations, peuvent
être considérées globalement constantes.
Affirmation 4 et 5
Non.
Pression O2 = 21% de 760 = 160 mmHg
Pression N2 = 79% de 760 = 600 mmHg
Affirmation 6
Si.
Pression totale = Pressions partielles gazeuses + pression partielle vapeur d’eau
La pression partielle de l’oxygène diminue dans un air plus humide : plus difficile de respirer.
Rappels :
- Les gaz sont des molécules en mouvement.
- La pression est due à la collision des molécules gazeuse avec la surface considérée.
- Loi de Dalton : la pression totale est la somme des pressions partielles.
- Tenir compte des fractions gazeuses pour déterminer la pression due à un gaz du mélange.
Page 6
Concentration, température, humidité

Sélectionnez les deux affirmations exactes :
1- La pression partielle de l’oxygène dans les alvéoles pulmonaires est constante
2- Les pressions partielles de l’oxygène dans les alvéoles pulmonaires et dans l’environnement externe sont identiques
3- La pression partielle de l’oxygène dépend de la température et de l’humidité
4- à autres paramètres égaux, il est plus facile de respirer dans de l’air humide
5- [A] : en fin d’expiration et en fin d’inspiration, le débit d’air s’annule : le gradient de pression entre l’intérieur des poumons et l’environnement est nul
Les affirmations 3 et 5 sont exactes.
Affirmations 1 & 2
Non.
Même si elle est tributaire des pressions partielles externes, la pression partielle de l’oxygène à l’intérieur des alvéoles pulmonaires subie l’effet du conditionnement de l’air, température et humidité, apporté par les voix aérienne supérieures.
La pression partielle de l’oxygène diminue avec le passage de l’air dans les VAS (Les cornets des cavités nasales joue le rôle de radiateur et d’humidificateur).
VAS : voix aérienne supérieures.
Affirmation 3
Oui.
Pas de valeur d’eau : pas de pression partielle
Exemples de pressions partielles pour de la vapeur d’eau en saturation 100% :
0m, 25°C : 3 KPa
0m, 37°C : 6 KPa (normal, l’agitation thermique accroît les impacts moléculaire sur la surface considérée)
Affirmation 4
Non.
La
fraction de la vapeur d’eau diminue relativement celle de l’oxygène : une
fraction de la valeurs d’eau plus importante diminue d’autant celle de
l’oxygène.