Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Pile voltaïque
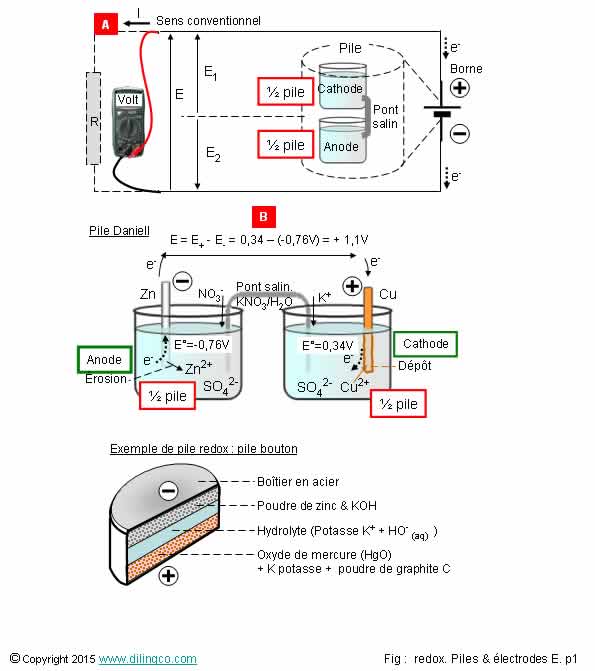
Sélectionner
l’affirmation exacte :
1- Des
réactions d’oxydoréduction ne peuvent pas constituer une pile électrique
2- [A]. Le sens
conventionnel du courant est l’inverse de celui de déplacement des électrons :
le courant conventionnel sort de la pile par la cathode
3- Les
électrons se déplacent dans les solutions et dans le pont électrolytique
4- [B]. E
fem de la pile Daniell = 0,42V
L’affirmation
2 est exacte.
Affirmation
1
Si.
Réaction d’oxydoréduction = échange d’électrons entre un réducteur et un oxydant.
Échange d’électrons = courant électrique.
Énergie
d’échange d’électrons = f.e.m.
f.e.m :
force électromotrice.
Ce sont
les couples redox de chaque ½ pile), reliés par le pont salin électrolytique,
qui constituent la pile.
Affirmation
2
Oui.
[A].
Le sens conventionnel du courant :
- est le
sens de déplacement des charges positives
(L’inverse de celui de déplacement des électrons)
- le
courant conventionnel sort de la pile par la cathode
(Voir la
figure schématisée de la pile)
- le f.e.m.
de la pile est positive, 1,1 v environ, entre le commun et le «+» de la pile.
Affirmation
3
Non.
Les
électrons se déplacent sur les fils externes à la pile (S’ils sont connectés à
un circuit externe).
A l’intérieur
des solutions, la cathode de cuivre fournit des électrons, l’anode de zinc les
attire.
Electrode
Zinc/solution : perte d’électrons = oxydation
Solution/électrode
Cu : gain d’électron = réduction
Ce sont
les ions qui se déplacent dans les solutions et le pont électrolytique.
Affirmation
4
Non.
Force électromotrice E= E1, borne +, – (-0,76), borne -, = +1,1V
Page 2.
Oxydoréduction. Pile
Daniell
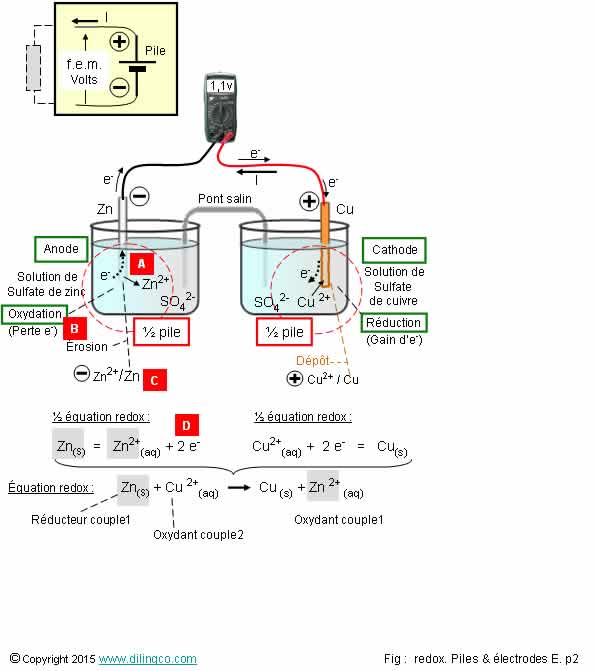
Sélectionner
l’affirmation exacte :
1- [A].
L’électrode en zinc attire les électrons, c’est une anode
2- [B].
Le zinc se réduit
3- [C].
Couple d’oxydoréduction : Zn/Zn2+
4- [D].
Équilibre des charges des ½ équations : 1 électron
L’affirmation
1 est exacte.
Affirmation
2
Non.
[B]. Le
zinc perd des électrons = réducteur (un réducteur « rend » des
électrons).
Le zinc,
réducteur, s’oxyde = réaction d’oxydation.
Une
oxydation est une perte d’électrons.
Revoir le chapitre Couple d’oxydoréduction.
Affirmation
3
Non.
[C]. Par
convention, dans un couple d’oxydoréduction, l’oxydant
doit être nommé en premier : Zn2+/Zn
Page 3.
Mesures des tensions
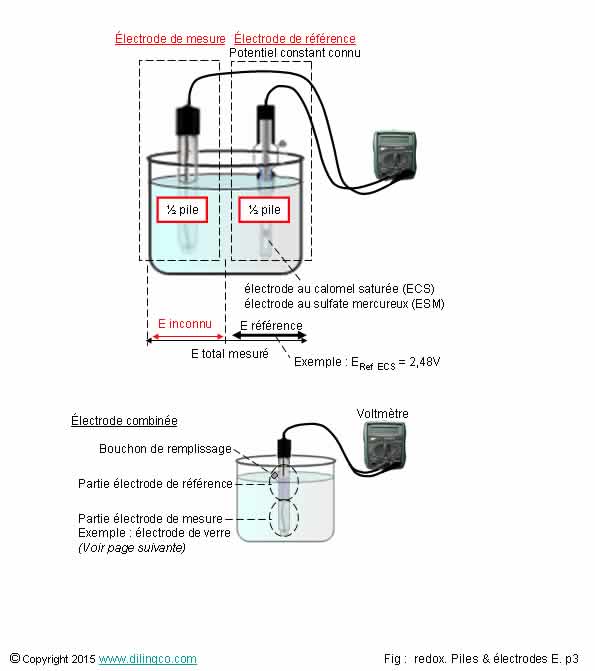
Sélectionner
l’affirmation exacte :
1- Le
choix des électrodes, de référence et de mesure, n’est pas lié à la solution
aqueuse à analyser et aux mesures à effectuer
2- Les
électrodes de référence n’ont pas de bouton de remplissage
3-
Électrode de référence = électrode dont le potentiel redox est fixe et connu
4- Une
électrode combinée ne mesure qu’un potentiel de référence
L’affirmation
3 est exacte.
Affirmation
1
Si.
Le choix
des électrodes, de référence et de mesure, est lié :
- à la
solution aqueuse à analyser,
Certains milieux à mesurer peuvent endommager une électrode de
référence mal choisie !
- aux
mesures à effectuer,
Exemple :
mesurer un pH, prendre une électrode de verre
comme électrode de mesure.
Affirmation
2
Si.
Comme toutes les électrodes de référence, elles ont un bouton de remplissage.
Les électrodes combinées se généralisent pour mesurer un pH.
Affirmation 3
Si.
Electrode de référence :
- son potentiel redox est fixe et connu,
- sert à être l’une des ½ piles d’une pile redox.
Par soustraction au potentiel global, l’électrode de référence permet de
déterminer le potentiel redox côté électrode de mesure.
L’appareil de mesure, voltmètre à haute impédance, donne
le résultat en pH ou concentrations moles/litre.
Affirmation 4
Non.
Une électrode combinée est composée de 2 parties, chacune
constituant une ½ pile redox.
L’électrode combinée transmet les tensions de référence et
à mesurer.
Page 4.
Types d’électrodes
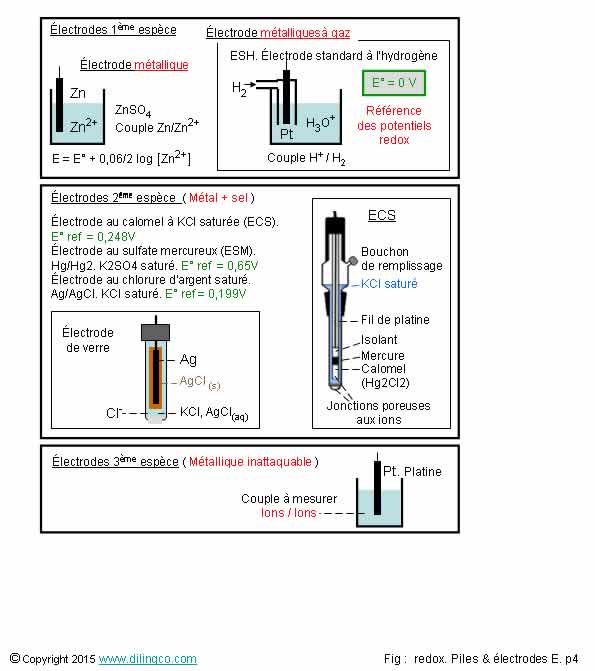
Sélectionner
les deux affirmations exactes :
1-
Electrode métallique de la première espèce : fil métallique inattaquable
dans solution oxydant/réducteur
2- Le
choix des électrodes, de référence et de mesure, est un préalable à
l’utilisation d’un appareil de mesure potentiométrique
3- Le
potentiel d’une électrode de référence n’est pas constant. Il dépend de la
solution aqueuse à mesurer
4- Une
électrode de verre permet de mesurer la concentration de chlore dans une
solution aqueuse
5- ESH,
électrode standard à l’hydrogène, peu pratique, n’est pas communément utilisée
comme électrode de référence dans les laboratoires
6-
Solution à mesurer contenant des ions Ag+ : électrode ECS ou électrode ESM
indifféremment
Les affirmations
2 et 5 sont exactes.
Affirmation 1
Non.
Electrode métallique de la première espèce :
Le métal de l’électrode fait
partie du couple redox et participe à l’oxydoréduction.
Mesure d’un potentiel redox d’une solution aqueuse contenant des
ions du métal de l’électrode métallique.
(Choisir l’électrode en conséquence)
Electrode métallique de la seconde espèce :
Le métal de l’électrode est en équilibre avec un de ses
composés peu soluble. Utilisations autres que le cas suivant.
Electrode métallique de la troisième espèce :
Fil métallique inattaquable plongeant dans une solution d’un
couple oxydant/réducteur d’ions dissous.
Exemple : mesurer la concentration Fe2+/Fe3+.
Affirmation 2
Oui.
Le choix des électrodes, de référence et de mesure, est
lié :
- à la solution aqueuse à analyser,
Certains milieux à mesurer peuvent
endommager une électrode de référence mal choisie,
- au mesures à effectuer,
Exemple : pour mesurer
un pH, prendre une électrode de verre comme électrode de mesure.
Affirmation 3
Non.
Pour servir de référence, une
électrode de référence a un potentiel redox fixe et connu.
Exemple :
Électrode au calomel saturé en KCl :
- une électrode de référence,
- couple redox Hg2Cl2/Hg. Calomel
(Chlorure de mercure/mercure)
- potentiel connu E° = 0,248
V à 25°C.
- la stabilité du potentiel est assurée par la constante
d’équilibre de dissolution d’un KCl très saturé,
- Attention : ne pas
utiliser (détruite !) si la solution à mesurer contient des ion AG+
Affirmation 4
Non.
Une électrode de verre est sensible aux concentrations
de protons H+.
Electrode très utilisée pour mesurer un
pH.
Affirmation 5
Exact.
Aux ESH, ENH, peut pratiques, on préfère les autres
électrodes de référence.
ESH : électrode standard à l’hydrogène,
ENH : … Normale …
Affirmation 6
Non.
Les ions AG+ en présence d’ions Chlore Cl-
précipitent en AgCl et bouchent les jonctions poreuses d’une électrode ECS,
… qui devient bonne pour la poubelle.
IMPERATIF : utiliser une électrode
de référence au sulfate mercureux pour mesurer une solution contenant des ions
Ag+ !!
Électrode
de référence
ECS. Électrode au calomel
saturé en KCl
- Couple redox Hg2Cl2/Hg. Calomel
(Chlorure de mercure/mercure).
- Potentiel E° = 0,248 V
à 25°C.
(E° exprimé en volts par rapport à l’ENH).
- La stabilité du potentiel est assurée par la constante
d’équilibre de dissolution d’un KCl très saturé.
- Attention : ne pas
utiliser (détruite !) si la solution à mesurer contient des ion AG+
ESM. Electrode au sulfate mercureux
- Couple redox Hg/Hg2
- K2SO4 saturé
- Potentiel E° = 0,6513V
à 25°C.
(E° exprimé en volts par rapport à l’ENH).
Electrode au chlorure d’argent
- Couple redox Ag/AgCl saturé
- KCl saturé
- Potentiel E° = 0,197V
à 25°C.
(E° exprimé en volts par rapport à l’ENH).
Page 5.
Dosage d’oxydoréduction
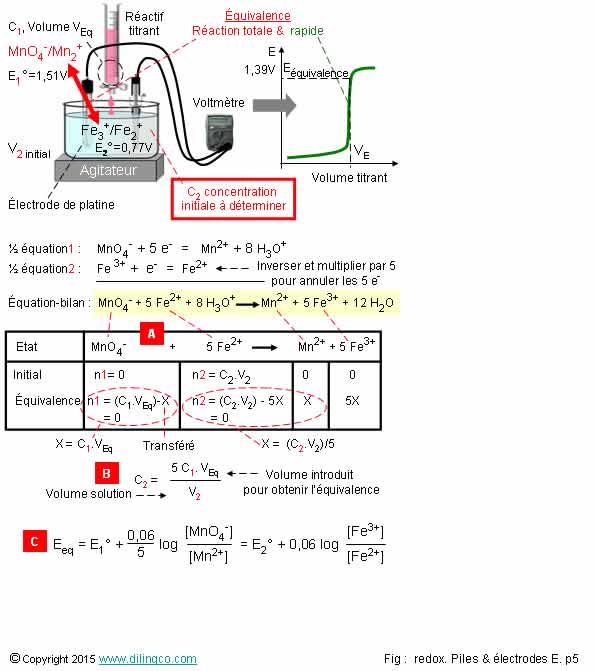
Sélectionner
les deux affirmations exactes :
1-
Dosage : le volume de réactif titrant pour arriver à l’équivalence est
suffisant pour déterminer la concentration à titrer
2- À l’équivalence,
le nombre d’électrons que peut capter l’oxydant = nombre d’électrons que peut
céder le réducteur
3- Formule
de la concentration à titrer : Les coefficients stoechiométriques
n’interviennent pas, la valeur de E mesurée à l’équivalence intervient
4-
Connaissant les concentrations des couples redox de l’équation bilan, on ne
peut pas calculer le f.e.m à l’équivalence. Cette f.e.m ne peut qu’être mesurée
5- Dosage
d’oxydoréduction : l’élément à titrer intervient dans une réaction
d’oxydoréduction
6- Ions
du couple oxydant/réducteur à mesurer tous en solution aqueuse : électrode
de mesure à choisir : électrode de verre
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Non.
En plus
du volume de réactif titrant, il faut la concentration
molaire volumique du titrant.
Affirmation
3
Si, les coefficients stoechiométriques interviennent
dans la formule,
Non, la f.e.m mesurée n’intervient pas.
Le changement brutal de la f.e.m mesurée est seulement un marqueur
indiquant que l’équivalence se produit, et qu’il faut noter VEq, le volume de titrant
versé pour obtenir l’équivalence.
[A].
à l’équivalence :
5
x n (Fe2+) initial = n (MnO4-)introduit
Les
électrons des réactifs sont entièrement transférés (Reste 0).
On en
déduit l’équation [B] :
Concentration
à titrer :
= Coeff.
stoechiométrique x C titrant x volume introduit
Volume de la solution
Logique :
la concentration à titrée est proportionnelle au nombre d’électrons à fournir
pour obtenir l’équivalence (numérateur) par unité de volume (dénominateur).
Affirmation
4
Si.
Connaissant
toutes les concentration des couples redox de l’équation bilan, on peut
calculer le f.e.m à l’équivalence : équation de Nernst.
Voir
figure [C].
Affirmation
6
Non.
Ions du
couple oxydant/réducteur à mesurer tous en solution aqueuse : électrode de
mesure à choisir : électrode métallique inattaquable.
Voir page
précédente, électrode de la 3ème espèce.
Rappel :
Une électrode de verre est sensible aux ions
hydrogène : mesure du pH.
Page
6.
Mesurer un potentiel E°
Sélectionner
les deux affirmations exactes :
1- Il
n’existe pas de tables de potentiel redox standard
2- Le
potentiel d’un couple redox ne dépend pas du contexte chimique (du pH de la
solution par exemple)
3-
Connaissant le potentiel redox du couple donneur et du couple accepteur, on
peut trouver la différence de potentiel redox de la réaction bilan
4- Il
existe des électrodes de référence autres que l’électrode ENH
5- [A].
La tension mesurée correspond au potentiel redox à mesurer
6- [B].
Les couples à potentiels redox positifs élevés : réducteurs forts
7- Pas
besoin d’un pH=0 dans l’électrode normale de l’hydrogène
Les
affirmations 3 et 4 sont exactes.
Affirmation
1
Si.
Il existe de nombreuses tables de potentiel redox standard E°.
En dehors
des conditions standard, mesurer un potentiel
d’oxydoréduction permet de déterminer
la concentration d’un soluté dans une solution.
Affirmation
2
Si.
Le potentiel d’un couple redox dépend de l’environnement.
Exemple :
la photosynthèse utilise la Lumière pour produire de l’énergie.
La loi de Nernst permet de calculer le potentiel
redox en fonction des E° et en dehors des conditions standard.
Voir Calculs potentiel redox E.
Affirmation
3
Oui.
Connaissant
le potentiel redox du couple donneur et du couple accepteur, on peut trouver la
différence de potentiel redox de la réaction d’oxydoréduction globale.
Exemple en
biochimie :
½ équation couple 1: NAD+ + 2H+ + 2 e- = NADH + H+ E0 = – 0,320 V½ équation couple 2 : Acétaldéhyde + 2 H+ + 2 e- = ÉthanolE0 = – 0,197 V
Réaction
redox bilan :
Acétaldéhyde + NADH + H+ => Éthanol + NAD+
Différence
de potentiel redox =
E°
accepteur – E° donneur =
– 0,197 –
(– 0,320) = + 0,123 V
Une f.em.redox bilan positive signifie une réaction favorable.
Affirmation
4
Oui.
Électrode
normale à l’hydrogène E.N.H : électrode
normale à l’hydrogène.
Électrode de calomel saturé E.C.S :
- Calomel :
ancien nom du chlorure de mercure Hg2Cl2,
-
Couple : Hg2Cl2/Hg,
-
potentiel relatif à l’E.N.H : 0,244 V,
- électrode utilisée pour les dosages pH-métriques,
- et la plupart des dosages redox (exceptés où les
ions Cl pourraient réagir avec les composés présents).
Autres
électrodes :
-
électrode de verre, utilisée pour la pH-métrie,
-
électrode combinée,
- …
Affirmation
5
Non.
[A]. La
tension mesurée correspond à la somme E = (E couple redox à mesurer) + (E
couple redox ENH).
La f.e.m
(E couple redox ENH) a été choisie comme tension de référence. Cette tension
est à soustraire à la tension mesurée pour en déduire la tension redox
recherchée.
Affirmation
6
Non.
[B]. Les
couples à potentiels redox positifs élevés :
oxydants forts.
Affirmation
7
Si.
[H+]
= 1mole par litre => pH=0
pH= - log
[H3O+] = - log 1 = 0
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Pile voltaïque

Sélectionner l’affirmation exacte :
1- Des réactions d’oxydoréduction ne peuvent pas constituer une pile électrique
2- [A]. Le sens conventionnel du courant est l’inverse de celui de déplacement des électrons : le courant conventionnel sort de la pile par la cathode
3- Les électrons se déplacent dans les solutions et dans le pont électrolytique
4- [B]. E fem de la pile Daniell = 0,42V
L’affirmation 2 est exacte.
Affirmation 1
Si.
Réaction d’oxydoréduction = échange d’électrons entre un réducteur et un oxydant.
Échange d’électrons = courant électrique.
Énergie d’échange d’électrons = f.e.m.
f.e.m : force électromotrice.
Ce sont les couples redox de chaque ½ pile), reliés par le pont salin électrolytique, qui constituent la pile.
Affirmation 2
Oui.
[A].
Le sens conventionnel du courant :
- est le sens de déplacement des charges positives
(L’inverse de celui de déplacement des électrons)
- le courant conventionnel sort de la pile par la cathode
(Voir la figure schématisée de la pile)
- le f.e.m. de la pile est positive, 1,1 v environ, entre le commun et le «+» de la pile.
Affirmation 3
Non.
Les électrons se déplacent sur les fils externes à la pile (S’ils sont connectés à un circuit externe).
A l’intérieur des solutions, la cathode de cuivre fournit des électrons, l’anode de zinc les attire.
Electrode Zinc/solution : perte d’électrons = oxydation
Solution/électrode Cu : gain d’électron = réduction
Ce sont les ions qui se déplacent dans les solutions et le pont électrolytique.
Affirmation 4
Non.
Force électromotrice E= E1, borne +, – (-0,76), borne -, = +1,1V
Page 2.
Oxydoréduction. Pile Daniell

Sélectionner l’affirmation exacte :
1- [A]. L’électrode en zinc attire les électrons, c’est une anode
2- [B]. Le zinc se réduit
3- [C]. Couple d’oxydoréduction : Zn/Zn2+
4- [D]. Équilibre des charges des ½ équations : 1 électron
L’affirmation 1 est exacte.
Affirmation 2
Non.
[B]. Le zinc perd des électrons = réducteur (un réducteur « rend » des électrons).
Le zinc, réducteur, s’oxyde = réaction d’oxydation.
Une oxydation est une perte d’électrons.
Revoir le chapitre Couple d’oxydoréduction.
Affirmation 3
Non.
[C]. Par convention, dans un couple d’oxydoréduction, l’oxydant doit être nommé en premier : Zn2+/Zn
Page 3.
Mesures des tensions

Sélectionner l’affirmation exacte :
1- Le choix des électrodes, de référence et de mesure, n’est pas lié à la solution aqueuse à analyser et aux mesures à effectuer
2- Les électrodes de référence n’ont pas de bouton de remplissage
3- Électrode de référence = électrode dont le potentiel redox est fixe et connu
4- Une électrode combinée ne mesure qu’un potentiel de référence
L’affirmation 3 est exacte.
Affirmation 1
Si.
Le choix des électrodes, de référence et de mesure, est lié :
- à la solution aqueuse à analyser,
Certains milieux à mesurer peuvent endommager une électrode de référence mal choisie !
- aux mesures à effectuer,
Exemple : mesurer un pH, prendre une électrode de verre comme électrode de mesure.
Affirmation 2
Si.
Comme toutes les électrodes de référence, elles ont un bouton de remplissage.
Les électrodes combinées se généralisent pour mesurer un pH.
Affirmation 3
Si.
Electrode de référence :
- son potentiel redox est fixe et connu,
- sert à être l’une des ½ piles d’une pile redox.
Par soustraction au potentiel global, l’électrode de référence permet de
déterminer le potentiel redox côté électrode de mesure.
L’appareil de mesure, voltmètre à haute impédance, donne le résultat en pH ou concentrations moles/litre.
Affirmation 4
Non.
Une électrode combinée est composée de 2 parties, chacune constituant une ½ pile redox.
L’électrode combinée transmet les tensions de référence et à mesurer.
Page 4.
Types d’électrodes

Sélectionner les deux affirmations exactes :
1- Electrode métallique de la première espèce : fil métallique inattaquable dans solution oxydant/réducteur
2- Le choix des électrodes, de référence et de mesure, est un préalable à l’utilisation d’un appareil de mesure potentiométrique
3- Le potentiel d’une électrode de référence n’est pas constant. Il dépend de la solution aqueuse à mesurer
4- Une électrode de verre permet de mesurer la concentration de chlore dans une solution aqueuse
5- ESH, électrode standard à l’hydrogène, peu pratique, n’est pas communément utilisée comme électrode de référence dans les laboratoires
6- Solution à mesurer contenant des ions Ag+ : électrode ECS ou électrode ESM indifféremment
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
Electrode métallique de la première espèce :
Le métal de l’électrode fait partie du couple redox et participe à l’oxydoréduction.
Mesure d’un potentiel redox d’une solution aqueuse contenant des ions du métal de l’électrode métallique.
(Choisir l’électrode en conséquence)
Electrode métallique de la seconde espèce :
Le métal de l’électrode est en équilibre avec un de ses composés peu soluble. Utilisations autres que le cas suivant.
Electrode métallique de la troisième espèce :
Fil métallique inattaquable plongeant dans une solution d’un couple oxydant/réducteur d’ions dissous.
Exemple : mesurer la concentration Fe2+/Fe3+.
Affirmation 2
Oui.
Le choix des électrodes, de référence et de mesure, est lié :
- à la solution aqueuse à analyser,
Certains milieux à mesurer peuvent endommager une électrode de référence mal choisie,
- au mesures à effectuer,
Exemple : pour mesurer un pH, prendre une électrode de verre comme électrode de mesure.
Affirmation 3
Non.
Pour servir de référence, une électrode de référence a un potentiel redox fixe et connu.
Exemple :
Électrode au calomel saturé en KCl :
- une électrode de référence,
- couple redox Hg2Cl2/Hg. Calomel (Chlorure de mercure/mercure)
- potentiel connu E° = 0,248 V à 25°C.
- la stabilité du potentiel est assurée par la constante d’équilibre de dissolution d’un KCl très saturé,
- Attention : ne pas utiliser (détruite !) si la solution à mesurer contient des ion AG+
Affirmation 4
Non.
Une électrode de verre est sensible aux concentrations de protons H+.
Electrode très utilisée pour mesurer un pH.
Affirmation 5
Exact.
Aux ESH, ENH, peut pratiques, on préfère les autres électrodes de référence.
ESH : électrode standard à l’hydrogène,
ENH : … Normale …
Affirmation 6
Non.
Les ions AG+ en présence d’ions Chlore Cl- précipitent en AgCl et bouchent les jonctions poreuses d’une électrode ECS,
… qui devient bonne pour la poubelle.
IMPERATIF : utiliser une électrode de référence au sulfate mercureux pour mesurer une solution contenant des ions Ag+ !!
Électrode de référence
ECS. Électrode au calomel saturé en KCl
- Couple redox Hg2Cl2/Hg. Calomel (Chlorure de mercure/mercure).
- Potentiel E° = 0,248 V à 25°C.
(E° exprimé en volts par rapport à l’ENH).
- La stabilité du potentiel est assurée par la constante d’équilibre de dissolution d’un KCl très saturé.
- Attention : ne pas utiliser (détruite !) si la solution à mesurer contient des ion AG+
ESM. Electrode au sulfate mercureux
- Couple redox Hg/Hg2
- K2SO4 saturé
- Potentiel E° = 0,6513V à 25°C.
(E° exprimé en volts par rapport à l’ENH).
Electrode au chlorure d’argent
- Couple redox Ag/AgCl saturé
- KCl saturé
- Potentiel E° = 0,197V à 25°C.
(E° exprimé en volts par rapport à l’ENH).
Page 5.
Dosage d’oxydoréduction

Sélectionner les deux affirmations exactes :
1- Dosage : le volume de réactif titrant pour arriver à l’équivalence est suffisant pour déterminer la concentration à titrer
2- À l’équivalence, le nombre d’électrons que peut capter l’oxydant = nombre d’électrons que peut céder le réducteur
3- Formule de la concentration à titrer : Les coefficients stoechiométriques n’interviennent pas, la valeur de E mesurée à l’équivalence intervient
4- Connaissant les concentrations des couples redox de l’équation bilan, on ne peut pas calculer le f.e.m à l’équivalence. Cette f.e.m ne peut qu’être mesurée
5- Dosage d’oxydoréduction : l’élément à titrer intervient dans une réaction d’oxydoréduction
6- Ions du couple oxydant/réducteur à mesurer tous en solution aqueuse : électrode de mesure à choisir : électrode de verre
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
En plus du volume de réactif titrant, il faut la concentration molaire volumique du titrant.
Affirmation 3
Si, les coefficients stoechiométriques interviennent dans la formule,
Non, la f.e.m mesurée n’intervient pas.
Le changement brutal de la f.e.m mesurée est seulement un marqueur indiquant que l’équivalence se produit, et qu’il faut noter VEq, le volume de titrant versé pour obtenir l’équivalence.
[A]. à l’équivalence :
5 x n (Fe2+) initial = n (MnO4-)introduit
Les électrons des réactifs sont entièrement transférés (Reste 0).
On en déduit l’équation [B] :
Concentration à titrer :
= Coeff. stoechiométrique x C titrant x volume introduit
Volume de la solution
Logique : la concentration à titrée est proportionnelle au nombre d’électrons à fournir pour obtenir l’équivalence (numérateur) par unité de volume (dénominateur).
Affirmation 4
Si.
Connaissant toutes les concentration des couples redox de l’équation bilan, on peut calculer le f.e.m à l’équivalence : équation de Nernst.
Voir figure [C].
Affirmation 6
Non.
Ions du couple oxydant/réducteur à mesurer tous en solution aqueuse : électrode de mesure à choisir : électrode métallique inattaquable.
Voir page précédente, électrode de la 3ème espèce.
Rappel :
Une électrode de verre est sensible aux ions hydrogène : mesure du pH.
Page 6.
Mesurer un potentiel E°
Sélectionner les deux affirmations exactes :
1- Il n’existe pas de tables de potentiel redox standard
2- Le potentiel d’un couple redox ne dépend pas du contexte chimique (du pH de la solution par exemple)
3- Connaissant le potentiel redox du couple donneur et du couple accepteur, on peut trouver la différence de potentiel redox de la réaction bilan
4- Il existe des électrodes de référence autres que l’électrode ENH
5- [A]. La tension mesurée correspond au potentiel redox à mesurer
6- [B]. Les couples à potentiels redox positifs élevés : réducteurs forts
7- Pas besoin d’un pH=0 dans l’électrode normale de l’hydrogène
Les affirmations 3 et 4 sont exactes.
Affirmation 1
Si.
Il existe de nombreuses tables de potentiel redox standard E°.
En dehors des conditions standard, mesurer un potentiel d’oxydoréduction permet de déterminer la concentration d’un soluté dans une solution.
Affirmation 2
Si.
Le potentiel d’un couple redox dépend de l’environnement.
Exemple :
la photosynthèse utilise la Lumière pour produire de l’énergie.
La loi de Nernst permet de calculer le potentiel
redox en fonction des E° et en dehors des conditions standard.
Voir Calculs potentiel redox E.
Affirmation 3
Oui.
Connaissant le potentiel redox du couple donneur et du couple accepteur, on peut trouver la différence de potentiel redox de la réaction d’oxydoréduction globale.
Exemple en biochimie :
½ équation couple 1: NAD+ + 2H+ + 2 e- = NADH + H+ E0 = – 0,320 V½ équation couple 2 : Acétaldéhyde + 2 H+ + 2 e- = ÉthanolE0 = – 0,197 V
Réaction redox bilan :
Acétaldéhyde + NADH + H+ => Éthanol + NAD+
Différence de potentiel redox =
E° accepteur – E° donneur =
– 0,197 – (– 0,320) = + 0,123 V
Une f.em.redox bilan positive signifie une réaction favorable.
Affirmation 4
Oui.
Électrode normale à l’hydrogène E.N.H : électrode normale à l’hydrogène.
Électrode de calomel saturé E.C.S :
- Calomel : ancien nom du chlorure de mercure Hg2Cl2,
- Couple : Hg2Cl2/Hg,
- potentiel relatif à l’E.N.H : 0,244 V,
- électrode utilisée pour les dosages pH-métriques,
- et la plupart des dosages redox (exceptés où les ions Cl pourraient réagir avec les composés présents).
Autres électrodes :
- électrode de verre, utilisée pour la pH-métrie,
- électrode combinée,
- …
Affirmation 5
Non.
[A]. La tension mesurée correspond à la somme E = (E couple redox à mesurer) + (E couple redox ENH).
La f.e.m (E couple redox ENH) a été choisie comme tension de référence. Cette tension est à soustraire à la tension mesurée pour en déduire la tension redox recherchée.
Affirmation 6
Non.
[B]. Les couples à potentiels redox positifs élevés : oxydants forts.
Affirmation 7
Si.
[H+] = 1mole par litre => pH=0
pH= - log [H3O+] = - log 1 = 0