Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
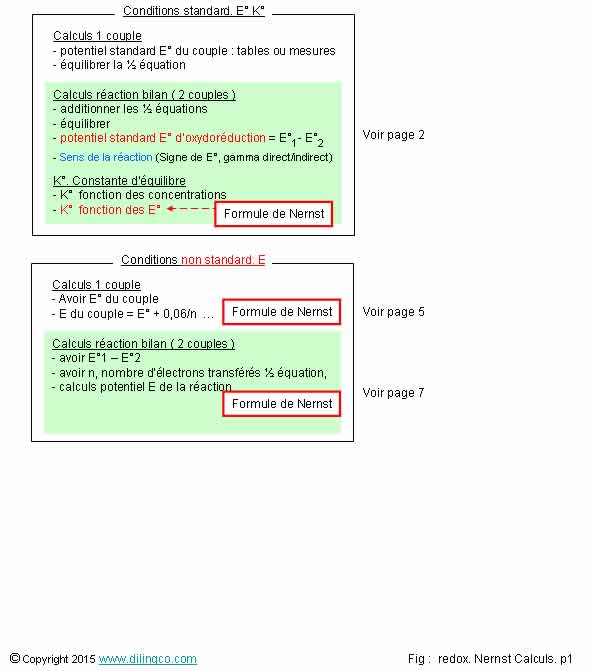
Page 1.
Calculs E°, E,
Q, K, Concentration
Sélectionner
l’affirmation exacte :
1. Les
réactions d’oxydoréduction font intervenir 1 couple redox
2. Une
constante d’équilibre K ne peut pas se calculer à partir des potentiels
standard des couples concernés
3. Les
conditions standard redox impliquent que les
concentrations de tous les ions actifs de la réaction soient à 1 mole/litre
L’affirmation
3 est exacte.
Affirmation
1
Non.
Les réactions d’oxydoréduction font intervenir 2 couples redox.
Première
étape des calculs : trouver et équilibrer les ½ équations
(Couple
concerné, trouver E°, nombre d’électrons échangés, …)
Affirmation
2
Si.
Voir
pages suivantes.
Affirmation
3
Oui.
E°, potentiel
redox standard :
- mesuré
avec une électrode ENH, Electrode normale à l’hydrogène,
(Ou ESH, électrode standard
à l’hydrogène)
- les concentrations de tous les ions actifs de la réaction sont à
1 mole/litre.
-
Température = 25°C,
-
P : 1 atm, pH=0.
Chapitres
connexes
- équilibrer
une ½ réaction par la méthode directe ou par la méthode des nombres
d’oxydation.
- Pile
redox
- Potentiel
standard E°
- Règle
du gamma
Page 2.
Nernst. Conditions non
standard
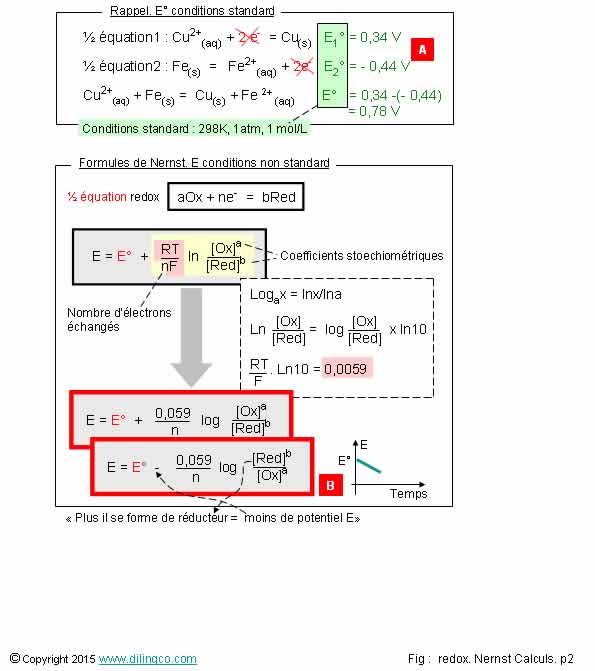
Sélectionner
les deux affirmations exactes :
1. [A]. E°
valides même si les ions réactifs ne sont pas tous en concentration 1 mole/litre
2. Les
coefficients stoechiométriques n’interviennent pas dans l’équation de Nernst
3. Formule
de Nernst : peut s’exprimer en ln, logarithme népérien, ou en log,
logarithme décimal
4. La
formule de Nernst ne concerne que les ½ équations d’oxydoréduction, pas
l’équation redox bilan
5- [B].
La fem d’oxydoréduction diminue à mesure que se forme le réducteur (E = E° - …)
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
Pour déterminer le potentiel redox, tous les ions
participant à la réaction d’oxydoréduction doivent être à 1 mole/litre.
Si tel
n’est pas le cas, la formule de Nernst permet de
calculer le potentiel redox E à partir du potentiel standard E° et des
concentrations.
Affirmation
3
Oui.
La
formule de Nernst, issue de l’enthalpie libre d’un système, peut s’exprimer en :
-
log, logarithme décimal,
E
= E° + 0,059/n log …
-
ln, logarithme népérien,
E = E° + 0,0256/n ln …
Les
constantes approchées ne sont pas les mêmes suivant le logarithme choisi.
Affirmation
4
Si.
La
formule de Nernst concerne les ½ équations et l’équation bilan d’oxydoréduction
(Voir pages suivantes)
Les équations de Nernst exprimées en log décimal, pour une ½
redox et pour une équation bilan, sont à retenir par cœur.
Affirmation
5
Oui.
[B]. La fem
d’oxydoréduction diminue à mesure que se forme le réducteur
Rappel :
Un réducteur s’oxyde en perdant des électrons.
[Réducteur] augmente = moins d’électrons disponibles = moins de force électromotrice.
Paramètres
de la formule de Nernst
E :
Potentiel redox en Volt
E° :
Potentiel redox standard en Volt
R :
constante des gaz parfaits (8,3145 J. mol-1. k-1)
T :
température en Kelvin
F :
Constante de Faraday (96 485 C. mol-1)
N:
nombre d’électrons échangés
Page 3.
Nernst. Valeurs des
paramètres
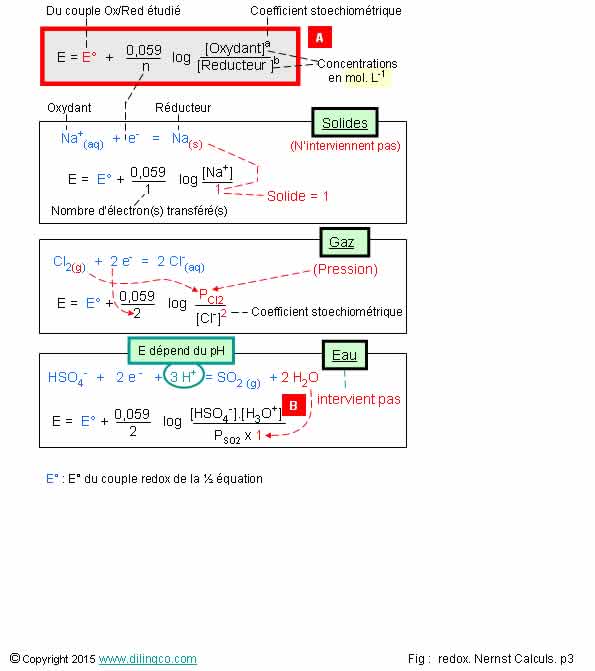
Sélectionner
l’affirmation exacte :
1- [A].
[Réducteur] / [Oxydant]
2- La
concentration des solides et l’eau (H2O), interviennent dans la formule de Nernst
3- Si des
ions H+ interviennent dans une ½ équation le potentiel E dépend du pH
4- [B].
Concentration oxonium au carré
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A]. « E°
+ … » = [Oxydant] / [Réducteur]
Affirmation
2
Non.
Les solides et l’eau (H2O), n’interviennent pas dans la
formule de Nernst
(Concentration
= 1)
Pour un gaz, la pression intervient.
Elle est
à mentionner en atm ou en bar. 1 bar = 105 Pa.
Affirmation
4
Non.
[A].
Concentration oxonium puissance du coefficient stoechométrique.
[H3O+]3
Page 4.
Potentiel E° d’une équation
bilan
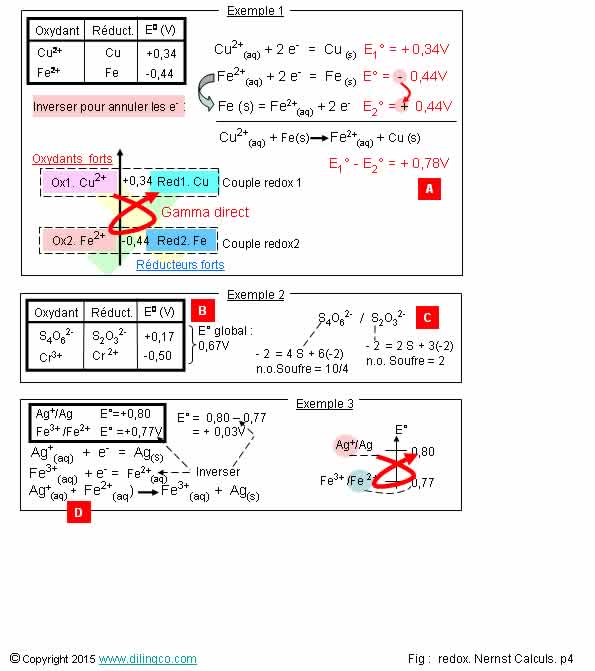
Sélectionner
les deux affirmations exactes :
1. [A]. E°
de la réaction d’oxydoréduction bilan = - 0,1 Volt
2. [B]. E°
de la réaction d’oxydoréduction = + 0,67 Volt
3. [C]. S2O3
est l’oxydant du couple
4. [C]. Le
nombre d’oxydation de l’atome de soufre ne varie pas dans la ½ réaction du
couple redox présenté
5. [D]. Fe2+
est le réducteur. Ag2+ est l’oxydant
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Non.
[A]. E°
de la réaction d’oxydoréduction = + 0,78 Volt
f.e.m
positive : la réaction d’oxydoréduction est spontanée.
Voir Pile
redox
Affirmation
2
Oui.
[A]. E°
de la réaction d’oxydoréduction = + 0,78 Volt
Comme
pour le premier exemple, l’inversion, pour cause d’annulation des électrons
échangés, entraîne l’inversion du signe de tension.
Affirmation
3
Non.
Par convention, le premier mentionné dans un couple redox est
l’oxydant du couple.
Affirmation
4
Si.
[C].
Dans un
couple redox, un des atomes au moins a son nombre d’oxydation qui varie lors de
l’oxydoréduction.
Dans le
couple présenté, l’atome de soufre a un n.o. qui varie :
- S4O62- :
n.o = 10/4
(Valeur
moyenne qui traduit que les atomes de soufre n’ont pas tous le même n.o.)
-
S2O32- : n.o = 2
Dans
le couple S4O62- / S2O32-
Le
premier élément S4O62- est
l’oxydant :
- Par
convention mentionné en premier,
- a une
charge positive (manque d’électrons) supérieure au second.
Voir Nombre
d’oxydation
Affirmation
5
Oui.
[D].
Couple1 oxydant/réducteur, Ag+/Ag
Couple2 oxydant/réducteur, Fe3+/Fe2+
Dans un couple redox, par convention, l’oxydant est mentionné à
gauche.
Dans l’équation
bilan :
Ag+
est l’oxydant.
Fe2+
est le réducteur.
L’oxydant le plus fort réagit avec le réducteur le plus fort.
Le gamma,
sens direct, montre que l’oxydoréduction telle qu’écrite est favorable.
Conseils
- écrire
les ½ équations dans l’ordre d’importance de leur potentiel redox
(Exemple
3 : ½ équation Ag en premier)
- Pour
annuler le e-, la ½ équation 2 doit être inversée = inversion de sa valeur E2°
dans E1° -(-E2°)
- faire
le diagramme du gamma.
Page 5.
Calculs Potentiel E. ½
équations

Sélectionner
l’affirmation exacte :
1- [A]. Log
(og ([Oxydant]/[Réducteur]) => (E = E° - log … )
2- [B]. Log
(2/0,5)
3- [C]. On
peut déduire : potentiel standard E° du couple = 0,77 Volt, n=1 électron échangé
(0,06/1) et que Log ([Red]/[Ox]), signe «-» de l’équation
4- E =
0,71 V
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A]. à se
rappeler par cœur :
Log [Oxydant]/[Réducteur] => E+E° + log …
Affirmation
2
Non.
[B]. Log
(5 / [0,5]2)
-
mentionner les pressions pour les gaz,
- ne pas
oublier les coefficients stoechiométriques.
Affirmation
3
Oui.
[C].
Couple Fe3+/Fe2+
La forme
oxydée est Fe3+
La forme
réduite est Fe2+
Rappels :
Une oxydation est une perte d’électrons.
Un réducteur s’oxyde.
Page 6.
Potentiel E d’oxydoréduction
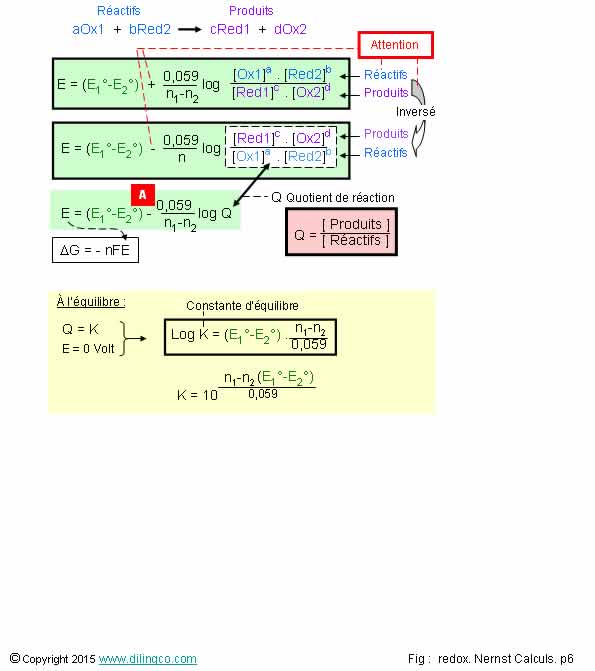
Sélectionner
l’affirmation exacte :
1- Pas de
variation d’enthalpie libre pour les oxydoréductions
2- [A]. E
= (E1°- E2°) – … log Q
3- À
l’équilibre chimique, les couples redox d’oxydoréduction d’une solution aqueuse
ont des potentiels différents
4- Il
faut les concentrations pour trouver la constante d’équilibre d’une
oxydoréduction
L’affirmation
2 est exacte.
Affirmation
1
Si.
Il y a variation
d’ enthalpie libre, variation d’énergie, lors d’une oxydoréduction :
ΔG° = - nFE°
F : constante de Faraday = 96 500 Coulomb(Charge d’une mole d’électrons)n: nombre d’électrons échangés dans les ½ équations.
Affirmation
3
Non.
A l’équilibre chimique, tous les couples redox présents dans la
solution ont le même potentiel.
Affirmation
4
Non.
Les
potentiels standard des 2 couples redox et n, nombre d’électrons échangés dans
l’écriture des équations, suffisent à trouver la constante d’équilibre.
Note :
On peut
aussi trouver la constante d’équilibre connaissant les concentrations.
Voir loi
d’action des masses.
Page 7.
Calculs E. Équation
bilan
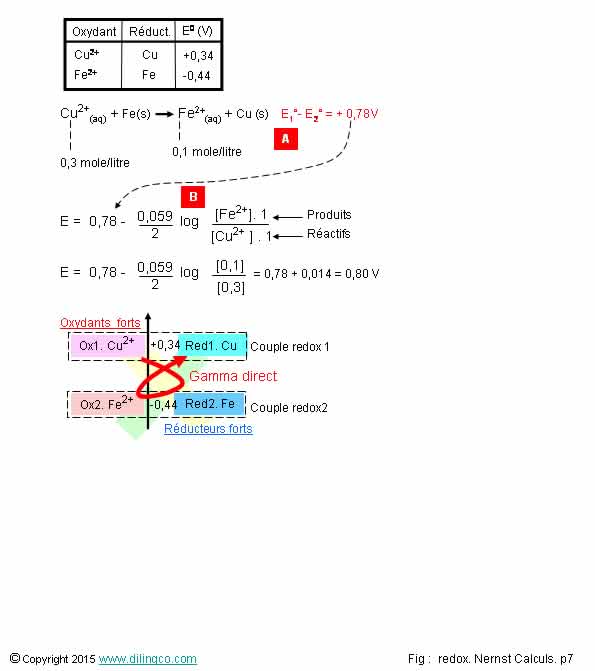
Sélectionner
l’affirmation exacte :
1- [A].
Les quantités de Cu et de fer (état solide) sont à connaître pour pouvoir
calculer le potentiel redox
2- Le nombre
d’électrons échangés n lors de la réaction d’oxydoréduction n’est pas utile
pour pouvoir calculer E avec la formule de Nernst
3- [B].
Log [0,1]/[0,3]
4-
Concentrations relatives oxydant1/oxydant2 en faveur de l’oxydant1 : la
réaction vers la droite sera défavorisée (et le potentiel E inférieur à E°)
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A]. Les
quantités de Cu et de fer (état solide)
n’interviennent pas dans la formule de Nernst.
Note :
- Dans
cet exemple d’équation bilan, l’expression du Log est très simple :
Log ([Fe2+]/[Cu2+])
- le signe « - … » implique : Log ([Produit]/[Réactif])
Affirmation
2
Si.
Nombre
d’électrons échangés lors de la réaction = n
0,0059/n
Affirmation
4
Non.
La
réaction telle qu’exprimée reste dans le sens gamma direct :
thermodynamiquement favorisée.
Relativement
plus d’oxydant1 que d’oxydant2 (0,3 mole/Litre pour 0,1 mole/litre) :
d’après le principe de Le Chapelier, la réaction tendra produire plus de
celui-ci; le potentiel E supérieur à E°.
Page 8.
K équilibre. Potentiel.
Enthalpie G

Sélectionner
l’affirmation exacte :
1- [A].
Nombre d’électrons échangés : n=4
2- [A].
E1° > E2°, le meilleur oxydant réagit avec le meilleur réducteur : (E1°
- E2°) > 0 = réaction spontanée
3- Les
concentrations sont indispensables pour calculer la constante d’équilibre d’une
oxydoréduction
4-
L’enthalpie libre peut se calculer à partir du potentiel redox mais pas à
partir de la constante d’équilibre
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A].
Nombre d’électrons échangés : n=2
(Récrire
les ½ équations pour vérifier)
Affirmation
2
Oui.
[A]. E1°
> E2° : Le meilleur oxydant réagit avec le meilleur réducteur & K
est très importante : réaction spontanée.
Si nécessaire à la compréhension, porter les 2 couples, avec leur E°, sur un Gamma.
Affirmation
3
Non.
Les
potentiels standard des 2 couples redox et n, nombre d’électrons échangés dans
l’écriture des équations, suffisent à trouver la constante d’équilibre.
Note :
On peut
aussi déterminer la constante d’équilibre à partir des concentrations.
Voir loi
d’action des masses.
Affirmation
4
Si.
L’enthalpie
libre peut se calculer :
- à
partir du potentiel d’oxydoréduction : -n
(E1°-E1°) F
- à
partir de la constante d’équilibre : - RT ln
K°
Voir
figure exemple 2.
Page 9.
K concentrations. K
potentiels

Sélectionner
les deux affirmations exactes :
1- [A].
Le réducteur cède 2 électrons à l’oxydant (D’après le calcul de la variation de
n.o)
2- [B].
Pour éliminer les électrons : multiplier la première ½ équation par 2 et
par 5 la deuxième ½ équation
3- [C].
Q= [Réactifs] / [Produits]
4- La
constante d’équilibre K° est proportionnelle à la différence des potentiels
standard E° des couples
5- La
constante d’équilibre K° varie en fonction des concentrations lors de
l’oxydoréduction
Les affirmations
2 et 4 sont exactes.
Affirmation
1
Non.
[A].
D’après le calcul de la variation de n.o, le réducteur cède 5 électrons à
l’oxydant :
n.o. de
l’atome Mn dans l’oxydant :
(n.o. Mn)
+ 4x-2 = -1
n.o. Mn =
+ 7
n.o. de
l’atome Mn dans le réducteur :
n.o. Mn =
+ 2
Différence
de 5 charges « + » entre l’oxydant et le réducteur :
Rajouter
5 e- à l’oxydant pour équilibrer, en charges, la réduction.
Affirmation
3
Non.
[C]. Q=
[Produits] / [Réactifs]
Mnémotechnique :
En sens
direct, le coefficient réactionnel augmente à
mesure que l’oxydoréduction produit … des produits.
Affirmation
5
Non.
La
constante d’équilibre K° est une constante et donc ne varie pas.
Le coefficient de réaction Q varie en fonction des concentrations, pour atteindre l’équilibre K,
lors de l’oxydoréduction.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Calculs E°, E, Q, K, Concentration

Sélectionner l’affirmation exacte :
1. Les réactions d’oxydoréduction font intervenir 1 couple redox
2. Une constante d’équilibre K ne peut pas se calculer à partir des potentiels standard des couples concernés
3. Les conditions standard redox impliquent que les concentrations de tous les ions actifs de la réaction soient à 1 mole/litre
L’affirmation 3 est exacte.
Affirmation 1
Non.
Les réactions d’oxydoréduction font intervenir 2 couples redox.
Première étape des calculs : trouver et équilibrer les ½ équations
(Couple concerné, trouver E°, nombre d’électrons échangés, …)
Affirmation 2
Si.
Voir pages suivantes.
Affirmation 3
Oui.
E°, potentiel redox standard :
- mesuré avec une électrode ENH, Electrode normale à l’hydrogène,
(Ou ESH, électrode standard à l’hydrogène)
- les concentrations de tous les ions actifs de la réaction sont à 1 mole/litre.
- Température = 25°C,
- P : 1 atm, pH=0.
Chapitres connexes
- équilibrer une ½ réaction par la méthode directe ou par la méthode des nombres d’oxydation.
- Pile redox
- Potentiel standard E°
- Règle du gamma
Page 2.
Nernst. Conditions non standard

Sélectionner les deux affirmations exactes :
1. [A]. E° valides même si les ions réactifs ne sont pas tous en concentration 1 mole/litre
2. Les coefficients stoechiométriques n’interviennent pas dans l’équation de Nernst
3. Formule de Nernst : peut s’exprimer en ln, logarithme népérien, ou en log, logarithme décimal
4. La formule de Nernst ne concerne que les ½ équations d’oxydoréduction, pas l’équation redox bilan
5- [B]. La fem d’oxydoréduction diminue à mesure que se forme le réducteur (E = E° - …)
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Pour déterminer le potentiel redox, tous les ions participant à la réaction d’oxydoréduction doivent être à 1 mole/litre.
Si tel n’est pas le cas, la formule de Nernst permet de calculer le potentiel redox E à partir du potentiel standard E° et des concentrations.
Affirmation 3
Oui.
La formule de Nernst, issue de l’enthalpie libre d’un système, peut s’exprimer en :
- log, logarithme décimal,
E = E° + 0,059/n log …
- ln, logarithme népérien,
E = E° + 0,0256/n ln …
Les constantes approchées ne sont pas les mêmes suivant le logarithme choisi.
Affirmation 4
Si.
La formule de Nernst concerne les ½ équations et l’équation bilan d’oxydoréduction (Voir pages suivantes)
Les équations de Nernst exprimées en log décimal, pour une ½ redox et pour une équation bilan, sont à retenir par cœur.
Affirmation 5
Oui.
[B]. La fem d’oxydoréduction diminue à mesure que se forme le réducteur
Rappel :
Un réducteur s’oxyde en perdant des électrons.
[Réducteur] augmente = moins d’électrons disponibles = moins de force électromotrice.
Paramètres de la formule de Nernst
E : Potentiel redox en Volt
E° : Potentiel redox standard en Volt
R : constante des gaz parfaits (8,3145 J. mol-1. k-1)
T : température en Kelvin
F : Constante de Faraday (96 485 C. mol-1)
N: nombre d’électrons échangés
Page 3.
Nernst. Valeurs des paramètres

Sélectionner l’affirmation exacte :
1- [A]. [Réducteur] / [Oxydant]
2- La concentration des solides et l’eau (H2O), interviennent dans la formule de Nernst
3- Si des ions H+ interviennent dans une ½ équation le potentiel E dépend du pH
4- [B]. Concentration oxonium au carré
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A]. « E° + … » = [Oxydant] / [Réducteur]
Affirmation 2
Non.
Les solides et l’eau (H2O), n’interviennent pas dans la formule de Nernst
(Concentration = 1)
Pour un gaz, la pression intervient.
Elle est à mentionner en atm ou en bar. 1 bar = 105 Pa.
Affirmation 4
Non.
[A]. Concentration oxonium puissance du coefficient stoechométrique.
[H3O+]3
Page 4.
Potentiel E° d’une équation bilan

Sélectionner les deux affirmations exactes :
1. [A]. E° de la réaction d’oxydoréduction bilan = - 0,1 Volt
2. [B]. E° de la réaction d’oxydoréduction = + 0,67 Volt
3. [C]. S2O3 est l’oxydant du couple
4. [C]. Le nombre d’oxydation de l’atome de soufre ne varie pas dans la ½ réaction du couple redox présenté
5. [D]. Fe2+ est le réducteur. Ag2+ est l’oxydant
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
[A]. E° de la réaction d’oxydoréduction = + 0,78 Volt
f.e.m positive : la réaction d’oxydoréduction est spontanée.
Voir Pile redox
Affirmation 2
Oui.
[A]. E° de la réaction d’oxydoréduction = + 0,78 Volt
Comme pour le premier exemple, l’inversion, pour cause d’annulation des électrons échangés, entraîne l’inversion du signe de tension.
Affirmation 3
Non.
Par convention, le premier mentionné dans un couple redox est l’oxydant du couple.
Affirmation 4
Si.
[C].
Dans un couple redox, un des atomes au moins a son nombre d’oxydation qui varie lors de l’oxydoréduction.
Dans le couple présenté, l’atome de soufre a un n.o. qui varie :
- S4O62- : n.o = 10/4
(Valeur moyenne qui traduit que les atomes de soufre n’ont pas tous le même n.o.)
- S2O32- : n.o = 2
Dans le couple S4O62- / S2O32-
Le premier élément S4O62- est l’oxydant :
- Par convention mentionné en premier,
- a une charge positive (manque d’électrons) supérieure au second.
Voir Nombre d’oxydation
Affirmation 5
Oui.
[D].
Couple1 oxydant/réducteur, Ag+/Ag
Couple2 oxydant/réducteur, Fe3+/Fe2+
Dans un couple redox, par convention, l’oxydant est mentionné à gauche.
Dans l’équation bilan :
Ag+ est l’oxydant.
Fe2+ est le réducteur.
L’oxydant le plus fort réagit avec le réducteur le plus fort.
Le gamma, sens direct, montre que l’oxydoréduction telle qu’écrite est favorable.
Conseils
- écrire les ½ équations dans l’ordre d’importance de leur potentiel redox
(Exemple 3 : ½ équation Ag en premier)
- Pour annuler le e-, la ½ équation 2 doit être inversée = inversion de sa valeur E2° dans E1° -(-E2°)
- faire le diagramme du gamma.
Page 5.
Calculs Potentiel E. ½ équations

Sélectionner l’affirmation exacte :
1- [A]. Log (og ([Oxydant]/[Réducteur]) => (E = E° - log … )
2- [B]. Log (2/0,5)
3- [C]. On peut déduire : potentiel standard E° du couple = 0,77 Volt, n=1 électron échangé (0,06/1) et que Log ([Red]/[Ox]), signe «-» de l’équation
4- E = 0,71 V
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A]. à se rappeler par cœur :
Log [Oxydant]/[Réducteur] => E+E° + log …
Affirmation 2
Non.
[B]. Log (5 / [0,5]2)
- mentionner les pressions pour les gaz,
- ne pas oublier les coefficients stoechiométriques.
Affirmation 3
Oui.
[C]. Couple Fe3+/Fe2+
La forme oxydée est Fe3+
La forme réduite est Fe2+
Rappels :
Une oxydation est une perte d’électrons.
Un réducteur s’oxyde.
Page 6.
Potentiel E d’oxydoréduction

Sélectionner l’affirmation exacte :
1- Pas de variation d’enthalpie libre pour les oxydoréductions
2- [A]. E = (E1°- E2°) – … log Q
3- À l’équilibre chimique, les couples redox d’oxydoréduction d’une solution aqueuse ont des potentiels différents
4- Il faut les concentrations pour trouver la constante d’équilibre d’une oxydoréduction
L’affirmation 2 est exacte.
Affirmation 1
Si.
Il y a variation d’ enthalpie libre, variation d’énergie, lors d’une oxydoréduction :
ΔG° = - nFE°
F : constante de Faraday = 96 500 Coulomb(Charge d’une mole d’électrons)n: nombre d’électrons échangés dans les ½ équations.
Affirmation 3
Non.
A l’équilibre chimique, tous les couples redox présents dans la solution ont le même potentiel.
Affirmation 4
Non.
Les potentiels standard des 2 couples redox et n, nombre d’électrons échangés dans l’écriture des équations, suffisent à trouver la constante d’équilibre.
Note :
On peut aussi trouver la constante d’équilibre connaissant les concentrations.
Voir loi d’action des masses.
Page 7.
Calculs E. Équation bilan

Sélectionner l’affirmation exacte :
1- [A]. Les quantités de Cu et de fer (état solide) sont à connaître pour pouvoir calculer le potentiel redox
2- Le nombre d’électrons échangés n lors de la réaction d’oxydoréduction n’est pas utile pour pouvoir calculer E avec la formule de Nernst
3- [B]. Log [0,1]/[0,3]
4- Concentrations relatives oxydant1/oxydant2 en faveur de l’oxydant1 : la réaction vers la droite sera défavorisée (et le potentiel E inférieur à E°)
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A]. Les quantités de Cu et de fer (état solide) n’interviennent pas dans la formule de Nernst.
Note :
- Dans cet exemple d’équation bilan, l’expression du Log est très simple :
Log ([Fe2+]/[Cu2+])
- le signe « - … » implique : Log ([Produit]/[Réactif])
Affirmation 2
Si.
Nombre d’électrons échangés lors de la réaction = n
0,0059/n
Affirmation 4
Non.
La réaction telle qu’exprimée reste dans le sens gamma direct : thermodynamiquement favorisée.
Relativement plus d’oxydant1 que d’oxydant2 (0,3 mole/Litre pour 0,1 mole/litre) : d’après le principe de Le Chapelier, la réaction tendra produire plus de celui-ci; le potentiel E supérieur à E°.
Page 8.
K équilibre. Potentiel. Enthalpie G

Sélectionner l’affirmation exacte :
1- [A]. Nombre d’électrons échangés : n=4
2- [A]. E1° > E2°, le meilleur oxydant réagit avec le meilleur réducteur : (E1° - E2°) > 0 = réaction spontanée
3- Les concentrations sont indispensables pour calculer la constante d’équilibre d’une oxydoréduction
4- L’enthalpie libre peut se calculer à partir du potentiel redox mais pas à partir de la constante d’équilibre
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A]. Nombre d’électrons échangés : n=2
(Récrire les ½ équations pour vérifier)
Affirmation 2
Oui.
[A]. E1°
> E2° : Le meilleur oxydant réagit avec le meilleur réducteur & K
est très importante : réaction spontanée.
Si nécessaire à la compréhension, porter les 2 couples, avec leur E°, sur un Gamma.
Affirmation 3
Non.
Les potentiels standard des 2 couples redox et n, nombre d’électrons échangés dans l’écriture des équations, suffisent à trouver la constante d’équilibre.
Note :
On peut aussi déterminer la constante d’équilibre à partir des concentrations.
Voir loi d’action des masses.
Affirmation 4
Si.
L’enthalpie libre peut se calculer :
- à partir du potentiel d’oxydoréduction : -n (E1°-E1°) F
- à partir de la constante d’équilibre : - RT ln K°
Voir figure exemple 2.
Page 9.
K concentrations. K potentiels

Sélectionner les deux affirmations exactes :
1- [A]. Le réducteur cède 2 électrons à l’oxydant (D’après le calcul de la variation de n.o)
2- [B]. Pour éliminer les électrons : multiplier la première ½ équation par 2 et par 5 la deuxième ½ équation
3- [C]. Q= [Réactifs] / [Produits]
4- La constante d’équilibre K° est proportionnelle à la différence des potentiels standard E° des couples
5- La constante d’équilibre K° varie en fonction des concentrations lors de l’oxydoréduction
Les affirmations 2 et 4 sont exactes.
Affirmation 1
Non.
[A]. D’après le calcul de la variation de n.o, le réducteur cède 5 électrons à l’oxydant :
n.o. de l’atome Mn dans l’oxydant :
(n.o. Mn) + 4x-2 = -1
n.o. Mn = + 7
n.o. de l’atome Mn dans le réducteur :
n.o. Mn = + 2
Différence de 5 charges « + » entre l’oxydant et le réducteur :
Rajouter 5 e- à l’oxydant pour équilibrer, en charges, la réduction.
Affirmation 3
Non.
[C]. Q= [Produits] / [Réactifs]
Mnémotechnique :
En sens direct, le coefficient réactionnel augmente à mesure que l’oxydoréduction produit … des produits.
Affirmation 5
Non.
La constante d’équilibre K° est une constante et donc ne varie pas.
Le coefficient de réaction Q varie en fonction des concentrations, pour atteindre l’équilibre K, lors de l’oxydoréduction.