Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Oxydations &
réductions. Exemples
Sélectionner
l’affirmation exacte :
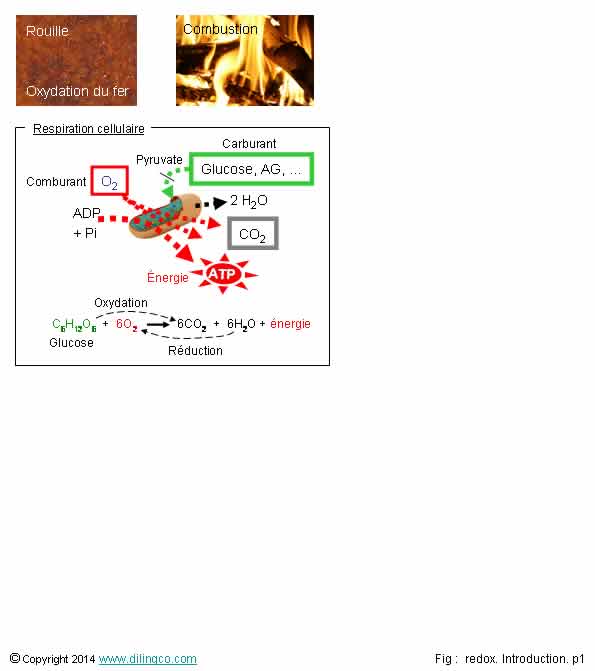
1- La
rouille (hydroxyde et oxyde de fer), résultat de la corrosion du fer en
présence d’oxygène et d’eau, à une composition chimique plus simple que le fer
2- Une
combustion est une réaction endothermique
3-
Respiration cellulaire : réaction d’oxydoréduction qui fournit à une
cellule l’énergie nécessaire à son fonctionnement
4-
Métabolisme des glucides dans l’organisme : gains successifs d’électrons
L’affirmation
3 est exacte.
Affirmation
1
Non.
La corrosion du fer est une oxydation lente qui forme des structures à base
de Fe(OH)3, Fe2O3, plus ou moins stables,
cristallisées, hydratées.
Affirmation
2
Non.
Combustion :
-
réaction exothermique (Qui produit de la chaleur),
-
réaction d’oxydoréduction entre 2 réactifs (un
combustible et un comburant),
-
déclenchée par une énergie d’activation (Exemples : de la chaleur, flamme,
pression, …),
- une
réaction en chaîne de rupture de liaisons chimiques produit des radicaux
libres.
Combustibles :
-
solides, liquides, gaz, métaux, …
-
exemples : bois, PVC, essence, butane, fer, magnésium, …
Comburant :
par exemple le dioxygène de l’air.
Affirmation
3
Oui.
Respiration
cellulaire :
- réaction
d’oxydoréduction
- entre
un carburant : glucose, acide gras, autres molécules organiques (acides
aminés, corps cétoniques),
- un
comburant : O2,
-
Produits : énergie (ATP), CO2, H2O, …
Affirmation
4
Non.
Le
métabolisme (catabolisme) des glucides correspond des oxydations du glucose, pertes d’électrons, qui
fournissent de l’énergie.
Note :
La perte d’un atome d’hydrogène correspond à une perte d’un
électron.
Etapes du
catabolisme du glucose dans l’organisme
Les glucides
sont transformés en glucose par le foie.
Voir Physiologie
digestive
Le
glucose peut être stocké sous forme de glycogène, ou dégradé, oxydé, lors de la
respiration cellulaire.
Oxydation du
glucose : perte d’électrons (ou d’atome H) et création d’énergie.
3 étapes
de la respiration cellulaire :
- la
glycolyse, le glucose est oxydé en pyruvate.
La glycolyse se fait dans le cytoplasme de la cellule, en anaérobie (Sans
oxygène),
- le
cycle de Krebs,
- la
chaîne respiratoire.
Voir :
- Catabolisme
des glucides : pertes successives d’électrons.
- Métabolisme
des lipides
- Métabolisme
composés azotés
Page 2.
Définitions
Sélectionner
l’affirmation exacte :
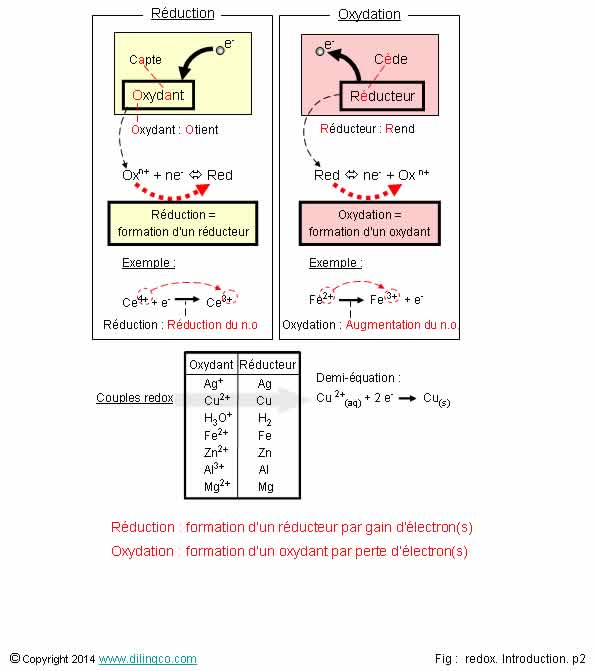
1- Une
oxydation est un gain d’électron(s)
2- Un
oxydant s’oxyde ; un réducteur se réduit
3- Une
oxydation est la formation d’un oxydant
4- Dans
le couple AG+/Ag, Ag est l’oxydant
L’affirmation
3 est exacte.
Il est important de mémoriser les définitions : oxydant,
réducteur, oxydation, réduction.
Affirmation
1
Non.
Oxydation = perte d’électrons
Réduction = gain d’électrons.
Affirmation 2
Non.
Attention piège ! : Un oxydant s’oxyde ; un réducteur se réduit
Mnémonique :
Un oxydant se réduit, un réducteur s’oxyde.
Un oxydant obtient
des électrons
Un réducteur rend
des électrons.
Affirmation
3
Oui.
Une oxydation est la formation d’un oxydant à partir d’un réducteur qui s’est
oxydé en perdant un ou des électrons.
Une réduction est la formation d’un réducteur à partir d’un oxydant qui s’est réduit en gagnant un ou
des électrons.
Note :
Le nombre
d’oxydation (n.o.) lié à l’état d’oxydation de l’élément chimique est présenté
au chapitre suivant.
Affirmation
4
Non.
Dans un
couple redox, le premier désigné est toujours
l’oxydant et le second le
réducteur.
Exemple :
Fe 3+/Fe 2+, Fe3+ est l’oxydant, Fe2+
le réducteur.
La
vérification est, pour un ion, simple facile :
Fe3+
+ e-
= Fe 2+
L’oxydant Fe3+ obtient un électron se réduire en réducteur Fe2+
(réducteur qui à l’inverse, en « rendant » un électron, forme un oxydant)
Comme
pour les couples acide/base, les couples redox sont formés de 2 espèces chimiques conjuguées.
Espèces conjuguées
redox : on passe d’une espèces à l’autre par gain ou perte d’électron(s).
Page 3.
Réaction d’oxydoréduction
Lors d’une réaction d’oxydoréduction, …
Sélectionner
les deux affirmations exactes :
1- Les
électrons « rendus » par le réducteur disparaissent dans la nature
2- [A].
Le réducteur s’est réduit. L’oxydant s’est oxydé
3- Il y a
échange d’électrons entre 2 couples redox Ox1-Red1 et Ox2/Red2 (Le réducteur1
rend un électron à l’oxydant2)
4- Une
réaction de réduction est une perte d’électron(s)
5- La
perte d’électron peut provenir de la perte d’un atome d’hydrogène
6- La
réaction peut se faire entre 2 oxydants ou entre 2 réducteurs
7- L’échange
d’électrons se fait entre réducteur et oxydant de chaque couple respectif
Les
affirmations 3 et 5 sont exactes.
Affirmation
1
Non.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
Les
électrons « rendus »
par le réducteur sont récupérés
par l’oxydant qui les « obtient ».
Affirmation
2
Non.
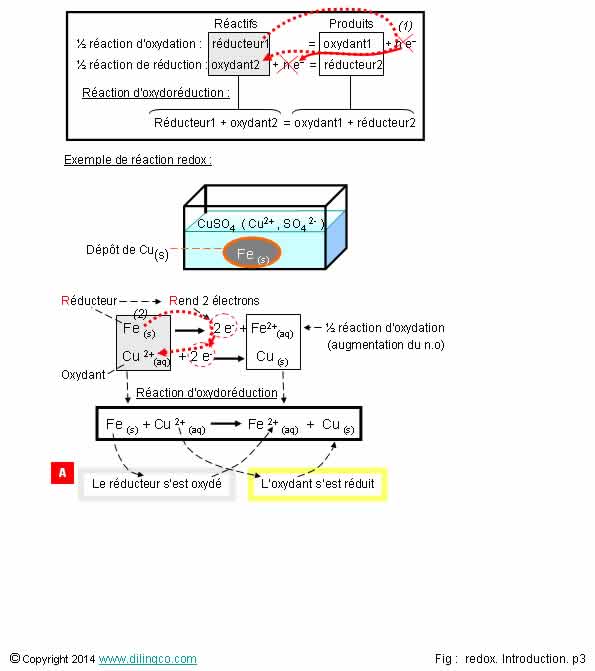
[A]. Le réducteur Fe(s) s’est oxydé. L’oxydant Cu2+(aq)
s’est réduit
L’oxydant ne peut pas « s’oxyder » lui-même !
(… mais
un oxydant peut être un réducteur, et donc « s’oxyder », s’il est
face à un oxydant plus fort que lui !)
Oxydation :
perte d’électron(s)
Affirmation
3
Oui.
Une
réaction d’oxydoréduction met en jeu 2 couples.
Il y a
échange d’électrons entre le couple redox Ox1-Red1 et le couple Ox2/Red2
Note :
Lors de
la combinaison des 2 demi-réactions, les électrons
sont éliminés, ils n’existent pas
dans l’eau.
Pour équilibrer la réaction d’oxydoréduction, il faut éventuellement,
multiplier chaque demi-réaction par un coefficient stoechiométrique.
Affirmation
4
Non.
Une réduction est un gain d’électron(s).
Ne pas se
fier à la signification du mot « réduction », qui prête, en chimie, à
confusion.
Pour ne
pas se tromper : une réduction est une réduction
du nombre d’oxydation (donc un gain d’électrons).
Affirmation
5
Oui.
La perte
d’électron peut provenir de la perte d’un atome d’hydrogène.
Affirmation
6
Non.
Une
réaction d'oxydoréduction ne peut pas se produire entre 2 oxydants ou 2
réducteurs.
Une réaction d'oxydoréduction ne peut se
produire qu’entre éléments de natures redox opposées ; un réducteur et un
oxydant.
Exemple
figure, réaction d’oxydoréduction Sulfate de
cuivre CuSO4, Fe :
Réactifs :
Réducteur Fe, oxydant Cu2+
Note :
Couple
sulfate de cuivre : l’ion cuivre Cu2+,
l’ion sulfate SO42-
.
Affirmation
7
Non.
Dans une
réaction d’oxydoréduction, l’échange d’électrons
se fait entre les 2 réactifs.
Les
réactifs appartiennent à 2 couples redox différents.
Voir figure (1) et (2).
Oxydation
Un réducteur s’oxyde.
Lors
d’une oxydation, le réducteur rend un ou des électrons.
Une oxydation est une perte d’électron(s)
Réduction
Un oxydant se réduit.
Lors d’une réduction, un oxydant obtient un ou des électrons.
Une réduction est un gain d’électron(s).
(Ne pas
se fier à la signification du mot ‘réduction’, qui prête, en chimie, à
confusion !)
Note :
L’oxydant ne peut pas « s’oxyder » lui-même !
(… mais
un oxydant peut être un réducteur, et donc s’oxyder », s’il est face à un
oxydant plus fort que lui !)
Réaction
d’oxydoréduction
Redox =
réduction / oxydation
Une réaction d'oxydoréduction est le couplage d’une réaction
d’oxydation et d’une réaction de réduction.
Les
électrons vont du réducteur (qui perd des électrons) à l’oxydant (qui gagne les
électrons).
Couple d’oxydoréduction
Dans un
couple redox, ‘réducteur oxydant’, les
deux espèces chimiques sont conjuguées par une écriture formelle :
Oxydant + n. e- = Réducteur
‘=’
signifie possibilité de passage de l’un à l’autre par transfert d’électrons.
(Oxydant
et réducteur sont ‘conjugués’)
Note :
Dans un couple redox, le premier désigné est
toujours l’oxydant et le second le
réducteur.
Exemple :
Fe 3+/Fe 2+, Fe3+ est l’oxydant, Fe2+
le réducteur.
Oxydation par perte d’hydrogène
Oxydation
d’un atome (ou une molécule) = perte
d’électron(s).
L’électron
perdu provient souvent de la perte d’un atome hydrogène (proton H+ plus
un électron e-) :
Une molécule qui perd de l’hydrogène perd un électron, et donc
s’oxyde, augmente son n.o.
Page 4.
Electronégativité &
redox
Sélectionner
les deux affirmations exactes :
1- La
différence d’électronégativités entre 2 éléments ne joue pas sur la nature de
leurs liaisons
2- Les principaux
oxydants sont les métaux alcalins
3- Les
principaux réducteurs sont les métaux (en particuliers les métaux alcalins et
alcalino-terreux)
4- Les
principaux réducteurs sont les gaz rares
5- Un
oxyde est un composé de l’oxygène avec un élément moins électronégatif (Tous
sauf le fluor)
6- Une
réaction d’oxydoréduction se fait entre éléments de même électronégativité
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Si.
Différence
d’électronégativités faible : liaison covalente.
Différence
d’électronégativités forte : liaison ionique.
Affirmation
2
Non.
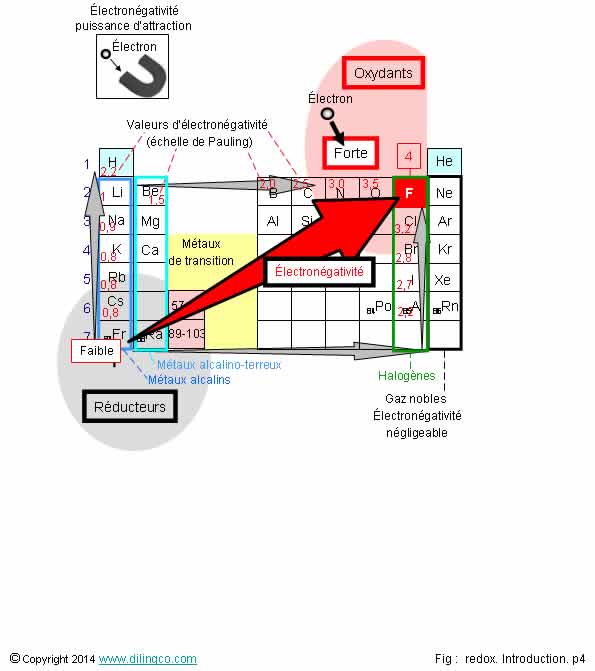
Les
principaux oxydants sont les corps simples les plus électronégatifs.
Ils sont
situés à droite du tableau périodique
Affirmation
4
Non.
Les gaz
rares sont très stables.
Ils n’ont
pas tendance à former des liaisons chimiques.
L’électronégativité des gaz rares est très faible, ils ne participent pas à des
réactions d’oxydoréduction.
Affirmation
6
Non.
Pour avoir
une réaction d’oxydoréduction, un échange d’électrons entre éléments chimiques,
il faut que l’un des éléments soit attractif d’électrons des électrons de
l’autre = différence d’électronégativité entre eux.
Electronégativité
Les gaz
rares sont très stables.
Ils n’ont
pas tendance à former des liaisons chimiques.
Leur électronégativité est très faible.
Le Fluor à la plus grande électronégativité (4 sur l’échelle de Pauling)
Le
Francium, en bas à gauche du tableau, à la plus petite électronégativité
(Si on
fait exception des gaz rares qui sont très stables)
Mnémotechnique pour
retenir l’ordre des éléments les plus électonégatifs:
font que le brome s’y cache (et inverser N et CI)
F
- O – N - CI - Br – S - C - H
F
- O – CI – N - Br – S - C - H
Electronégativité
- Capacité d’un élément, à attirer des électrons d’un autre élément,
(Élément :
atome ou molécule)
- La différence des électronégativités de deux
éléments détermine la nature de la liaison
chimique :
- Différence < 1,7 => Liaison covalente
-
Différence > 1,7 => Liaison ionique
En cas de
différence importante d’électronégativité, les électrons de liaison sont
fortement déplacés vers l’atome le plus électronégatif (qui devient un ion
négatif anion). Il n’y a plus de liaison covalente équilibrée mais une liaison
ionique entre deux ions.
-
L’échelle de Pauling est la plus utilisée pour calculer la différence d’électonégativité,
- Le Fluor est l’élément le
plus électronégatif du tableau.
Evolutions
de l’électronégativité
L’attraction du noyau sur les électrons augmente
avec sont nombre de protons (plus
de protons = plus de charge):
- L’électronégativité augmente de gauche à droite sur une période (Exception de la
dernière colonne, les gaz rares, qui sont très stables),
- L’électronégativité augmente de bas en haut :
Plus n est important, plus il y a de protons (plus d’attraction) mais aussi
plus d’électrons ; Les électrons font écran entre les électrons externes
et le noyau (lorsque n diminue =moins
d’écran).
Note :
Les
évolutions présentées sont globalement vraies. Mais il peut y avoir, dans le
détail, des atomes voisins, qui ne respectent pas les tendances générales.
Page 5.
Pile redox
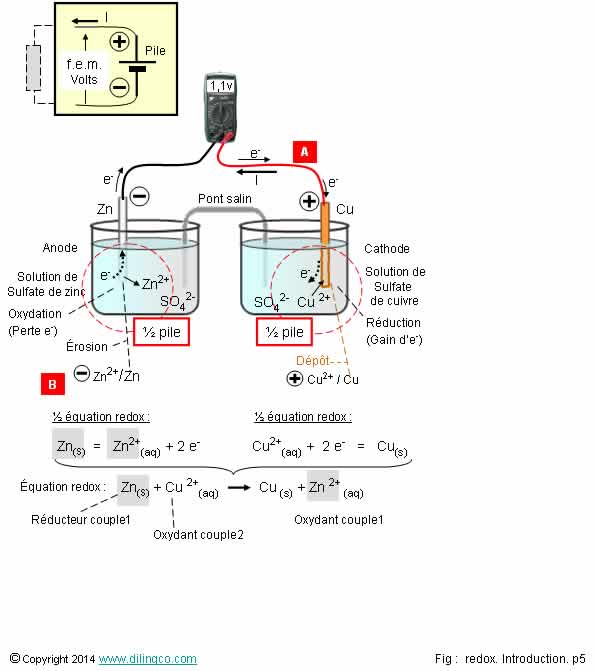
Sélectionner
l’affirmation exacte :
1- Des
réactions d’oxydoréduction ne peuvent pas constituer une pile électrique
2- [A]. Le sens
conventionnel du courant est l’inverse de celui de déplacement des électrons :
le courant conventionnel sort de la pile par la cathode de cuivre
3- Les
électrons se déplacent dans les solutions et dans le pont électrolytique
4- [B].
Couple redox : Zn/SO4
L’affirmation
2 est exacte.
Affirmation
1
Si.
Réaction d’oxydoréduction = échange d’électrons entre un réducteur et un oxydant.
Échange d’électrons = courant électrique.
Énergie
d’échange d’électrons = f.e.m.
f.e.m :
force électromotrice.
Ce sont
les 2 couples redox (Zn/Zn2+ & Cu2+/Cu), reliés par
le pont électrolytique, qui constituent la pile.
Affirmation
2
Oui.
[A].
Le sens conventionnel du courant :
- est le
sens de déplacement des charges positives
(L’inverse de celui de déplacement des électrons)
- le
courant conventionnel sort de la pile par la cathode
(Voir la
figure schématisée de la pile)
- le f.e.m.
de la pile est positive, 1,1 v environ, entre le commun et le «+» de la pile.
Affirmation
3
Non.
Les
électrons se déplacent sur les fils externes à la pile (S’ils sont connectés à
un circuit externe).
A
l’intérieur des solutions, la cathode
de cuivre fournit des électrons, l’anode de zinc les
attire.
Electrode
Zinc/solution : perte d’électrons = oxydation
Solution/électrode
Cu : gain d’électron = réduction
Ce sont
les ions qui se déplacent dans les solutions et le pont électrolytique.
Affirmation
4
Non.
Couple
redox : un réducteur et un oxydant.
Écrire la demi équation pour déterminer le réducteur (celui qui
« rend » des électrons) et l’oxydant qui les obtient.
Dans la ½
équation, le transfert d’électrons se fait entre Zn (réducteur) et Zn2+ (Oxydant).
Dans
l’équation bilan : passage d’électrons entre le zinc (Zn perd 2 électrons)
et le cuivre (Cu gagne 2 électrons).
Note :
Par convention d’écriture d’un couple redox, l’oxydant est notifié
en premier :
Zn2+ / Zn
Oxydant
/ réducteur.
Page 6.
Mesurer un potentiel E°
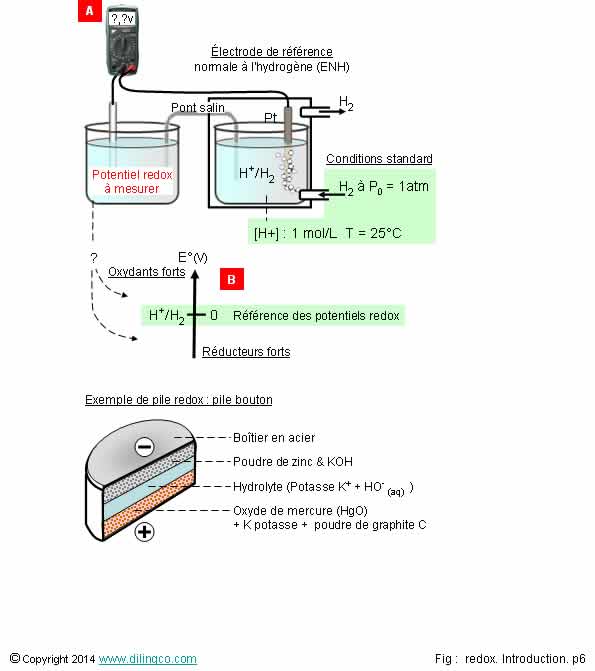
Sélectionner
les deux affirmations exactes :
1- Il
n’existe pas de tables de potentiel redox standard
2- Le
potentiel d’un couple redox ne dépend pas du contexte chimique (du pH de la
solution par exemple)
3-
Connaissant le potentiel redox du couple donneur et du couple accepteur, on
peut trouver la différence de potentiel redox de la réaction bilan
4- Il
existe des électrodes de référence autres que l’électrode ENH
5- [A].
La tension mesurée correspond au potentiel redox à mesurer
6- [B].
Les couples à potentiels redox positifs élevés : réducteurs forts
7- Pas
besoin d’un pH=0 dans l’électrode normale de l’hydrogène
Les
affirmations 3 et 4 sont exactes.
Affirmation
1
Si.
Il existe de nombreuses tables de potentiel redox standard E°.
En dehors
des conditions standard, mesurer un potentiel
d’oxydoréduction permet de déterminer
la concentration d’un soluté dans une solution.
Affirmation
2
Si.
Le potentiel d’un couple redox dépend de l’environnement.
Exemple :
la photosynthèse utilise la Lumière pour produire de l’énergie.
La loi de Nernst permet de calculer le potentiel
redox en fonction des E° et en dehors des conditions standard.
Voir Calculs potentiel redox E.
Affirmation
3
Oui.
Connaissant
le potentiel redox du couple donneur et du couple accepteur, on peut trouver la
différence de potentiel redox de la réaction d’oxydoréduction globale.
Exemple en
biochimie :
½ équation couple 1: NAD+ + 2H+ + 2 e- = NADH + H+ E0 = – 0,320 V½ équation couple 2 : Acétaldéhyde + 2 H+ + 2 e- = ÉthanolE0 = – 0,197 V
Réaction
redox bilan :
Acétaldéhyde + NADH + H+ => Éthanol + NAD+
Différence
de potentiel redox =
E°
accepteur – E° donneur =
– 0,197 –
(– 0,320) = + 0,123 V
Une f.em.redox bilan positive signifie une réaction favorable.
Affirmation
4
Oui.
Électrode
normale à l’hydrogène E.N.H : électrode
normale à l’hydrogène.
Électrode de calomel saturé E.C.S :
-
Calomel : ancien nom du chlorure de mercure Hg2Cl2,
-
Couple : Hg2Cl2/Hg,
-
potentiel relatif à l’E.N.H : 0,244 V,
- électrode utilisée pour les dosages pH-métriques,
- et la plupart des dosages redox (exceptés où les
ions Cl pourraient réagir avec les composés présents).
Autres
électrodes :
-
électrode de verre, utilisée pour la pH-métrie,
-
électrode combinée,
- …
Affirmation
5
Non.
[A]. La
tension mesurée correspond à la somme E = (E couple redox à mesurer) + (E
couple redox ENH).
La f.e.m
(E couple redox ENH) a été choisie comme tension de référence. Cette tension
est à soustraire à la tension mesurée pour en déduire la tension redox
recherchée.
Affirmation
6
Non.
[B]. Les
couples à potentiels redox positifs élevés : oxydants
forts.
Affirmation
7
Si.
[H+]
= 1mole par litre => pH=0
pH= - log
[H3O+] = - log 1 = 0
Page 7.
Dlink : Potredox
Potentiel standard redox
E°
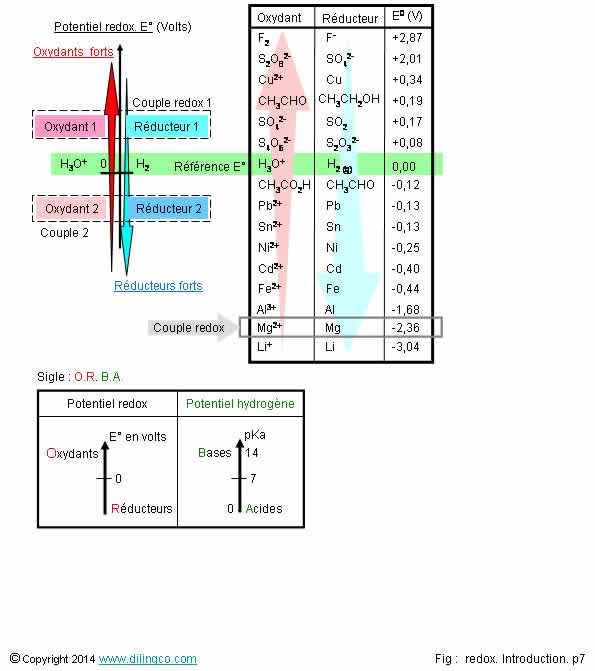
Sélectionner
les deux affirmations exactes :
1- Les
potentiels d’oxydoréduction ne permettent pas de prévoir la possibilité, la
force, le sens, des réactions d’oxydoréduction entre espèces chimiques
2- Un potentiel redox élevé définit un couple oxydant fort et
réducteur faible
3- Le difluor
est un réducteur très puissant
4- Le potentiel
redox s’exprime en volts mais ne peut pas se mesurer
5- Conditions
standard E° : 25°C, 1 mole/litre pour tous les ions participant à la
réaction, 1 Pa pour les gaz qui y participent, métaux état pur, électrode SNH
6- Par
convention, le potentiel d’oxydoréduction du couple H3O+/H2, a, comme le pH,
une valeur = 7
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Si.
Les potentiels d’oxydoréduction permettent de prévoir la possibilité, la force, le
sens, des réactions d’oxydoréduction entre espèces chimiques
Le potentiel d’oxydoréduction standard, noté E°,
permet d’affecter une force oxydante
(ou inversement, de force réductrice), et de classer
les oxydants et les réducteurs
sur une échelle de valeur.
Le
potentiel d’oxydo-réduction se mesure en volt.
Affirmation
3
Non.
Le fluor
est l’élément le plus électronégatif du tableau périodique
Voir page précédente «Electronégativité & redox».
Le difluor
est :
- un
oxydant très puissant (potentiel redox 2,87 volt)
-
extrêmement réactif et corrosif.
Affirmation
4
Si.
De
nombreuses tables de potentiels redox sont sur Internet mais le potentiel redox
peut aussi se mesurer.
Voir page précédente.
Affirmation
5
Oui.
Un
potentiel redox standard :
- est
mesuré avec une électrode ENH, Electrode normale à
l’hydrogène,
(Ou ESH, électrode standard
à l’hydrogène)
- les concentrations de tous les ions actifs de la réaction sont à
1 mole/litre.
Potentiel redox pour des concentrations différentes :
équation de Nernst.
-
Température = 25°C,
E° (Ox/red)
= E° (T), E°
est fonction de la température.
-
P : 1 atm, pH=0.
Note :
On peut
faire une similitude entre :
-
potentiel redox E et potentiel standard E°,
- pH, pKa
(Mêmes
notions d’axes, de références 0, de potentiels réels et standard)
Affirmation
6
Non.
Par
convention, le potentiel d’oxydoréduction standard
du couple H3O+/H2, a une valeur E° = 0.
E° (H+/H2)
= origine de l’échelle des potentiels redox.
La figure
fait ressortir :
- E°
positifs : Oxydants (et réducteurs conjugués)
- E°
négatifs : Réducteurs (et oxydants conjugués)
Mnémonique :
Axes des
potentiels redox ou potentiels hydrogène (pH) = se rappeler le sigle O.R.B.A.
Page 8.
Règle du gamma
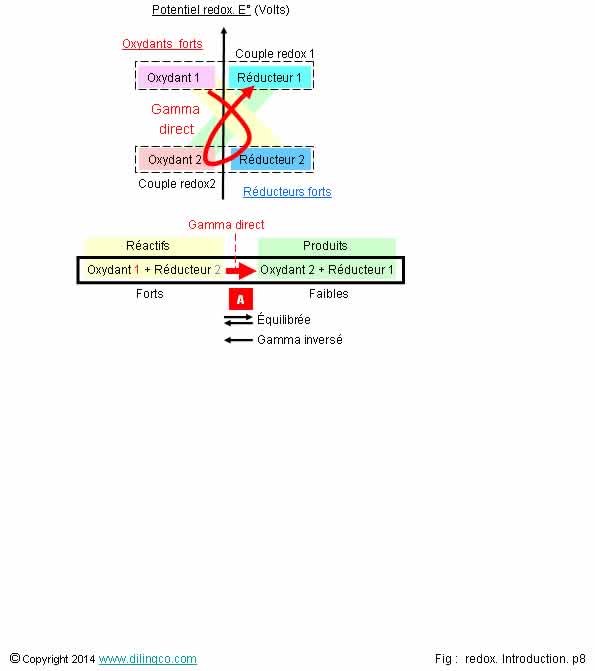
Sélectionner
l’affirmation exacte :
1- Réaction
d’oxydoréduction : réaction entre les oxydants de 2 couples redox
2- [A]. Pour
les réactions d’oxydoréduction, la règle du gamma est à un seul sens (le sens
direct), et une réaction d’oxydoréduction est toujours totale
3- À
l’équilibre, les couples redox ont le même potentiel d’oxydoréduction
4- Règle
du gamma : l’oxydant le plus fort réagit avec le réducteur le plus faible
pour donner le réducteur le plus fort et l’oxydant le plus faible
L’affirmation
3 est exacte.
Affirmation
1
Non.
Réaction
d’oxydoréduction : réaction entre l’oxydant d’un couple et le réducteur
d’un autre couple.
Affirmation
2
Non.
Une
réaction redox peut se faire :
- dans le
sens gauche à droite (gamma direct),
- dans
les deux sens (réaction équilibrée),
ou même
de droite à gauche (gamma indirect).
Une
réaction d’oxydoréduction peut, suivant la différence entre les potentiels
redox des 2 couples, être totale, partielle, ou
quasi-nulle.
Les
règles du gamma, pour les réactions d’oxydoréduction et les réactions
acido-basiques sont similaires.
Affirmation
4
Non.
Gamma
direct: l’oxydant le plus fort réagit avec le réducteur le plus fort pour donner
l’oxydant le plus faible et le réducteur le plus faible.
Voir figure.
Page 9.
Résumé. Eau oxygénée
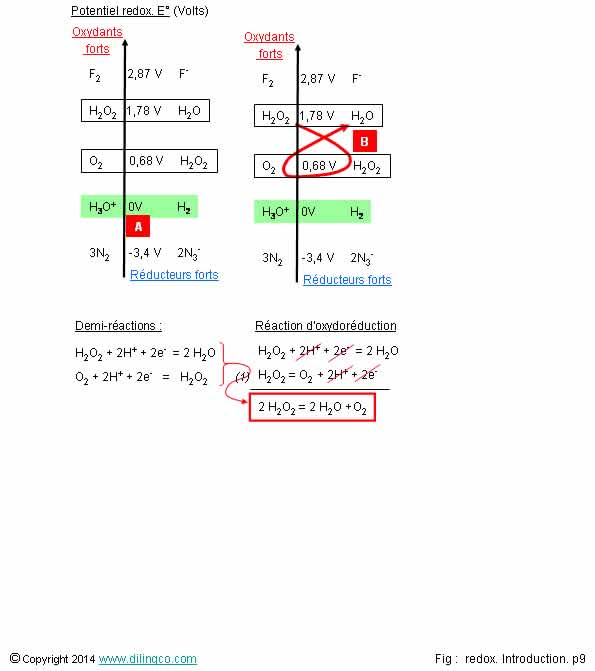
Sélectionner
l’affirmation exacte :
1- Un composé chimique ne peut pas être, selon le couple où il se
trouve, un oxydant ou un réducteur
2- [A]. Potentiel redox de l’eau pure = 1
3- [B]. L’oxydant le plus fort, E° le plus élevé, réagit avec le
réducteur le plus fort, E° le plus faible. Gamma direct : le réaction est
favorable
4- [C] : Réaction globale : H2O2 + O2 = 1H2O + H2O2 (les
protons H et les électrons des 2 demi-équations s’annulent)
L’affirmation 3 est exacte.
Affirmation 1
Si.
Un composé chimique peut intervenir dans plusieurs couples redox
et peut être suivant le cas un oxydant ou un réducteur.
Exemple l’eau oxygéné ou peroxyde d’hydrogène H2O2
:
H2O2/H2O : E°=1,78 V, H2O2
à gauche du couple redox = oxydant
O2/H2O2 : E°=0,68 V, H2O2
à
droite du couple redox = réducteur
(Par conventions couple Oxydant/réducteur)
On peut aussi estimer les richesses en électrons des éléments du
couple redox : O2 est moins riche en électrons que H2O2 ;
il est prêt à « obtenir » des électrons = oxydant.
Les propriétés oxydantes fortes de l’eau oxygénée en font un
antiseptique et un stérilisant.
Affirmation 2
Non.
[A]. Potentiel redox de l’eau pure a été arbitrairement fixé à 0
V, référence de l’axe des potentiels redox.
Affirmation
4
Non.
2 H2O2 = 2 H2O + O2
Figure (1) : pour éviter des erreurs il est conseillé d’inverser l’une des 2
demi-équations.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Oxydations & réductions. Exemples

Sélectionner l’affirmation exacte :
1- La rouille (hydroxyde et oxyde de fer), résultat de la corrosion du fer en présence d’oxygène et d’eau, à une composition chimique plus simple que le fer
2- Une combustion est une réaction endothermique
3- Respiration cellulaire : réaction d’oxydoréduction qui fournit à une cellule l’énergie nécessaire à son fonctionnement
4- Métabolisme des glucides dans l’organisme : gains successifs d’électrons
L’affirmation 3 est exacte.
Affirmation 1
Non.
La corrosion du fer est une oxydation lente qui forme des structures à base de Fe(OH)3, Fe2O3, plus ou moins stables, cristallisées, hydratées.
Affirmation 2
Non.
Combustion :
- réaction exothermique (Qui produit de la chaleur),
- réaction d’oxydoréduction entre 2 réactifs (un combustible et un comburant),
- déclenchée par une énergie d’activation (Exemples : de la chaleur, flamme, pression, …),
- une réaction en chaîne de rupture de liaisons chimiques produit des radicaux libres.
Combustibles :
- solides, liquides, gaz, métaux, …
- exemples : bois, PVC, essence, butane, fer, magnésium, …
Comburant : par exemple le dioxygène de l’air.
Affirmation 3
Oui.
Respiration cellulaire :
- réaction d’oxydoréduction
- entre un carburant : glucose, acide gras, autres molécules organiques (acides aminés, corps cétoniques),
- un comburant : O2,
- Produits : énergie (ATP), CO2, H2O, …
Affirmation 4
Non.
Le métabolisme (catabolisme) des glucides correspond des oxydations du glucose, pertes d’électrons, qui fournissent de l’énergie.
Note :
La perte d’un atome d’hydrogène correspond à une perte d’un électron.
Etapes du catabolisme du glucose dans l’organisme
Les glucides sont transformés en glucose par le foie.
Voir Physiologie digestive
Le glucose peut être stocké sous forme de glycogène, ou dégradé, oxydé, lors de la respiration cellulaire.
Oxydation du glucose : perte d’électrons (ou d’atome H) et création d’énergie.
3 étapes de la respiration cellulaire :
- la
glycolyse, le glucose est oxydé en pyruvate.
La glycolyse se fait dans le cytoplasme de la cellule, en anaérobie (Sans
oxygène),
- le cycle de Krebs,
- la chaîne respiratoire.
Voir :
- Catabolisme des glucides : pertes successives d’électrons.
- Métabolisme des lipides
- Métabolisme composés azotés
Page 2.
Définitions

Sélectionner l’affirmation exacte :
1- Une oxydation est un gain d’électron(s)
2- Un oxydant s’oxyde ; un réducteur se réduit
3- Une oxydation est la formation d’un oxydant
4- Dans le couple AG+/Ag, Ag est l’oxydant
L’affirmation 3 est exacte.
Il est important de mémoriser les définitions : oxydant, réducteur, oxydation, réduction.
Affirmation 1
Non.
Oxydation = perte d’électrons
Réduction = gain d’électrons.
Affirmation 2
Non.
Attention piège ! : Un oxydant s’oxyde ; un réducteur se réduit
Mnémonique :
Un oxydant se réduit, un réducteur s’oxyde.
Un oxydant obtient des électrons
Un réducteur rend des électrons.
Affirmation 3
Oui.
Une oxydation est la formation d’un oxydant à partir d’un réducteur qui s’est oxydé en perdant un ou des électrons.
Une réduction est la formation d’un réducteur à partir d’un oxydant qui s’est réduit en gagnant un ou des électrons.
Note :
Le nombre d’oxydation (n.o.) lié à l’état d’oxydation de l’élément chimique est présenté au chapitre suivant.
Affirmation 4
Non.
Dans un couple redox, le premier désigné est toujours l’oxydant et le second le réducteur.
Exemple : Fe 3+/Fe 2+, Fe3+ est l’oxydant, Fe2+ le réducteur.
La vérification est, pour un ion, simple facile :
Fe3+ + e- = Fe 2+
L’oxydant Fe3+ obtient un électron se réduire en réducteur Fe2+ (réducteur qui à l’inverse, en « rendant » un électron, forme un oxydant)
Comme pour les couples acide/base, les couples redox sont formés de 2 espèces chimiques conjuguées.
Espèces conjuguées redox : on passe d’une espèces à l’autre par gain ou perte d’électron(s).
Page 3.
Réaction d’oxydoréduction
Lors d’une réaction d’oxydoréduction, …

Sélectionner les deux affirmations exactes :
1- Les électrons « rendus » par le réducteur disparaissent dans la nature
2- [A]. Le réducteur s’est réduit. L’oxydant s’est oxydé
3- Il y a échange d’électrons entre 2 couples redox Ox1-Red1 et Ox2/Red2 (Le réducteur1 rend un électron à l’oxydant2)
4- Une réaction de réduction est une perte d’électron(s)
5- La perte d’électron peut provenir de la perte d’un atome d’hydrogène
6- La réaction peut se faire entre 2 oxydants ou entre 2 réducteurs
7- L’échange d’électrons se fait entre réducteur et oxydant de chaque couple respectif
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Lavoisier « Rien ne se perd, rien ne se crée, tout se transforme. »
Les électrons « rendus » par le réducteur sont récupérés par l’oxydant qui les « obtient ».
Affirmation 2
Non.
[A]. Le réducteur Fe(s) s’est oxydé. L’oxydant Cu2+(aq) s’est réduit
L’oxydant ne peut pas « s’oxyder » lui-même !
(… mais un oxydant peut être un réducteur, et donc « s’oxyder », s’il est face à un oxydant plus fort que lui !)
Oxydation : perte d’électron(s)
Affirmation 3
Oui.
Une réaction d’oxydoréduction met en jeu 2 couples.
Il y a échange d’électrons entre le couple redox Ox1-Red1 et le couple Ox2/Red2
Note :
Lors de
la combinaison des 2 demi-réactions, les électrons
sont éliminés, ils n’existent pas
dans l’eau.
Pour équilibrer la réaction d’oxydoréduction, il faut éventuellement,
multiplier chaque demi-réaction par un coefficient stoechiométrique.
Affirmation 4
Non.
Une réduction est un gain d’électron(s).
Ne pas se fier à la signification du mot « réduction », qui prête, en chimie, à confusion.
Pour ne pas se tromper : une réduction est une réduction du nombre d’oxydation (donc un gain d’électrons).
Affirmation 5
Oui.
La perte d’électron peut provenir de la perte d’un atome d’hydrogène.
Affirmation 6
Non.
Une
réaction d'oxydoréduction ne peut pas se produire entre 2 oxydants ou 2
réducteurs.
Une réaction d'oxydoréduction ne peut se
produire qu’entre éléments de natures redox opposées ; un réducteur et un
oxydant.
Exemple figure, réaction d’oxydoréduction Sulfate de cuivre CuSO4, Fe :
Réactifs : Réducteur Fe, oxydant Cu2+
Note :
Couple sulfate de cuivre : l’ion cuivre Cu2+, l’ion sulfate SO42- .
Affirmation 7
Non.
Dans une réaction d’oxydoréduction, l’échange d’électrons se fait entre les 2 réactifs.
Les
réactifs appartiennent à 2 couples redox différents.
Voir figure (1) et (2).
Oxydation
Un réducteur s’oxyde.
Lors d’une oxydation, le réducteur rend un ou des électrons.
Une oxydation est une perte d’électron(s)
Réduction
Un oxydant se réduit.
Lors d’une réduction, un oxydant obtient un ou des électrons.
Une réduction est un gain d’électron(s).
(Ne pas se fier à la signification du mot ‘réduction’, qui prête, en chimie, à confusion !)
Note :
L’oxydant ne peut pas « s’oxyder » lui-même !
(… mais un oxydant peut être un réducteur, et donc s’oxyder », s’il est face à un oxydant plus fort que lui !)
Réaction d’oxydoréduction
Redox = réduction / oxydation
Une réaction d'oxydoréduction est le couplage d’une réaction d’oxydation et d’une réaction de réduction.
Les électrons vont du réducteur (qui perd des électrons) à l’oxydant (qui gagne les électrons).
Couple d’oxydoréduction
Dans un couple redox, ‘réducteur oxydant’, les deux espèces chimiques sont conjuguées par une écriture formelle :
Oxydant + n. e- = Réducteur
‘=’ signifie possibilité de passage de l’un à l’autre par transfert d’électrons.
(Oxydant et réducteur sont ‘conjugués’)
Note :
Dans un couple redox, le premier désigné est
toujours l’oxydant et le second le
réducteur.
Exemple : Fe 3+/Fe 2+, Fe3+ est l’oxydant, Fe2+ le réducteur.
Oxydation par perte d’hydrogène
Oxydation d’un atome (ou une molécule) = perte d’électron(s).
L’électron perdu provient souvent de la perte d’un atome hydrogène (proton H+ plus un électron e-) :
Une molécule qui perd de l’hydrogène perd un électron, et donc s’oxyde, augmente son n.o.
Page 4.
Electronégativité & redox

Sélectionner les deux affirmations exactes :
1- La différence d’électronégativités entre 2 éléments ne joue pas sur la nature de leurs liaisons
2- Les principaux oxydants sont les métaux alcalins
3- Les principaux réducteurs sont les métaux (en particuliers les métaux alcalins et alcalino-terreux)
4- Les principaux réducteurs sont les gaz rares
5- Un oxyde est un composé de l’oxygène avec un élément moins électronégatif (Tous sauf le fluor)
6- Une réaction d’oxydoréduction se fait entre éléments de même électronégativité
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Si.
Différence d’électronégativités faible : liaison covalente.
Différence d’électronégativités forte : liaison ionique.
Affirmation 2
Non.
Les principaux oxydants sont les corps simples les plus électronégatifs.
Ils sont situés à droite du tableau périodique
Affirmation 4
Non.
Les gaz rares sont très stables.
Ils n’ont
pas tendance à former des liaisons chimiques.
L’électronégativité des gaz rares est très faible, ils ne participent pas à des
réactions d’oxydoréduction.
Affirmation 6
Non.
Pour avoir une réaction d’oxydoréduction, un échange d’électrons entre éléments chimiques, il faut que l’un des éléments soit attractif d’électrons des électrons de l’autre = différence d’électronégativité entre eux.
Electronégativité
Les gaz rares sont très stables.
Ils n’ont
pas tendance à former des liaisons chimiques.
Leur électronégativité est très faible.
Le Fluor à la plus grande électronégativité (4 sur l’échelle de Pauling)
Le Francium, en bas à gauche du tableau, à la plus petite électronégativité
(Si on fait exception des gaz rares qui sont très stables)
Mnémotechnique pour retenir l’ordre des éléments les plus électonégatifs:
font que le brome s’y cache (et inverser N et CI)
F - O – N - CI - Br – S - C - H
F - O – CI – N - Br – S - C - H
Electronégativité
- Capacité d’un élément, à attirer des électrons d’un autre élément,
(Élément : atome ou molécule)
- La différence des électronégativités de deux
éléments détermine la nature de la liaison
chimique :
- Différence < 1,7 => Liaison covalente
- Différence > 1,7 => Liaison ionique
En cas de différence importante d’électronégativité, les électrons de liaison sont fortement déplacés vers l’atome le plus électronégatif (qui devient un ion négatif anion). Il n’y a plus de liaison covalente équilibrée mais une liaison ionique entre deux ions.
- L’échelle de Pauling est la plus utilisée pour calculer la différence d’électonégativité,
- Le Fluor est l’élément le plus électronégatif du tableau.
Evolutions de l’électronégativité
L’attraction du noyau sur les électrons augmente avec sont nombre de protons (plus de protons = plus de charge):
- L’électronégativité augmente de gauche à droite sur une période (Exception de la dernière colonne, les gaz rares, qui sont très stables),
- L’électronégativité augmente de bas en haut : Plus n est important, plus il y a de protons (plus d’attraction) mais aussi plus d’électrons ; Les électrons font écran entre les électrons externes et le noyau (lorsque n diminue =moins d’écran).
Note :
Les évolutions présentées sont globalement vraies. Mais il peut y avoir, dans le détail, des atomes voisins, qui ne respectent pas les tendances générales.
Page 5.
Pile redox

Sélectionner l’affirmation exacte :
1- Des réactions d’oxydoréduction ne peuvent pas constituer une pile électrique
2- [A]. Le sens conventionnel du courant est l’inverse de celui de déplacement des électrons : le courant conventionnel sort de la pile par la cathode de cuivre
3- Les électrons se déplacent dans les solutions et dans le pont électrolytique
4- [B]. Couple redox : Zn/SO4
L’affirmation 2 est exacte.
Affirmation 1
Si.
Réaction d’oxydoréduction = échange d’électrons entre un réducteur et un oxydant.
Échange d’électrons = courant électrique.
Énergie d’échange d’électrons = f.e.m.
f.e.m : force électromotrice.
Ce sont les 2 couples redox (Zn/Zn2+ & Cu2+/Cu), reliés par le pont électrolytique, qui constituent la pile.
Affirmation 2
Oui.
[A].
Le sens conventionnel du courant :
- est le sens de déplacement des charges positives
(L’inverse de celui de déplacement des électrons)
- le courant conventionnel sort de la pile par la cathode
(Voir la figure schématisée de la pile)
- le f.e.m. de la pile est positive, 1,1 v environ, entre le commun et le «+» de la pile.
Affirmation 3
Non.
Les électrons se déplacent sur les fils externes à la pile (S’ils sont connectés à un circuit externe).
A l’intérieur des solutions, la cathode de cuivre fournit des électrons, l’anode de zinc les attire.
Electrode Zinc/solution : perte d’électrons = oxydation
Solution/électrode Cu : gain d’électron = réduction
Ce sont les ions qui se déplacent dans les solutions et le pont électrolytique.
Affirmation 4
Non.
Couple
redox : un réducteur et un oxydant.
Écrire la demi équation pour déterminer le réducteur (celui qui
« rend » des électrons) et l’oxydant qui les obtient.
Dans la ½ équation, le transfert d’électrons se fait entre Zn (réducteur) et Zn2+ (Oxydant).
Dans l’équation bilan : passage d’électrons entre le zinc (Zn perd 2 électrons) et le cuivre (Cu gagne 2 électrons).
Note :
Par convention d’écriture d’un couple redox, l’oxydant est notifié en premier :
Zn2+ / Zn
Oxydant / réducteur.
Page 6.
Mesurer un potentiel E°

Sélectionner les deux affirmations exactes :
1- Il n’existe pas de tables de potentiel redox standard
2- Le potentiel d’un couple redox ne dépend pas du contexte chimique (du pH de la solution par exemple)
3- Connaissant le potentiel redox du couple donneur et du couple accepteur, on peut trouver la différence de potentiel redox de la réaction bilan
4- Il existe des électrodes de référence autres que l’électrode ENH
5- [A]. La tension mesurée correspond au potentiel redox à mesurer
6- [B]. Les couples à potentiels redox positifs élevés : réducteurs forts
7- Pas besoin d’un pH=0 dans l’électrode normale de l’hydrogène
Les affirmations 3 et 4 sont exactes.
Affirmation 1
Si.
Il existe de nombreuses tables de potentiel redox standard E°.
En dehors des conditions standard, mesurer un potentiel d’oxydoréduction permet de déterminer la concentration d’un soluté dans une solution.
Affirmation 2
Si.
Le potentiel d’un couple redox dépend de l’environnement.
Exemple :
la photosynthèse utilise la Lumière pour produire de l’énergie.
La loi de Nernst permet de calculer le potentiel
redox en fonction des E° et en dehors des conditions standard.
Voir Calculs potentiel redox E.
Affirmation 3
Oui.
Connaissant le potentiel redox du couple donneur et du couple accepteur, on peut trouver la différence de potentiel redox de la réaction d’oxydoréduction globale.
Exemple en biochimie :
½ équation couple 1: NAD+ + 2H+ + 2 e- = NADH + H+ E0 = – 0,320 V½ équation couple 2 : Acétaldéhyde + 2 H+ + 2 e- = ÉthanolE0 = – 0,197 V
Réaction redox bilan :
Acétaldéhyde + NADH + H+ => Éthanol + NAD+
Différence de potentiel redox =
E° accepteur – E° donneur =
– 0,197 – (– 0,320) = + 0,123 V
Une f.em.redox bilan positive signifie une réaction favorable.
Affirmation 4
Oui.
Électrode normale à l’hydrogène E.N.H : électrode normale à l’hydrogène.
Électrode de calomel saturé E.C.S :
- Calomel : ancien nom du chlorure de mercure Hg2Cl2,
- Couple : Hg2Cl2/Hg,
- potentiel relatif à l’E.N.H : 0,244 V,
- électrode utilisée pour les dosages pH-métriques,
- et la plupart des dosages redox (exceptés où les ions Cl pourraient réagir avec les composés présents).
Autres électrodes :
- électrode de verre, utilisée pour la pH-métrie,
- électrode combinée,
- …
Affirmation 5
Non.
[A]. La tension mesurée correspond à la somme E = (E couple redox à mesurer) + (E couple redox ENH).
La f.e.m (E couple redox ENH) a été choisie comme tension de référence. Cette tension est à soustraire à la tension mesurée pour en déduire la tension redox recherchée.
Affirmation 6
Non.
[B]. Les couples à potentiels redox positifs élevés : oxydants forts.
Affirmation 7
Si.
[H+] = 1mole par litre => pH=0
pH= - log [H3O+] = - log 1 = 0
Page 7.
Dlink : Potredox
Potentiel standard redox E°

Sélectionner les deux affirmations exactes :
1- Les potentiels d’oxydoréduction ne permettent pas de prévoir la possibilité, la force, le sens, des réactions d’oxydoréduction entre espèces chimiques
2- Un potentiel redox élevé définit un couple oxydant fort et réducteur faible
3- Le difluor est un réducteur très puissant
4- Le potentiel redox s’exprime en volts mais ne peut pas se mesurer
5- Conditions standard E° : 25°C, 1 mole/litre pour tous les ions participant à la réaction, 1 Pa pour les gaz qui y participent, métaux état pur, électrode SNH
6- Par convention, le potentiel d’oxydoréduction du couple H3O+/H2, a, comme le pH, une valeur = 7
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Si.
Les potentiels d’oxydoréduction permettent de prévoir la possibilité, la force, le sens, des réactions d’oxydoréduction entre espèces chimiques
Le potentiel d’oxydoréduction standard, noté E°, permet d’affecter une force oxydante (ou inversement, de force réductrice), et de classer les oxydants et les réducteurs sur une échelle de valeur.
Le potentiel d’oxydo-réduction se mesure en volt.
Affirmation 3
Non.
Le fluor est l’élément le plus électronégatif du tableau périodique
Voir page précédente «Electronégativité & redox».
Le difluor est :
- un oxydant très puissant (potentiel redox 2,87 volt)
- extrêmement réactif et corrosif.
Affirmation 4
Si.
De
nombreuses tables de potentiels redox sont sur Internet mais le potentiel redox
peut aussi se mesurer.
Voir page précédente.
Affirmation 5
Oui.
Un potentiel redox standard :
- est mesuré avec une électrode ENH, Electrode normale à l’hydrogène,
(Ou ESH, électrode standard à l’hydrogène)
- les concentrations de tous les ions actifs de la réaction sont à 1 mole/litre.
Potentiel redox pour des concentrations différentes : équation de Nernst.
- Température = 25°C,
E° (Ox/red) = E° (T), E° est fonction de la température.
- P : 1 atm, pH=0.
Note :
On peut faire une similitude entre :
- potentiel redox E et potentiel standard E°,
- pH, pKa
(Mêmes notions d’axes, de références 0, de potentiels réels et standard)
Affirmation 6
Non.
Par convention, le potentiel d’oxydoréduction standard du couple H3O+/H2, a une valeur E° = 0.
E° (H+/H2) = origine de l’échelle des potentiels redox.
La figure fait ressortir :
- E° positifs : Oxydants (et réducteurs conjugués)
- E° négatifs : Réducteurs (et oxydants conjugués)
Mnémonique :
Axes des potentiels redox ou potentiels hydrogène (pH) = se rappeler le sigle O.R.B.A.
Page 8.
Règle du gamma

Sélectionner l’affirmation exacte :
1- Réaction d’oxydoréduction : réaction entre les oxydants de 2 couples redox
2- [A]. Pour les réactions d’oxydoréduction, la règle du gamma est à un seul sens (le sens direct), et une réaction d’oxydoréduction est toujours totale
3- À l’équilibre, les couples redox ont le même potentiel d’oxydoréduction
4- Règle du gamma : l’oxydant le plus fort réagit avec le réducteur le plus faible pour donner le réducteur le plus fort et l’oxydant le plus faible
L’affirmation 3 est exacte.
Affirmation 1
Non.
Réaction d’oxydoréduction : réaction entre l’oxydant d’un couple et le réducteur d’un autre couple.
Affirmation 2
Non.
Une réaction redox peut se faire :
- dans le sens gauche à droite (gamma direct),
- dans les deux sens (réaction équilibrée),
ou même de droite à gauche (gamma indirect).
Une réaction d’oxydoréduction peut, suivant la différence entre les potentiels redox des 2 couples, être totale, partielle, ou quasi-nulle.
Les règles du gamma, pour les réactions d’oxydoréduction et les réactions acido-basiques sont similaires.
Affirmation 4
Non.
Gamma direct: l’oxydant le plus fort réagit avec le réducteur le plus fort pour donner l’oxydant le plus faible et le réducteur le plus faible.
Voir figure.
Page 9.
Résumé. Eau oxygénée

Sélectionner l’affirmation exacte :
1- Un composé chimique ne peut pas être, selon le couple où il se trouve, un oxydant ou un réducteur
2- [A]. Potentiel redox de l’eau pure = 1
3- [B]. L’oxydant le plus fort, E° le plus élevé, réagit avec le réducteur le plus fort, E° le plus faible. Gamma direct : le réaction est favorable
4- [C] : Réaction globale : H2O2 + O2 = 1H2O + H2O2 (les protons H et les électrons des 2 demi-équations s’annulent)
L’affirmation 3 est exacte.
Affirmation 1
Si.
Un composé chimique peut intervenir dans plusieurs couples redox et peut être suivant le cas un oxydant ou un réducteur.
Exemple l’eau oxygéné ou peroxyde d’hydrogène H2O2 :
H2O2/H2O : E°=1,78 V, H2O2 à gauche du couple redox = oxydant
O2/H2O2 : E°=0,68 V, H2O2 à droite du couple redox = réducteur
(Par conventions couple Oxydant/réducteur)
On peut aussi estimer les richesses en électrons des éléments du couple redox : O2 est moins riche en électrons que H2O2 ; il est prêt à « obtenir » des électrons = oxydant.
Les propriétés oxydantes fortes de l’eau oxygénée en font un antiseptique et un stérilisant.
Affirmation 2
Non.
[A]. Potentiel redox de l’eau pure a été arbitrairement fixé à 0 V, référence de l’axe des potentiels redox.
Affirmation 4
Non.
2 H2O2 = 2 H2O + O2
Figure (1) : pour éviter des erreurs il est conseillé d’inverser l’une des 2 demi-équations.