Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Titrage & dosage
Sélectionner
l’affirmation exacte :
1- Il
faut toujours verser un réactif titrant pour déterminer la concentration d’un
élément dans une solution
2- Dosage
ou titrage : déterminer la quantité, la concentration d’une substance,
dans une autre, dans une solution, dans un mélange
3- Un
dosage chimique (ou titrage) n’est pas destructif
4- Tous
les dosages sont destructifs
L’affirmation
2 est exacte.
Affirmation
1
Non.
Exemples:
-
utilisation d’un papier pH qui, trempé dans la solution à mesurer, qui prend
des couleurs acides ou basiques plus ou moins prononcées,
- dosages
ph-métrique ou potentiométriques avec des sondes préalablement étalonnées,
- dosage spectrophotométriques
(mesure de l’absorption lumineuse)
Affirmation
2
Oui.
Dosage et titrage : termes globalement similaires.
Affirmation
3
Si.
Les
dosages (ou titrages) par réactions chimiques sont destructifs. Un échantillon
de la solution est prélevée et versée dans un bécher pour être analysé. Un
réactif titrant provoque une réaction chimique acido-basique ou d’oxydo-réduction.
A
l’équivalence, le réactif titrant et le réactif titré ont été entièrement
consommés.
Avant
l’équivalence, le réactif limitant est le réactif titrant.
Après l’équivalence, si on continu à verser du réactif titrant, il n’y a plus
de réactif titré : le réactif titré est le réactif limitant.
Affirmation
4
Non.
Les
dosages par mesure d’une grandeur physique liée à une concentration sont
souvent non destructifs.
Exemples :
dosage spectrophotométriques (mesure de l’absorption lumineuse), dosages par étalonnages.
[A].
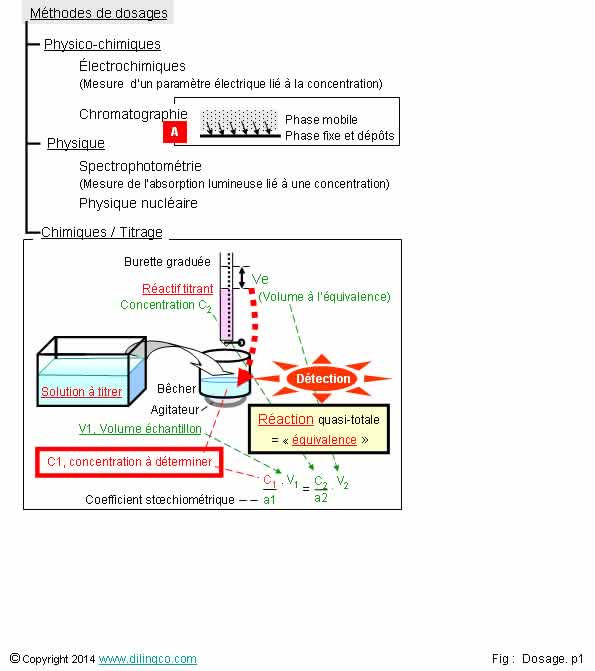
Méthode de dosage chromatographique
Très
importante méthode de dosage : rechercher « Chromatographie » sur
Internet.
L’échantillon
à doser est contenu dans une phase mobile gazeuse ou liquide. Phase mobile en
contact avec une phase fixe (papier, gélatine, polymère, …).
Des
forces d’attractions faibles (Liaisons Van der Waals) s’établissent
entre les éléments à doser et la phase fixe. Les vitesses de migration et les
dépôts sont mesurés pour déterminer les éléments et les concentrations
recherchées.
Titrage chimique :
- le
réactif titrant versé dans la solution provoque une
réaction chimique.
Les
réactifs, titré et titrant, sont liés par une réaction chimique provoquée par
versement progressif de réactif titrant dans la solution à titrer.
- la
détection de cette réaction, associée au volume d’équivalence, permet de
calculer le « titre », la concentration, de l’élément recherché.
Dosage par étalonnage :
- étalonnage préalable du dispositif par des
mesures à partir de solutions à concentrations connues,
-
comparaison de la solution à doser avec l’étalonnage préalable pour déterminer
la concentration de l’élément recherché.
Il n’y a pas de réaction chimique dans la solution à doser.
L’électrode
introduite dans la solution mesure un potentiel redox, potentiel comparé a la
courbe de potentiels préalables obtenus par d’échantillonnages avec des
concentrations différentes.
Voir
aussi Pile Redox
Note :
Dans la
mesure où les échantillonnages préalables ne sont
pas toujours possibles, en milieux biologiques par exemple, le
dosage d’une solution n’est pas toujours possible. Il faut alors procéder par
titrage.
Page 2.
Rappels pka. pH
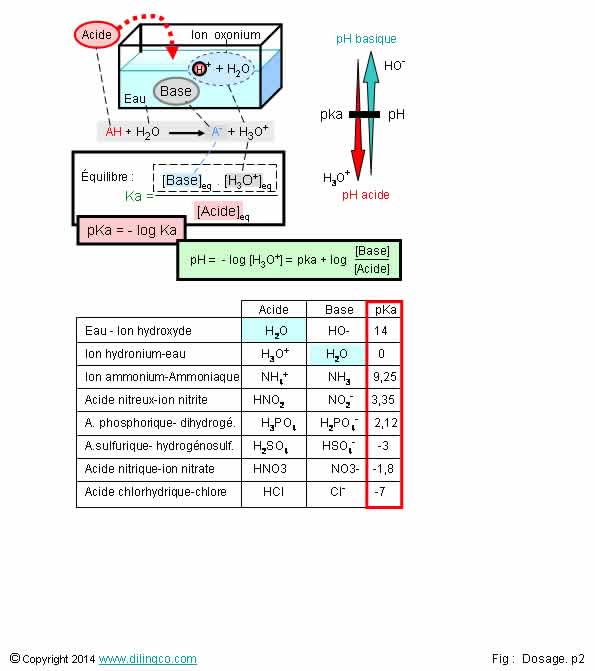
Sélectionner
l’affirmation exacte :
1- pH = force
d’un acide
2- pKa =
force d’un acide
3- Les
acides forts ont le même pka, le même pouvoir de dissociation, lorsqu’ils sont versés
dans une solution
4- Acide :
élément capable de capter des protons H+
L’affirmation
2 est exacte.
Affirmation
1 :
Non.
pH, potentiel hydrogène = concentration des ion hydronium (oxonium) d’une solution.
La concentration
en H3O+ varie en fonction des concentrations d’acides ou
de bases versées dans la solution.
Affirmation
3
Non.
Par
exemple, l’acide sulfurique, pKa=-3, est plus
fort, se dissocie mieux en solution, que
l’acide nitrique de pka -1,8.
Affirmation
4
Non.
Acide : élément capable de donner des protons H+.
En
solution aqueuse, ces protons s’associent immédiatement avec l’eau pour donner
des cations Oxonium H3O+.
Pour
pouvoir donner des H+, et donc par définition, les
molécules d’acides ont des atomes d’hydrogène.
Exemples
d’acides :
-
HNO3, acide nitrique,
-
HCL, acide chlorhydrique,
-
HClO, acide perchlorique,
-
H2SO4, acide
sulfurique,
- etc.
Page 3.
Evolution du pH
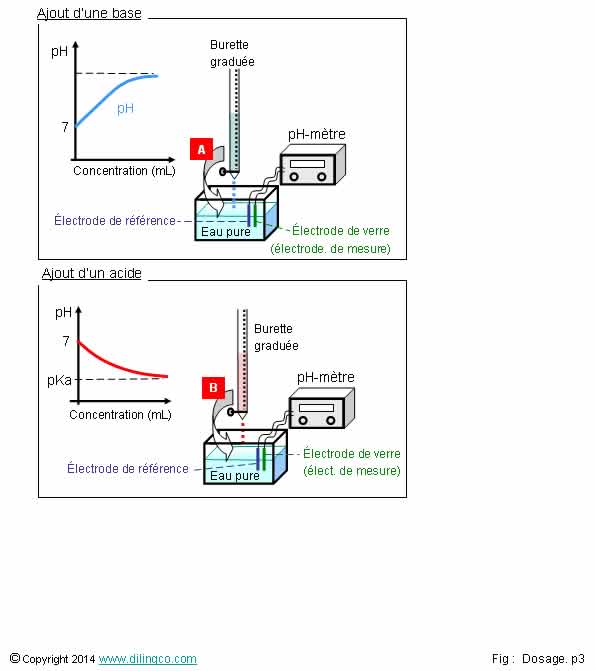
Sélectionner
l’affirmation exacte :
1- Le pH
d’une solution est égal au pKa de l’acide contenu dans la solution aqueuse
2-
[A] : l’accroissement du pH indique qu’un acide est progressivement ajouté
3- pH-métrie :
mesure du potentiel d’hydrogène d’une solution
4- Une
« électrode de verre » d’un pH-mètre est insensible aux ions
hydronium
L’affirmation
3 est exacte.
Affirmation
1
Non.
Partant de l’eau pure, pH neutre = 7, l’ajout d’un acide augment la
concentration des ions oxonium H3O+ de la solution, et
fait baisser le pH.
pH =
concentration des ion oxonium dans une solution = -
log [H3O+]
Le pH
dépend des concentrations.
Le pka est le potentiel de dissociation d’un acide
et lui est spécifique.
Affirmation
2
Non.
[A] :
l’accroissement du pH indique qu’une base est
progressivement ajoutée.
Une
décroissance du pH [B] indiquerait que de l’acide serait ajouté
Affirmation
3
Oui.
Le titrage d’une solution : déterminer le point d’équilibre
acido-basique par
ajouts croissants d’un élément de la réaction.
pH-métrie : mesure du potentiel d’hydrogène, pH, d’une solution
La mesure
s’effectue avec un pH-mètre.
Affirmation
4
Non.
Une
« électrode de verre » est le type le plus courant d’électrode de
mesure du pH d’une solution.
Elle est
très sensible aux concentrations d’ions hydroniums de la solution.
Rappels :
pH d’une solution = - le logarithme décimal de la concentration
des ions oxonium = - log [H3O+].
Ions
hydronium = ions oxonium hydratés.
Page 4
Détection de l’équivalence
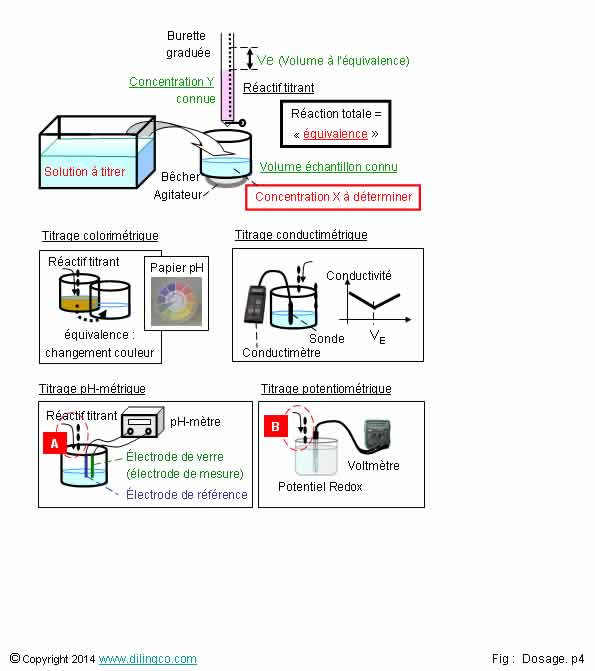
Sélectionner
l’affirmation exacte :
1- Le titrage
conductimétrique n’est pas adapté pour mesurer le pH d’une solution contenant
un acide fort ou une base forte
2- L’équivalence,
réaction quasi-totale et rapide, est une notion qui s’applique à un dosage ou à
un titrage
3- Un
pH-mètre mesure le potentiel électrochimique entre une électrode de référence,
de potentiel connu, et une électrode sensible à la concentration des ions H3O+
4- [B]. Connaître
les concentrations des couples redox à l’équivalence ne permet pas de calculer
le potentiel redox
L’affirmation
3 est exacte.
Affirmation
1
Si.
La grande
conductivité des ions H3O+, hydronium, ou HO-,
hydroxyde, rend le dosage conductimétrique très adapté pour mesurer
les pH forts ou faibles.
Le
conductimètre donne la conductance en Siemens, noté S.
Affirmation
2
Non.
L’équivalence, réaction quasi-totale et rapide, est une notion qui s’applique à un titrage (Il n’y a pas de
détection de réaction lors d’un dosage)
Note :
Pour que la réaction puisse être déterminée avec précision, la réaction doit
être nette ; quasi-totale et rapide.
Affirmation
3
Oui.
pH-mètre :
-
appareil de mesure du pH,
Rappel :
pH = - log [H3O+]
- mesure
le potentiel électrochimique entre 2 électrodes (combinées ou séparées),
- une
électrode de référence à potentiel connu
(au calomel,
Ag/agCl, …)
- une
électrode de mesure, dite électrode de verre, sensible à la concentration H3O+,
- le
pH-mètre doit être étalonné à l’aide de solutions tampon à pH connus
(Exemples : 4, 7, 10)
Affirmation
4
Si.
Connaissant
toutes les concentration des couples redox de l’équation bilan, on peut
calculer le potentiel redox à l’équivalence : équation de Nernst.
Voir Procédure de titrage redox
Danger :
Les acides sont dangereux et corrosifs.
Ne jamais verser de l’eau dans de l’acide.
On verse toujours, progressivement, l’acide dans l’eau.
Page 5
Titrage pH-métrique
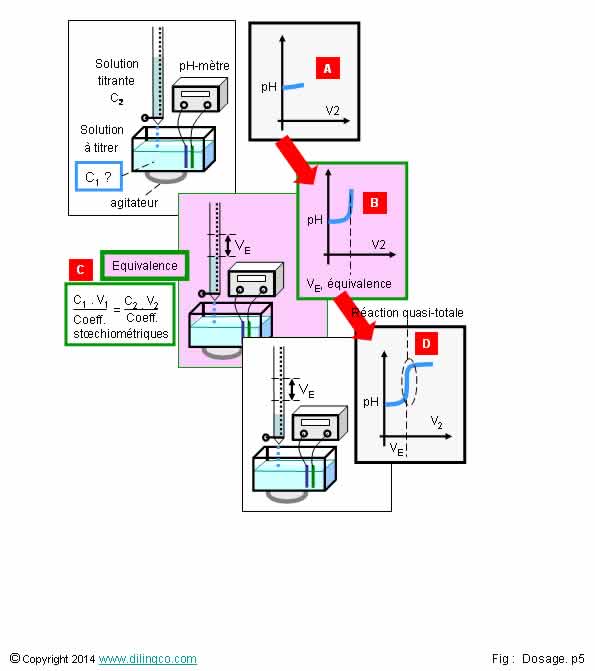
Sélectionner
l’affirmation exacte :
1- [A].
Au début, le réactif titré est le réactif limitant
2- [B]
& [D]. La réaction titrant/titré n’a pas besoin d’être rapide
3- Une
opération de titrage ne nécessite pas une réaction titrant/titré totale
4- [D]. À
l’équivalence, réaction totale, on a : (C1.V1)/coefficient
stoechiométrique1 = (C2.V2)/coefficient stoechiométrique2
L’affirmation
4 est exacte.
Affirmation
1
Non.
[A]. Au début, la réaction entre réactifs est limitée
par la quantité de mole du réactif titrant versée dans la solution à
titrer : le réactif titrant est le réactif
limitant.
Affirmation
2
Si.
[B] &
[D].
La
réaction titrant/titré a pas besoin d’être rapide pour que le VE, volume de
réactif titrant à l’équivalence, puisse être déterminé avec précision.
Affirmation
3
Si.
La réaction
titrant/titré doit être totale, plus de
réactif titrant ou titré, pour pouvoir écrire à l’équivalence :
Nombre de moles réactif titrant = Nombre de moles réactif titré.
Page 6
Exemple. Titrage d’une solution HCl
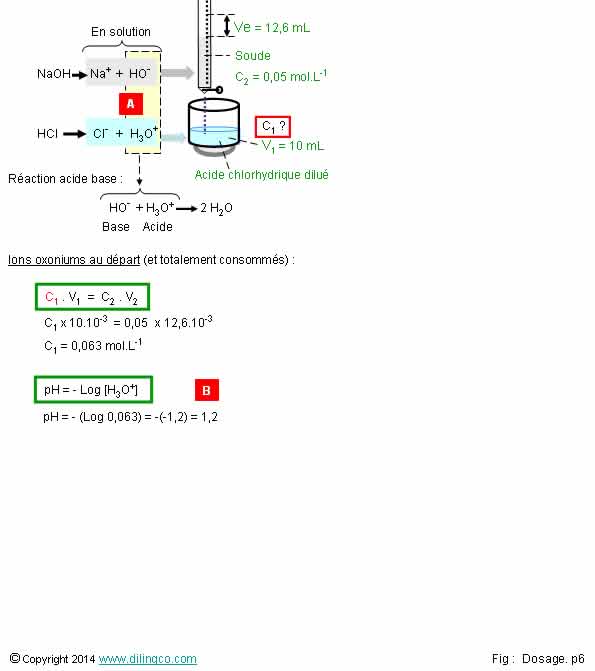
Sélectionner
l’affirmation exacte :
1- Avant
le titrage, le pH de la solution à titrer est égal au pka de l’acide
chlorhydrique
2- [A].
Réaction oxonium hydroxyde = réaction acide base : pour déterminer
l’équivalence il faut mesurer l’évolution des pH et tracer une courbe pH/volume
titrant versé
3- [B].
Le pH de départ calculé (pH = 1,2) correspond à celui d’un acide faible
L’affirmation
2 est exacte.
Affirmation
1
Non.
Avant le
titrage, le pH de la solution est égal à la concentration des ions H3O+
dans la solution. pH qui dépend de la quantité
d’acide versée dans la solution.
Le pKa de
l’acide chlorhydrique, pka=-7, est son potentiel
de dissociation, sa force.
Affirmation
2
Oui.
[A].
Réaction oxonium hydroxyde = réaction acide base
Affirmation
3
Non.
[B]. Le pH
de départ calculé (pH = 1,2) correspond à celui obtenu avec un acide fort, de pka
négatif.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Titrage & dosage

Sélectionner l’affirmation exacte :
1- Il faut toujours verser un réactif titrant pour déterminer la concentration d’un élément dans une solution
2- Dosage ou titrage : déterminer la quantité, la concentration d’une substance, dans une autre, dans une solution, dans un mélange
3- Un dosage chimique (ou titrage) n’est pas destructif
4- Tous les dosages sont destructifs
L’affirmation 2 est exacte.
Affirmation 1
Non.
Exemples:
- utilisation d’un papier pH qui, trempé dans la solution à mesurer, qui prend des couleurs acides ou basiques plus ou moins prononcées,
- dosages ph-métrique ou potentiométriques avec des sondes préalablement étalonnées,
- dosage spectrophotométriques (mesure de l’absorption lumineuse)
Affirmation 2
Oui.
Dosage et titrage : termes globalement similaires.
Affirmation 3
Si.
Les dosages (ou titrages) par réactions chimiques sont destructifs. Un échantillon de la solution est prélevée et versée dans un bécher pour être analysé. Un réactif titrant provoque une réaction chimique acido-basique ou d’oxydo-réduction.
A l’équivalence, le réactif titrant et le réactif titré ont été entièrement consommés.
Avant
l’équivalence, le réactif limitant est le réactif titrant.
Après l’équivalence, si on continu à verser du réactif titrant, il n’y a plus
de réactif titré : le réactif titré est le réactif limitant.
Affirmation 4
Non.
Les dosages par mesure d’une grandeur physique liée à une concentration sont souvent non destructifs.
Exemples : dosage spectrophotométriques (mesure de l’absorption lumineuse), dosages par étalonnages.
[A]. Méthode de dosage chromatographique
Très importante méthode de dosage : rechercher « Chromatographie » sur Internet.
L’échantillon à doser est contenu dans une phase mobile gazeuse ou liquide. Phase mobile en contact avec une phase fixe (papier, gélatine, polymère, …).
Des forces d’attractions faibles (Liaisons Van der Waals) s’établissent entre les éléments à doser et la phase fixe. Les vitesses de migration et les dépôts sont mesurés pour déterminer les éléments et les concentrations recherchées.
Titrage chimique :
- le réactif titrant versé dans la solution provoque une réaction chimique.
Les réactifs, titré et titrant, sont liés par une réaction chimique provoquée par versement progressif de réactif titrant dans la solution à titrer.
- la détection de cette réaction, associée au volume d’équivalence, permet de calculer le « titre », la concentration, de l’élément recherché.
Dosage par étalonnage :
- étalonnage préalable du dispositif par des mesures à partir de solutions à concentrations connues,
- comparaison de la solution à doser avec l’étalonnage préalable pour déterminer la concentration de l’élément recherché.
Il n’y a pas de réaction chimique dans la solution à doser.
L’électrode introduite dans la solution mesure un potentiel redox, potentiel comparé a la courbe de potentiels préalables obtenus par d’échantillonnages avec des concentrations différentes.
Voir aussi Pile Redox
Note :
Dans la mesure où les échantillonnages préalables ne sont pas toujours possibles, en milieux biologiques par exemple, le dosage d’une solution n’est pas toujours possible. Il faut alors procéder par titrage.
Page 2.
Rappels pka. pH

Sélectionner l’affirmation exacte :
1- pH = force d’un acide
2- pKa = force d’un acide
3- Les acides forts ont le même pka, le même pouvoir de dissociation, lorsqu’ils sont versés dans une solution
4- Acide : élément capable de capter des protons H+
L’affirmation 2 est exacte.
Affirmation 1 :
Non.
pH, potentiel hydrogène = concentration des ion hydronium (oxonium) d’une solution.
La concentration en H3O+ varie en fonction des concentrations d’acides ou de bases versées dans la solution.
Affirmation 3
Non.
Par exemple, l’acide sulfurique, pKa=-3, est plus fort, se dissocie mieux en solution, que l’acide nitrique de pka -1,8.
Affirmation 4
Non.
Acide : élément capable de donner des protons H+.
En solution aqueuse, ces protons s’associent immédiatement avec l’eau pour donner des cations Oxonium H3O+.
Pour pouvoir donner des H+, et donc par définition, les molécules d’acides ont des atomes d’hydrogène.
Exemples d’acides :
- HNO3, acide nitrique,
- HCL, acide chlorhydrique,
- HClO, acide perchlorique,
- H2SO4, acide sulfurique,
- etc.
Page 3.
Evolution du pH

Sélectionner l’affirmation exacte :
1- Le pH d’une solution est égal au pKa de l’acide contenu dans la solution aqueuse
2- [A] : l’accroissement du pH indique qu’un acide est progressivement ajouté
3- pH-métrie : mesure du potentiel d’hydrogène d’une solution
4- Une « électrode de verre » d’un pH-mètre est insensible aux ions hydronium
L’affirmation 3 est exacte.
Affirmation 1
Non.
Partant de l’eau pure, pH neutre = 7, l’ajout d’un acide augment la
concentration des ions oxonium H3O+ de la solution, et
fait baisser le pH.
pH = concentration des ion oxonium dans une solution = - log [H3O+]
Le pH
dépend des concentrations.
Le pka est le potentiel de dissociation d’un acide
et lui est spécifique.
Affirmation 2
Non.
[A] : l’accroissement du pH indique qu’une base est progressivement ajoutée.
Une décroissance du pH [B] indiquerait que de l’acide serait ajouté
Affirmation 3
Oui.
Le titrage d’une solution : déterminer le point d’équilibre acido-basique par ajouts croissants d’un élément de la réaction.
pH-métrie : mesure du potentiel d’hydrogène, pH, d’une solution
La mesure s’effectue avec un pH-mètre.
Affirmation 4
Non.
Une « électrode de verre » est le type le plus courant d’électrode de mesure du pH d’une solution.
Elle est très sensible aux concentrations d’ions hydroniums de la solution.
Rappels :
pH d’une solution = - le logarithme décimal de la concentration des ions oxonium = - log [H3O+].
Ions hydronium = ions oxonium hydratés.
Page 4
Détection de l’équivalence

Sélectionner l’affirmation exacte :
1- Le titrage conductimétrique n’est pas adapté pour mesurer le pH d’une solution contenant un acide fort ou une base forte
2- L’équivalence, réaction quasi-totale et rapide, est une notion qui s’applique à un dosage ou à un titrage
3- Un pH-mètre mesure le potentiel électrochimique entre une électrode de référence, de potentiel connu, et une électrode sensible à la concentration des ions H3O+
4- [B]. Connaître les concentrations des couples redox à l’équivalence ne permet pas de calculer le potentiel redox
L’affirmation 3 est exacte.
Affirmation 1
Si.
La grande conductivité des ions H3O+, hydronium, ou HO-, hydroxyde, rend le dosage conductimétrique très adapté pour mesurer les pH forts ou faibles.
Le conductimètre donne la conductance en Siemens, noté S.
Affirmation 2
Non.
L’équivalence, réaction quasi-totale et rapide, est une notion qui s’applique à un titrage (Il n’y a pas de détection de réaction lors d’un dosage)
Note : Pour que la réaction puisse être déterminée avec précision, la réaction doit être nette ; quasi-totale et rapide.
Affirmation 3
Oui.
pH-mètre :
- appareil de mesure du pH,
Rappel : pH = - log [H3O+]
- mesure le potentiel électrochimique entre 2 électrodes (combinées ou séparées),
- une électrode de référence à potentiel connu
(au calomel, Ag/agCl, …)
- une électrode de mesure, dite électrode de verre, sensible à la concentration H3O+,
- le pH-mètre doit être étalonné à l’aide de solutions tampon à pH connus (Exemples : 4, 7, 10)
Affirmation 4
Si.
Connaissant toutes les concentration des couples redox de l’équation bilan, on peut calculer le potentiel redox à l’équivalence : équation de Nernst.
Voir Procédure de titrage redox
Danger :
Les acides sont dangereux et corrosifs.
Ne jamais verser de l’eau dans de l’acide.
On verse toujours, progressivement, l’acide dans l’eau.
Page 5
Titrage pH-métrique

Sélectionner l’affirmation exacte :
1- [A]. Au début, le réactif titré est le réactif limitant
2- [B] & [D]. La réaction titrant/titré n’a pas besoin d’être rapide
3- Une opération de titrage ne nécessite pas une réaction titrant/titré totale
4- [D]. À l’équivalence, réaction totale, on a : (C1.V1)/coefficient stoechiométrique1 = (C2.V2)/coefficient stoechiométrique2
L’affirmation 4 est exacte.
Affirmation 1
Non.
[A]. Au début, la réaction entre réactifs est limitée par la quantité de mole du réactif titrant versée dans la solution à titrer : le réactif titrant est le réactif limitant.
Affirmation 2
Si.
[B] & [D].
La réaction titrant/titré a pas besoin d’être rapide pour que le VE, volume de réactif titrant à l’équivalence, puisse être déterminé avec précision.
Affirmation 3
Si.
La réaction titrant/titré doit être totale, plus de réactif titrant ou titré, pour pouvoir écrire à l’équivalence :
Nombre de moles réactif titrant = Nombre de moles réactif titré.
Page 6
Exemple. Titrage d’une solution HCl

Sélectionner l’affirmation exacte :
1- Avant le titrage, le pH de la solution à titrer est égal au pka de l’acide chlorhydrique
2- [A]. Réaction oxonium hydroxyde = réaction acide base : pour déterminer l’équivalence il faut mesurer l’évolution des pH et tracer une courbe pH/volume titrant versé
3- [B]. Le pH de départ calculé (pH = 1,2) correspond à celui d’un acide faible
L’affirmation 2 est exacte.
Affirmation 1
Non.
Avant le titrage, le pH de la solution est égal à la concentration des ions H3O+ dans la solution. pH qui dépend de la quantité d’acide versée dans la solution.
Le pKa de l’acide chlorhydrique, pka=-7, est son potentiel de dissociation, sa force.
Affirmation 2
Oui.
[A]. Réaction oxonium hydroxyde = réaction acide base
Affirmation 3
Non.
[B]. Le pH de départ calculé (pH = 1,2) correspond à celui obtenu avec un acide fort, de pka négatif.