Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Réactions Acido-basiques
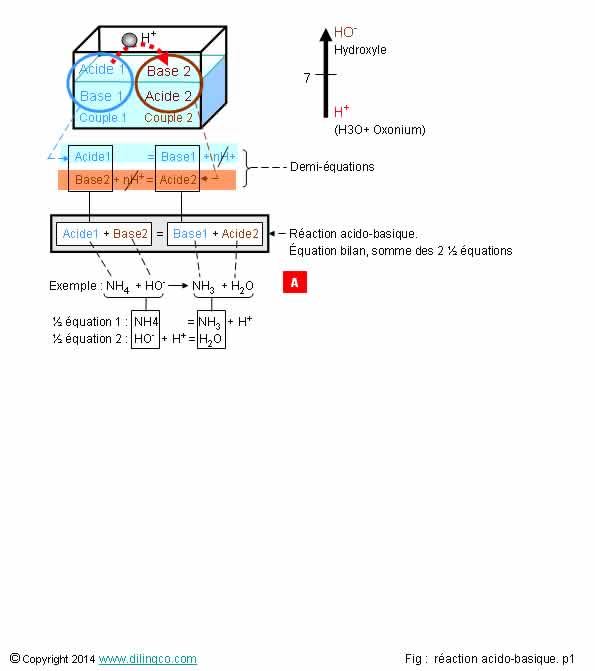
Sélectionner
l’affirmation exacte :
1- [A]. NH4
et NH3 ont des atomes H, ce sont des acides
2- [A]. H2O
est la base du couple 2
3- Réaction
acido-basique : échange de protons entre l’acide d’un couple A1/B1 et la
base d’un couple A2/B2
4- La
formation d’un couple acide-base (voir paragraphes précédents) n’est pas une
réaction acido-basique
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A].
Avoir des
atomes H n’est pas un critère suffisant pour être un acide.
Selon la
réaction, une molécule est considérée comme un acide ou comme une base.
Un acide (définition de Bronsted) est une espèce
capable de céder au moins un proton H+.
Une base est une espèce capable de capter au moins un proton H+.
Autre
définition d’une base (définition
d’Arrhenius) : espèce chimique qui en solution
donne des ions hydroxydes HO-
Affirmation
2
Non.
H2O
a, dans cette équation, un caractère basique.
Voir Eau
ampholyte
Affirmation
3
Oui.
Réaction acido-basique : transfert d’un proton H+
entre les réactifs.
Affirmation
4
Si.
La
formation d’un couple acide base, lors de la mise d’un acide ou d’une base dans
l’eau, est une réaction acido-basique.
La
réaction acido-basique est un passage d’un proton H+ d’un élément
chimique à l’autre :
Réaction
acido-basique de la figure :
NH4
+ HO- -> NH3 + H2O
Dans le
couple acide-base NH4/NH3,
NH4
est l’acide,
NH3
sa base conjuguée.
Par
soucis de progression ordonnée, le thème « Acide base » a été divisé
en chapitres :
- Couple
acide-base,
- Calcul
du pH d’une solution,
-
réaction acido-basique (Ce chapitre).
Le
deuxième élément chimique de la réaction acido-basique peut être, un deuxième
élément mis dans la solution, ou l’eau.
- pH-métrie.
Page 2.
Demi-équations
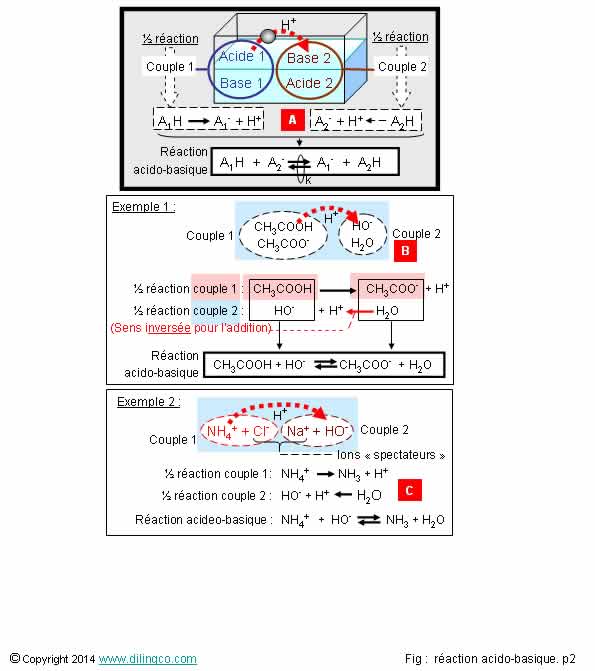
Sélectionner
l’affirmation exacte :
1- Une
réaction acido-basique se fait toujours dans le sens acide1-base2
2- [A]. Réaction
acido-basique bilan : somme des 2 demi-équations relatives à chaque couple
3- [B].
Couple 2 : H2O, H+
L’affirmation
2 est exacte.
Affirmation
1
Non.
Le sens
de la réaction dépend de la constante d’équilibre K de la réaction.
Voir pages suivantes.
Affirmation
2
Oui.
[A].
Réaction acido-basique : somme des 2 demi-équations relatives à chaque
couple.
La demi-réaction du couple 2 (celle qui fournit la base) est présentée inversée, produits mis à gauche, pour faire ressortir les éléments additionnés de
la réaction bilan.
Les
protons H, des 2 côtés de l’équation, s’annulent.
Affirmation
3
Non.
[A]. Couple
2 : H2O, HO-
Dans cet
exemple, l’eau est prise dans son caractère acide, base conjuguée : ion
hydroxyde HO-
Voir Eau
ampholyte
Note :
Pour
pouvoir obtenir la réaction acido-basique par addition des 2 demies équations, l’équation du couple dont est issue la base est inversée.
Voir figure.
Page 3.
Sens de la réaction
acido-basique
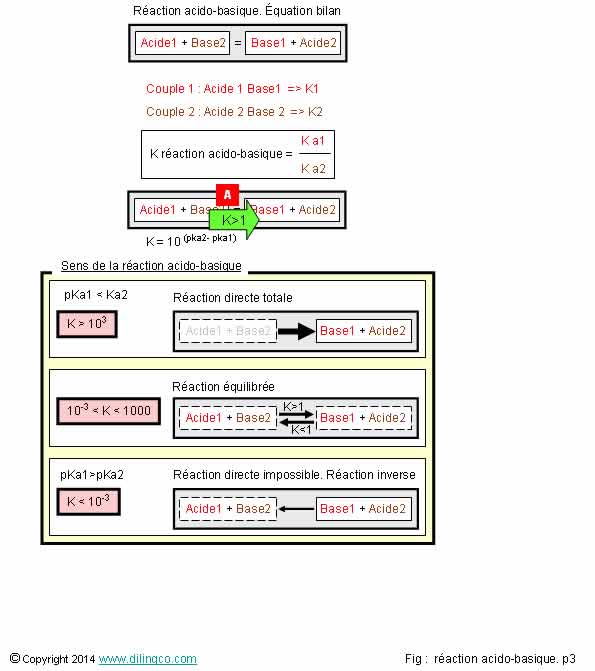
Sélectionner
les deux affirmations exactes :
1- Une réaction
acido-basique est toujours dans le Acide1-base2 donne Base1-acide1
2- Ka
négatif (Ka du couple 1 bien supérieure à Ka du couple 2) : la réaction Acide1-base2
Base1-acide1 reste possible
3- La
réaction acido-basique est totale si la différence des pKa des 2 couples est
supérieure à 3
4- pKa
couple1=7 et pKa couple2=6 : la réaction acido-basique est totale
5- [A]. ka1
> Ka2 même chose que pKa1 > pKa2
Les affirmations
3 et 5 sont exactes.
Affirmation
2
Non.
Ka1 bien
supérieure à Ka2 : la réaction est totale et se fait dans le sens direct pour
donner des produits Base1, Acide 2
Affirmation
3
Oui.
Si la différence des pKa>3 alors K>1000 : réaction
totale directe ou indirecte.
Affirmation
4
Non.
pKa
couple1=7 et pKa couple2=6
Différence
pka = 7 – 6 = 1
Différence
des pka inférieure à 3 (<1000) : réaction non totale.
Affirmation
5
Non.
[A]. ka1
> Ka2 n’est pas la même chose que pKa1 > pKa2
(pKa= -logKa,
il faut inverser la différence)
Page 4.
Représentations « Règle
du gamma »
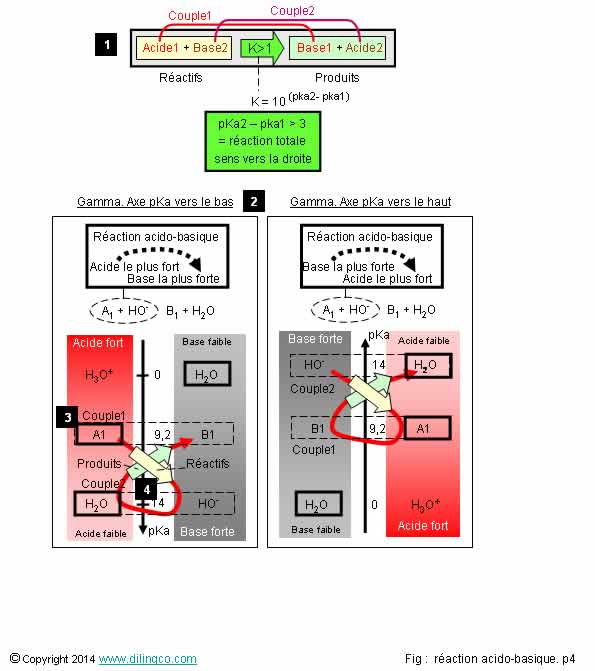
Sélectionner
les deux affirmations exactes :
1- Une
seule représentation « figure gamma » possible
2- Le
sens du tracé du gamma indique l’acide et la base concernés par la réaction
acido-basique
3-
L’étape [3] consiste à entourer les espèces initialement présentes dans la
solution
4-
« Soit un mélange initial d’acide A1 et de base B2 dans l’eau » =
2 espèces initiales
5- Un tracé
du gamma d’une réaction acido-basique se fait des éléments les plus forts
(acide ou base) de la réaction vers les éléments les plus faibles
6- Acide
fort = pKa fort
Les
affirmations 3 et 5 sont exactes.
Affirmation
1
Non.
2 figures
possibles pour trouver le sens du « gamma » (lettre grecque):
- L’axe des pka tournée vers le bas
Dans ce
cas, les acides sont représentés à gauche
de l’axe, les acides forts (pKa les plus petits) en haut.
- L’axe des pka tourné vers le haut
Dans ce
cas, les bases sont représentées à gauche
de l’axe, les bases fortes (pKa les plus grands) en haut.
Ces 2 représentations sont identiques et conduisent aux mêmes
résultats.
Ce
chapitre utilise indifféremment l’une ou l’autre des représentations possibles.
Affirmation
2
Non.
C’est
l’équation [1] acido-basique qui définit les éléments concernés.
Comme
expliquée précédemment, cette équation résulte de 2 demi-équations.
Le sens du tracé du gamma indique dans quel sens se fait la
réaction « Réactifs – produits ».
Les gamma
de la figure sont des gamma directs : réactions vers la droite, des
réactifs vers les produits, comme représenté par l’équation [1].
Pour être
plus précis, selon les règles de la thermodynamique, ou comme expliqué page
précédente :
- la
réaction peut se faire comme représentés sur la figure
Acide1+base2
-> base1+acide2
- se
faire dans les 2 sens ; réaction équilibrée
- se
faire dans le sens inverse
base1+acide2
-> acide1+base2
Affirmation
4
Non.
« Soit
un mélange initial d’acide A1 et de base B2 dans l’eau » = 3
espèces initiales :
-
Acide A1,
-
Base B1,
-
Eau.
Note:
L’espèce initiale “eau” est a entourer 2 fois: une fois en tant qu’acide, une
fois en tant que base.
Affirmation
6
Non.
Attention !
Acide fort = pKa faible
Note :
les acides dits « forts » s’ils ont des pka négatifs (pka : -2,
…).
Procédure
[1]. Ecrire
les 2 demi-réactions et trouver la réaction acido-basique résultante.
[2]. Choisir
une représentation axe pka vers le bas (et acides à gauche) ou axe pka vers le
haut (et bases à gauche)
[3]. Entourer
les espèces initiales. H2O est systématiquement à entourer 2 fois. Les pKa H3O+/H2O (=0) et
HO-/H2O (=1) et leurs positionnements sont à connaître
par cœur !
[4]. Tracer le gamma
Acide le
plus fort vers base la plus forte (axe des pKa vers le bas)
Base la
forte vers acide le plus fort (axe des pKa vers le haut).
Obtient-on
un gamma direct ? ou un gamma inversé ?
Voir page suivante.
[5].
Calculer la constante d’équilibre K de la réaction acido-basique.
K=
Ka1/Ka2
ou plus
généralement, les pKa étant fournis :
K=
10^pka2-pka1
[6].
Vérifier les
conditions (Apparition d’une nouvelle espèce, plusieurs réactions
prépondérantes, …)
Règle du Gamma = sens des réactions acido-basiques et d’oxydo-réduction
La règle
du gamma est utilisée pour trouver le sens :
- des réactions acido-basiques,
- des réactions d’oxido-réduction.
Page
5.
Gamma direct &
inversé
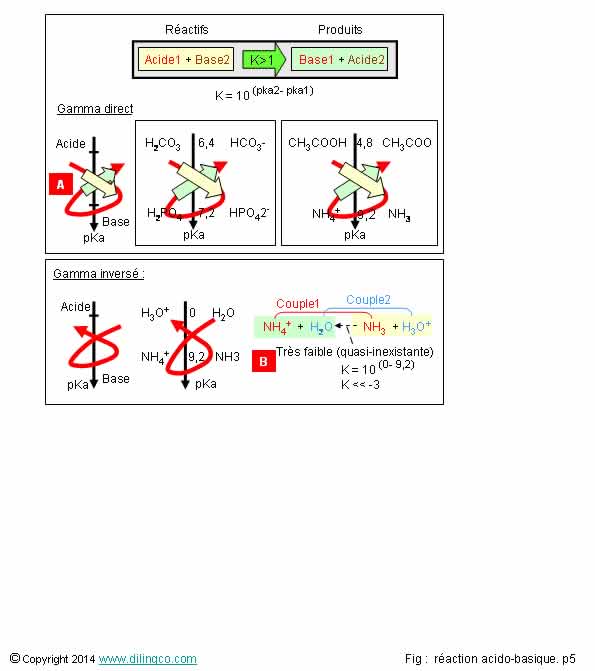
Sélectionner
l’affirmation exacte :
1- Gamma
direct : la réaction est totale
2- [A]. Gamma
direct : l’acide le plus puissant avec la base la plus puissante
3- [A].
Réactifs : acide de pka le plus grand avec la base de pka le plus petit
4- [B]. La
réaction est totale de droite à gauche
L’affirmation
2 est exacte.
Affirmation
1
Non.
C’est la
différence des pKa qui indique si une réaction acide-base est totale,
équilibrée, ou impossible dans le sens réactifs forts<->produits.
Différence des pKa > 3 = réaction totale,
dans le sens réactifs forts->produits.
Différence
des pka faible = réaction équilibrée ; dans les 2 sens.
Différence
des pKa <-3 = réaction quasi-impossible dans le sens
produits<->réactifs forts.
Affirmation
2
Oui.
Le sens du gamma = sens de la réaction
Les éléments les plus forts réagissent pour donner les
produits.
2 cas types obtenus :
- « g Gamma direct » : réaction thermodynamique acido-basique
favorable. - « g Gamma inversé » : réaction thermodynamique
acido-basique défavorable.
Affirmation
3
Non.
[A].
Réactifs : acide fort (pKa le plus petit)
et base forte (pka le plus grand).
Affirmation
4
Non.
[A].
Différence
des pka : (0 – 9,2) =-9,2
Très
inférieur à -3 : réaction de tendance produits -> réactifs mais
« quasi-impossible » (règles de la thermodynamique).
Règle du Gamma = sens des réactions acido-basiques et d’oxydo-réduction
La règle
du gamma est utilisée pour déterminer le sens :
- des réactions acido-basiques,
- des réactions d’oxido-réduction.
Page 6.
Exemple. Chlorure
d’ammonium. Gamma
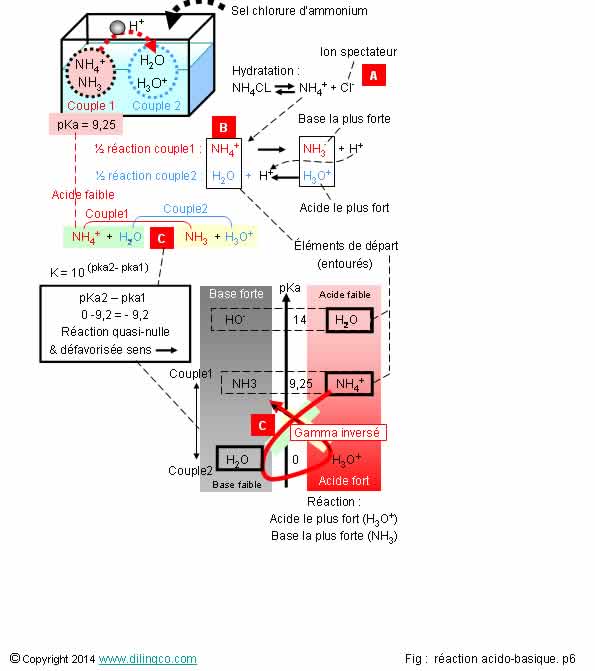
Sélectionner
l’affirmation exacte :
1- [A]. Les
ions « spectateurs » entrent dans l’équation de la réaction acido-basique
2- Les
espèces entourées dans la figure du gamma sont les espèces initiales de la
solution (Moins l’ion chlore qui n’intervient pas dans la réaction
acido-basique)
3- [B]. NH4
est une base
4- [C].
La valeur de K et le sens du gamma indiquent une réaction ammonium (NH4+) H2O
favorable
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A]. Les
ions « spectateurs » :
-
n’entrent pas dans les demi-équations,
-
n’entrent pas dans l’équation bilan acido-basique,
- n’ont
pas à être mentionnés (et entourés) dans la figure du gamma.
Affirmation
2
Oui.
L’ion
ammonium NH4+, l’eau en tant que base et en tant
qu’acide, sont les espèces initiales entourées dans la figure du gamma.
L’ion chlore, ne participe pas à la réaction acido-basique, et ne figure pas
dans la figure du gamma.
Affirmation
3
Non.
NH4
est un acide : il fournit un proton H+.
De par le
pka du couple NH4+/NH3, NH4 est un
acide faible ; il se dissocie peu dans la solution.
Très peu
d’ions oxonium = K très faible.
Affirmation
4
Non.
[C]. La
valeur de K : 10^-9,2 très très
faible : réaction quasi-nulle.
Sens du
gamma = gamma inversé : la
réaction qui se fait n’est pas la réaction NH4/H2O mais la réaction H3O+/NH3 = sens droite gauche.
Page 7.
Exemple. Chlorure
d’ammonium. pH
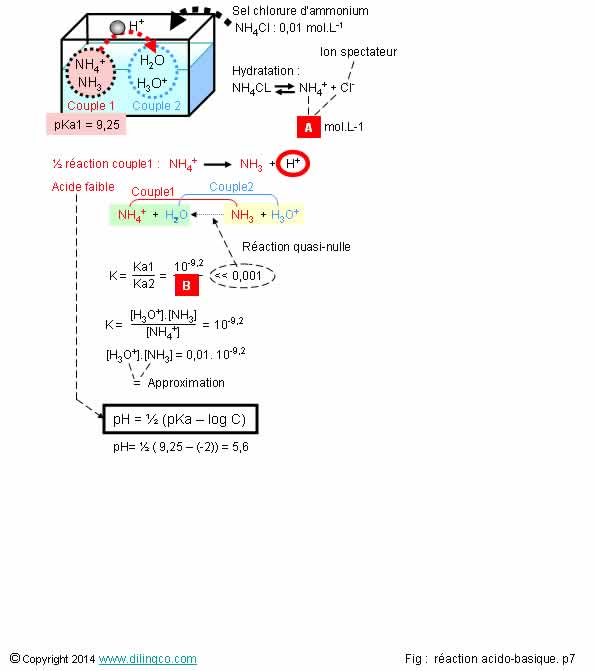
Sélectionner
l’affirmation exacte :
1- [A].
0,005 moles d’ions ammonium et de chlore par litre
2- [B].
Ka2 = 10^-14
3- Acide
faible : la relation pH=1/2 (pKa – logC) peut être utilisée pour calculer
le pH de la solution
4- [C].
La réaction est basique
L’affirmation
3 est exacte.
Affirmation
1
Non.
Même
nombre de moles pour chaque fille que le nombre de moles mères.
(0,01
moles par litres)
Affirmation
2
Non.
[B]. Ka2
est ici le pKa du couple H2O/H3O+ de l’eau, pka=0.
Eau
ampholyte.
Affirmation
3
Oui.
NH4, même
avec un pKa=9,2 est un acide pour la réaction : il fournit le proton H+
Acides
forts : pkA = -2 et <
Réactions
approximatives de calcul du pH : voir Calculs du pH
Affirmation
4
Non.
[C]. De
manière logique, l’acide faible NH4+ donne une solution,
inférieure à 7, faiblement acide (pH=5,6).
Page 8.
Réaction prépondérante
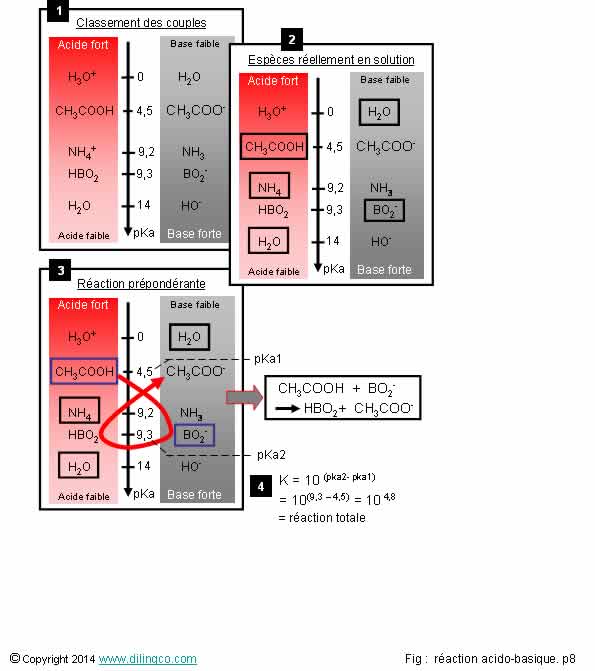
Sélectionner
l’affirmation exacte :
1- 2
acides de pka voisins dans une solution : on considère l’acide de plus
petit pka comme le seul important
2- On
peut dire qu’il y a une réaction prépondérante si un des (2) acides est
nettement plus fort que (les) l’autre (différence des pKa > 2)
3- Réaction
prépondérante : l’acide le plus fort réagit toujours entièrement avec la
base la plus forte
4- Les
espèces à entourer pour tracer la figure du gamma sont toutes les espèces
chimiques présentes dans la solution
L’affirmation
2 est exacte.
Affirmation
1
Non.
Si les 2
acides ont des pka voisins, on ne peut pas conclure qu’une réaction est prépondérante.
Les deux acides sont à considérer. Il faut écrire les équations de réactions
pour chaque acide.
Le pH est
le –log (Concentrations H3O+ apportés par chaque acide)
Affirmation2
Oui.
On peut
dire qu’il y a une réaction prépondérante
si un des (2) acides est nettement plus fort que (les) l’autre (différence des pKa > 2)
Figure :
Il y a une réaction prépondérante ; CH3COOH est un acide
beaucoup plus fort (pka=4,5) que NH4, pka=9,2.
Affirmation
3
Non.
Une
réaction acido-basique, même prépondérante, n’est pas toujours totale :
calculer K.
Affirmation
4
Non.
Les
espèces à entourer :
- les
espèces initiales mentionnées dans l’énoncé « Un mélange formé de
…. »
- l’eau,
H2O acide et H2O basique.
Ne pas entourer les ions spectateurs
(Ils
n’interviennent pas dans les réactions acido-basiques).
Ne jamais entourer les éléments produits de couples acido-basiques.
Exemple
figure :
- CH3COO-
et NH3, bien que présents, sont des produits de couples et ne
doivent pas être entourés.
Page 9.
Mélanges
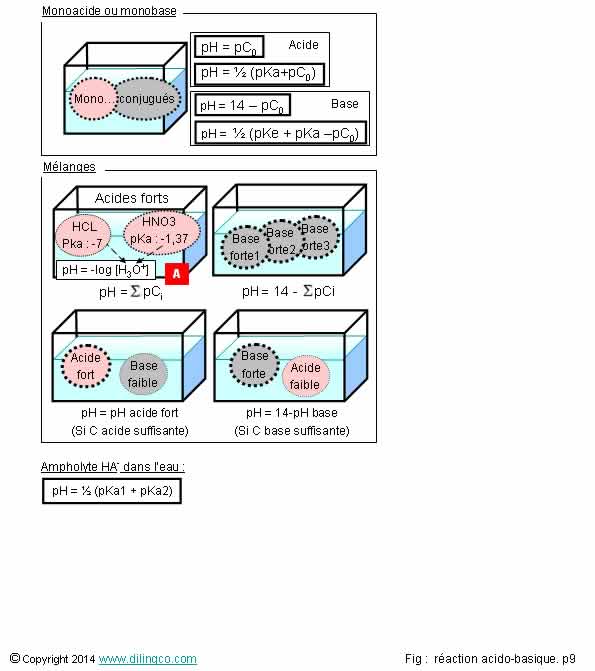
Sélectionner
les deux affirmations
exactes :
1- Solution
de 2 acides forts, pH = - log (2 fois [Oxonium] apportés par l’un des acides)
2-
Mélange d’un acide fort et d’un acide faible (différence des pka >2),
l’acide fort impose son pH (Si la concentration en acide fort n’est pas trop
faible)
3- [A].
Les 2 acides sont des acides forts : il n’est pas possible de considérer
qu’il y a réaction prépondérante de l’acide chlorhydrique
4-
Mélange d’acides faibles de pKa proches : les concentrations relatives des
acides ne jouent pas
5- HCO3
est un ampholyte. Dans l’eau son pH = 1/2 (pka couple acide/base conjuguée) + ½
(pka couple base/acide conjugué)
Les
affirmations 2 et 5 sont exactes.
Affirmation
1
Non.
Il faut
tenir compte des concentrations de chaque acide et des volumes initiaux de
solutions mélangés.
Calcul des concentrations d’ions oxonium apportés par chaque acide :
pH = - log ([Oxonium dus à acide1] + [Oxonium dus à
acide2])
Procédure
à suivre:
1- Nombre de moles contenues dans chaque solution
initiale
n1=C1.V1,
n2=C2.V2
2-
Somme des moles = total des [H3O+]
= n1+N2
3- Volume total. V = V1+V2
4- Calculer la concentration obtenue en ions H3O+ : n1+n2 / V1+V2
5- pH = - log [Concentration H3O+
obtenue]
Note :
Si le pH
trouvé est < 6,5 les oxoniums d’autoprotolyse de l’eau sont effectivement négligeables.
Affirmation
3
Si.
Mais même
si on peut négliger l’apport en H3O+ par l’acide faible
(qui ne se dissocie pas), il faut ramener le nombre de moles H3O+
de l’acide fort au nouveau volume du mélange.
1- Nombre de moles n1 de l’acide fort,
2-
Nouveau volume V=V1+V2
3-
Concentration C= n1/V
4- pH= - log [C]
Affirmation
4
Si.
Acides faibles de pka voisins :
pH=-1/2 log (Ka1.C1+Ka2.C2)
Acides
faibles de pKa distincts : faire les calculs pour trouver les concentrations
en H3O+.
Affirmation
5
Oui.
HCO3
est un ampholyte.
-
Acide : HCO3- => CO32- +
H+ pka=10,3
-
Base : HCO3- + H+ => H2O
+CO2 pka = 6,4
PH
= ½ (10,3 + 6,4) = 8,35
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Réactions Acido-basiques

Sélectionner l’affirmation exacte :
1- [A]. NH4 et NH3 ont des atomes H, ce sont des acides
2- [A]. H2O est la base du couple 2
3- Réaction acido-basique : échange de protons entre l’acide d’un couple A1/B1 et la base d’un couple A2/B2
4- La formation d’un couple acide-base (voir paragraphes précédents) n’est pas une réaction acido-basique
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A].
Avoir des atomes H n’est pas un critère suffisant pour être un acide.
Selon la réaction, une molécule est considérée comme un acide ou comme une base.
Un acide (définition de Bronsted) est une espèce capable de céder au moins un proton H+.
Une base est une espèce capable de capter au moins un proton H+.
Autre définition d’une base (définition d’Arrhenius) : espèce chimique qui en solution donne des ions hydroxydes HO-
Affirmation 2
Non.
H2O a, dans cette équation, un caractère basique.
Voir Eau ampholyte
Affirmation 3
Oui.
Réaction acido-basique : transfert d’un proton H+ entre les réactifs.
Affirmation 4
Si.
La formation d’un couple acide base, lors de la mise d’un acide ou d’une base dans l’eau, est une réaction acido-basique.
La réaction acido-basique est un passage d’un proton H+ d’un élément chimique à l’autre :
Réaction acido-basique de la figure :
NH4 + HO- -> NH3 + H2O
Dans le couple acide-base NH4/NH3,
NH4 est l’acide,
NH3 sa base conjuguée.
Par soucis de progression ordonnée, le thème « Acide base » a été divisé en chapitres :
- Couple acide-base,
- Calcul du pH d’une solution,
- réaction acido-basique (Ce chapitre).
Le deuxième élément chimique de la réaction acido-basique peut être, un deuxième élément mis dans la solution, ou l’eau.
- pH-métrie.
Page 2.
Demi-équations

Sélectionner l’affirmation exacte :
1- Une réaction acido-basique se fait toujours dans le sens acide1-base2
2- [A]. Réaction acido-basique bilan : somme des 2 demi-équations relatives à chaque couple
3- [B]. Couple 2 : H2O, H+
L’affirmation 2 est exacte.
Affirmation 1
Non.
Le sens de la réaction dépend de la constante d’équilibre K de la réaction.
Voir pages suivantes.
Affirmation 2
Oui.
[A].
Réaction acido-basique : somme des 2 demi-équations relatives à chaque
couple.
La demi-réaction du couple 2 (celle qui fournit la base) est présentée inversée, produits mis à gauche, pour faire ressortir les éléments additionnés de
la réaction bilan.
Les protons H, des 2 côtés de l’équation, s’annulent.
Affirmation 3
Non.
[A]. Couple 2 : H2O, HO-
Dans cet exemple, l’eau est prise dans son caractère acide, base conjuguée : ion hydroxyde HO-
Voir Eau ampholyte
Note :
Pour pouvoir obtenir la réaction acido-basique par addition des 2 demies équations, l’équation du couple dont est issue la base est inversée.
Voir figure.
Page 3.
Sens de la réaction acido-basique

Sélectionner les deux affirmations exactes :
1- Une réaction acido-basique est toujours dans le Acide1-base2 donne Base1-acide1
2- Ka négatif (Ka du couple 1 bien supérieure à Ka du couple 2) : la réaction Acide1-base2 Base1-acide1 reste possible
3- La réaction acido-basique est totale si la différence des pKa des 2 couples est supérieure à 3
4- pKa couple1=7 et pKa couple2=6 : la réaction acido-basique est totale
5- [A]. ka1 > Ka2 même chose que pKa1 > pKa2
Les affirmations 3 et 5 sont exactes.
Affirmation 2
Non.
Ka1 bien supérieure à Ka2 : la réaction est totale et se fait dans le sens direct pour donner des produits Base1, Acide 2
Affirmation 3
Oui.
Si la différence des pKa>3 alors K>1000 : réaction totale directe ou indirecte.
Affirmation 4
Non.
pKa couple1=7 et pKa couple2=6
Différence pka = 7 – 6 = 1
Différence des pka inférieure à 3 (<1000) : réaction non totale.
Affirmation 5
Non.
[A]. ka1 > Ka2 n’est pas la même chose que pKa1 > pKa2
(pKa= -logKa, il faut inverser la différence)
Page 4.
Représentations « Règle du gamma »

Sélectionner les deux affirmations exactes :
1- Une seule représentation « figure gamma » possible
2- Le sens du tracé du gamma indique l’acide et la base concernés par la réaction acido-basique
3- L’étape [3] consiste à entourer les espèces initialement présentes dans la solution
4- « Soit un mélange initial d’acide A1 et de base B2 dans l’eau » = 2 espèces initiales
5- Un tracé du gamma d’une réaction acido-basique se fait des éléments les plus forts (acide ou base) de la réaction vers les éléments les plus faibles
6- Acide fort = pKa fort
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
2 figures possibles pour trouver le sens du « gamma » (lettre grecque):
- L’axe des pka tournée vers le bas
Dans ce cas, les acides sont représentés à gauche de l’axe, les acides forts (pKa les plus petits) en haut.
- L’axe des pka tourné vers le haut
Dans ce cas, les bases sont représentées à gauche de l’axe, les bases fortes (pKa les plus grands) en haut.
Ces 2 représentations sont identiques et conduisent aux mêmes résultats.
Ce chapitre utilise indifféremment l’une ou l’autre des représentations possibles.
Affirmation 2
Non.
C’est l’équation [1] acido-basique qui définit les éléments concernés.
Comme expliquée précédemment, cette équation résulte de 2 demi-équations.
Le sens du tracé du gamma indique dans quel sens se fait la réaction « Réactifs – produits ».
Les gamma de la figure sont des gamma directs : réactions vers la droite, des réactifs vers les produits, comme représenté par l’équation [1].
Pour être plus précis, selon les règles de la thermodynamique, ou comme expliqué page précédente :
- la réaction peut se faire comme représentés sur la figure
Acide1+base2 -> base1+acide2
- se faire dans les 2 sens ; réaction équilibrée
- se faire dans le sens inverse
base1+acide2 -> acide1+base2
Affirmation 4
Non.
« Soit un mélange initial d’acide A1 et de base B2 dans l’eau » = 3 espèces initiales :
- Acide A1,
- Base B1,
- Eau.
Note:
L’espèce initiale “eau” est a entourer 2 fois: une fois en tant qu’acide, une fois en tant que base.
Affirmation 6
Non.
Attention !
Acide fort = pKa faible
Note : les acides dits « forts » s’ils ont des pka négatifs (pka : -2, …).
Procédure
[1]. Ecrire les 2 demi-réactions et trouver la réaction acido-basique résultante.
[2]. Choisir une représentation axe pka vers le bas (et acides à gauche) ou axe pka vers le haut (et bases à gauche)
[3]. Entourer
les espèces initiales. H2O est systématiquement à entourer 2 fois. Les pKa H3O+/H2O (=0) et
HO-/H2O (=1) et leurs positionnements sont à connaître
par cœur !
[4]. Tracer le gamma
Acide le plus fort vers base la plus forte (axe des pKa vers le bas)
Base la forte vers acide le plus fort (axe des pKa vers le haut).
Obtient-on un gamma direct ? ou un gamma inversé ?
Voir page suivante.
[5]. Calculer la constante d’équilibre K de la réaction acido-basique.
K= Ka1/Ka2
ou plus généralement, les pKa étant fournis :
K= 10^pka2-pka1
[6]. Vérifier les conditions (Apparition d’une nouvelle espèce, plusieurs réactions prépondérantes, …)
Règle du Gamma = sens des réactions acido-basiques et d’oxydo-réduction
La règle du gamma est utilisée pour trouver le sens :
- des réactions acido-basiques,
- des réactions d’oxido-réduction.
Page 5.
Gamma direct & inversé

Sélectionner l’affirmation exacte :
1- Gamma direct : la réaction est totale
2- [A]. Gamma direct : l’acide le plus puissant avec la base la plus puissante
3- [A]. Réactifs : acide de pka le plus grand avec la base de pka le plus petit
4- [B]. La réaction est totale de droite à gauche
L’affirmation 2 est exacte.
Affirmation 1
Non.
C’est la différence des pKa qui indique si une réaction acide-base est totale, équilibrée, ou impossible dans le sens réactifs forts<->produits.
Différence des pKa > 3 = réaction totale,
dans le sens réactifs forts->produits.
Différence des pka faible = réaction équilibrée ; dans les 2 sens.
Différence des pKa <-3 = réaction quasi-impossible dans le sens produits<->réactifs forts.
Affirmation 2
Oui.
Le sens du gamma = sens de la réaction
Les éléments les plus forts réagissent pour donner les produits.
2 cas types obtenus :
- « g Gamma direct » : réaction thermodynamique acido-basique favorable. - « g Gamma inversé » : réaction thermodynamique acido-basique défavorable.
Affirmation 3
Non.
[A]. Réactifs : acide fort (pKa le plus petit) et base forte (pka le plus grand).
Affirmation 4
Non.
[A].
Différence des pka : (0 – 9,2) =-9,2
Très inférieur à -3 : réaction de tendance produits -> réactifs mais « quasi-impossible » (règles de la thermodynamique).
Règle du Gamma = sens des réactions acido-basiques et d’oxydo-réduction
La règle du gamma est utilisée pour déterminer le sens :
- des réactions acido-basiques,
- des réactions d’oxido-réduction.
Page 6.
Exemple. Chlorure d’ammonium. Gamma

Sélectionner l’affirmation exacte :
1- [A]. Les ions « spectateurs » entrent dans l’équation de la réaction acido-basique
2- Les espèces entourées dans la figure du gamma sont les espèces initiales de la solution (Moins l’ion chlore qui n’intervient pas dans la réaction acido-basique)
3- [B]. NH4 est une base
4- [C]. La valeur de K et le sens du gamma indiquent une réaction ammonium (NH4+) H2O favorable
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A]. Les ions « spectateurs » :
- n’entrent pas dans les demi-équations,
- n’entrent pas dans l’équation bilan acido-basique,
- n’ont pas à être mentionnés (et entourés) dans la figure du gamma.
Affirmation 2
Oui.
L’ion
ammonium NH4+, l’eau en tant que base et en tant
qu’acide, sont les espèces initiales entourées dans la figure du gamma.
L’ion chlore, ne participe pas à la réaction acido-basique, et ne figure pas
dans la figure du gamma.
Affirmation 3
Non.
NH4 est un acide : il fournit un proton H+.
De par le pka du couple NH4+/NH3, NH4 est un acide faible ; il se dissocie peu dans la solution.
Très peu d’ions oxonium = K très faible.
Affirmation 4
Non.
[C]. La valeur de K : 10^-9,2 très très faible : réaction quasi-nulle.
Sens du gamma = gamma inversé : la réaction qui se fait n’est pas la réaction NH4/H2O mais la réaction H3O+/NH3 = sens droite gauche.
Page 7.
Exemple. Chlorure d’ammonium. pH

Sélectionner l’affirmation exacte :
1- [A]. 0,005 moles d’ions ammonium et de chlore par litre
2- [B]. Ka2 = 10^-14
3- Acide faible : la relation pH=1/2 (pKa – logC) peut être utilisée pour calculer le pH de la solution
4- [C]. La réaction est basique
L’affirmation 3 est exacte.
Affirmation 1
Non.
Même nombre de moles pour chaque fille que le nombre de moles mères.
(0,01 moles par litres)
Affirmation 2
Non.
[B]. Ka2 est ici le pKa du couple H2O/H3O+ de l’eau, pka=0.
Eau ampholyte.
Affirmation 3
Oui.
NH4, même avec un pKa=9,2 est un acide pour la réaction : il fournit le proton H+
Acides forts : pkA = -2 et <
Réactions approximatives de calcul du pH : voir Calculs du pH
Affirmation 4
Non.
[C]. De manière logique, l’acide faible NH4+ donne une solution, inférieure à 7, faiblement acide (pH=5,6).
Page 8.
Réaction prépondérante

Sélectionner l’affirmation exacte :
1- 2 acides de pka voisins dans une solution : on considère l’acide de plus petit pka comme le seul important
2- On peut dire qu’il y a une réaction prépondérante si un des (2) acides est nettement plus fort que (les) l’autre (différence des pKa > 2)
3- Réaction prépondérante : l’acide le plus fort réagit toujours entièrement avec la base la plus forte
4- Les espèces à entourer pour tracer la figure du gamma sont toutes les espèces chimiques présentes dans la solution
L’affirmation 2 est exacte.
Affirmation 1
Non.
Si les 2 acides ont des pka voisins, on ne peut pas conclure qu’une réaction est prépondérante. Les deux acides sont à considérer. Il faut écrire les équations de réactions pour chaque acide.
Le pH est le –log (Concentrations H3O+ apportés par chaque acide)
Affirmation2
Oui.
On peut dire qu’il y a une réaction prépondérante si un des (2) acides est nettement plus fort que (les) l’autre (différence des pKa > 2)
Figure : Il y a une réaction prépondérante ; CH3COOH est un acide beaucoup plus fort (pka=4,5) que NH4, pka=9,2.
Affirmation 3
Non.
Une réaction acido-basique, même prépondérante, n’est pas toujours totale : calculer K.
Affirmation 4
Non.
Les espèces à entourer :
- les espèces initiales mentionnées dans l’énoncé « Un mélange formé de …. »
- l’eau,
H2O acide et H2O basique.
Ne pas entourer les ions spectateurs
(Ils n’interviennent pas dans les réactions acido-basiques).
Ne jamais entourer les éléments produits de couples acido-basiques.
Exemple figure :
- CH3COO- et NH3, bien que présents, sont des produits de couples et ne doivent pas être entourés.
Page 9.
Mélanges

Sélectionner les deux affirmations exactes :
1- Solution de 2 acides forts, pH = - log (2 fois [Oxonium] apportés par l’un des acides)
2- Mélange d’un acide fort et d’un acide faible (différence des pka >2), l’acide fort impose son pH (Si la concentration en acide fort n’est pas trop faible)
3- [A]. Les 2 acides sont des acides forts : il n’est pas possible de considérer qu’il y a réaction prépondérante de l’acide chlorhydrique
4- Mélange d’acides faibles de pKa proches : les concentrations relatives des acides ne jouent pas
5- HCO3 est un ampholyte. Dans l’eau son pH = 1/2 (pka couple acide/base conjuguée) + ½ (pka couple base/acide conjugué)
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
Il faut tenir compte des concentrations de chaque acide et des volumes initiaux de solutions mélangés.
Calcul des concentrations d’ions oxonium apportés par chaque acide :
pH = - log ([Oxonium dus à acide1] + [Oxonium dus à acide2])
Procédure à suivre:
1- Nombre de moles contenues dans chaque solution initiale
n1=C1.V1, n2=C2.V2
2- Somme des moles = total des [H3O+] = n1+N2
3- Volume total. V = V1+V2
4- Calculer la concentration obtenue en ions H3O+ : n1+n2 / V1+V2
5- pH = - log [Concentration H3O+ obtenue]
Note :
Si le pH trouvé est < 6,5 les oxoniums d’autoprotolyse de l’eau sont effectivement négligeables.
Affirmation 3
Si.
Mais même si on peut négliger l’apport en H3O+ par l’acide faible (qui ne se dissocie pas), il faut ramener le nombre de moles H3O+ de l’acide fort au nouveau volume du mélange.
1- Nombre de moles n1 de l’acide fort,
2- Nouveau volume V=V1+V2
3- Concentration C= n1/V
4- pH= - log [C]
Affirmation 4
Si.
Acides faibles de pka voisins :
pH=-1/2 log (Ka1.C1+Ka2.C2)
Acides faibles de pKa distincts : faire les calculs pour trouver les concentrations en H3O+.
Affirmation 5
Oui.
HCO3 est un ampholyte.
- Acide : HCO3- => CO32- + H+ pka=10,3
- Base : HCO3- + H+ => H2O +CO2 pka = 6,4
PH = ½ (10,3 + 6,4) = 8,35