Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Acides & Bases.
Définitions
Sélectionner
les deux affirmations exactes :
1- Un acide
est une espèce chimique capable de capter un proton H+
2-
L’anion nitrate, NO3 est un acide (définition de Bronsted)
3- Une molécule
avec des atomes d’hydrogène peut être un acide ou une base (Cela dépend de
sa constante d’acidité Ka ; de son pka)
4- KOH
est une base : KOH + H = KOH2
5- Polybase :
capable de capter successivement plusieurs ions H+. Polyacide : capable de
se dissocier en libérant plusieurs ions H+
6- Seuls
les acides forts ont des base conjuguées
7- La
formation d’un couple acide base, par mise en solution aqueuse d’un acide ou
d’une base, n’est pas une réaction acido-basique
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
Un acide (définition de Bronsted) est une espèce
capable de céder au moins un proton H+.
La molécule formée par libération de proton(s) est une base
Une base est une espèce capable de capter au moins un proton H+.
La molécule formée par capture de proton(s) est un acide conjugué.
Affirmation
2
Non.
L’anion
nitrate, NO3- est une base.
NO3-
n’a pas de proton Hydrogène, il ne peut pas être un acide !
Un anion,
charge électrique négative, n’a pas une surcharge positive (par excès d’un proton
hydrogène), et donc : un anion ne peut pas céder un proton H+,
qu’il n’a pas, et être un acide.
Affirmation
3
Oui.
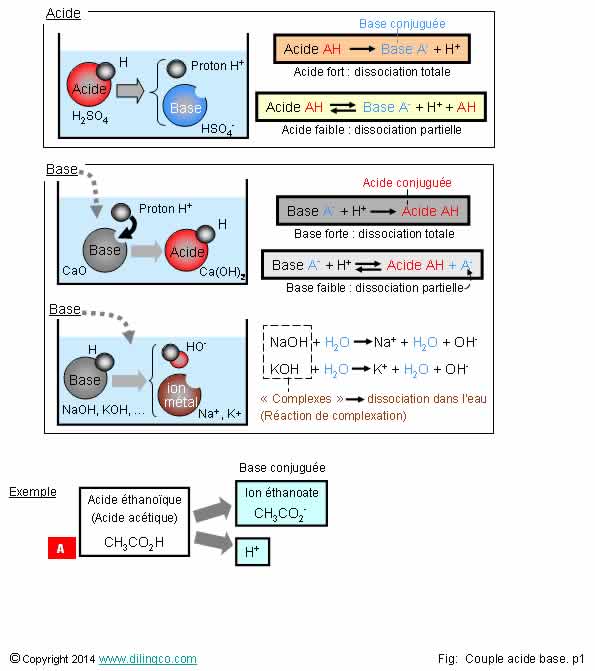
[A].
Molécule avec des atomes d’hydrogène peut être un acide ou une base.
Exemple [A] : CH3CO2H et CH3CO2-
Le
classement en acide ou base dépend de la constante d’acidité Ka de ces molécules.
Ka, pka : voir pages suivantes.
Affirmation
4
Non.
KOH est
une base et aussi un « complexe » formé de 2 partie K et OH.
Mis en
solution aqueuse, KOH se dissocie, par une réaction de « complexation »,
en ion métallique K+ et ion hydroxyle OH-.
Par ses HO- qu’elle libère en solution aqueuse, la potasse est une
base.
L’eau ne
participe pas à l’équilibre de la réaction.
Même
principe pour la soude.
KOH,
Hydroxyde de potassium, et NaOH, Hydoxyde
de sodium (soude, soude caustique) sont 2 exemples
de bases fortes : se dissocient entièrement dans l’eau.
Affirmation5
Oui.
Polybase :
capte 2 (dibase), 3 (tribase), ions H+
Polyacide :
libère 2 (diacide), 3 (triacide), ions H+
Affirmation
6
Non.
A tout acide est associé une base, base dite
« conjuguée ».
Les HA et
A- reliés forme un « couple acide-base ».
A la différence d’un acide faible, un acide fort se dissocie
entièrement en solution aqueuse.
Affirmation 7
Si.
La
formation d’un couple acide base, par mise en solution aqueuse d’un acide ou
d’une base, est une réaction acido-basique
Par
soucis de progression ordonnée, le thème « Acide base » a été divisé
en chapitres :
- Couple
acide-base (ce chapitre),
- Calcul
du pH d’une solution,
-
réaction acido-basique (L’eau joue le rôle du deuxième élément chimique de la
réaction acido-basique),
- pH-métrie.
Acide : donneur de protons H+.
Base : accepteur de protons H+.
Exemple
d’acidité : chaîne de transport mitochondrie
L’acide
(souvent noté «AH»), est un élément
chimique qui se dissocie en solution aqueuse pour donner
une base (A-) et un proton H+
(Le
proton H+ ne n’existe pas en solution, il se solvate en ion oxonium
H3O+).
Définition
de Bronsted
Un acide est toute espèce qui peut libérer un ou plusieurs protons H.
Un acide
«AH» versé dans l’eau :
AH + H2O
<-> A- + H3O+
La base
découlant de la dissociation de l’acide, notée A-
dans cette équation générique, est chargée négativement.
H3O+
: un ion oxonium.
Note :
- La base
conjuguée découle de la dissociation de l’acide et lui est propre :
Chaque acide a une base conjuguée (et chaque base a un acide conjugué).
Acide.
Définition de Lewis
La
définition de Lewis est plus large que la définition de Bronsted.
Un acide
de Lewis est un accepteur de doublet.
Un des
atomes possède une lacune électronique (une de ses orbitales est vide).
Un acide de Lewis est un électrophile
(a = acide = aime/attire
les électrons).
Base.
Définition de Lewis
Une base de Lewis est un donneur de doublets
(Ayant au
moins un doublet libre).
Exemple :
Un
donneur d’ion O2- (riche en électrons) est une base.
Page 2.
Ka. pKa
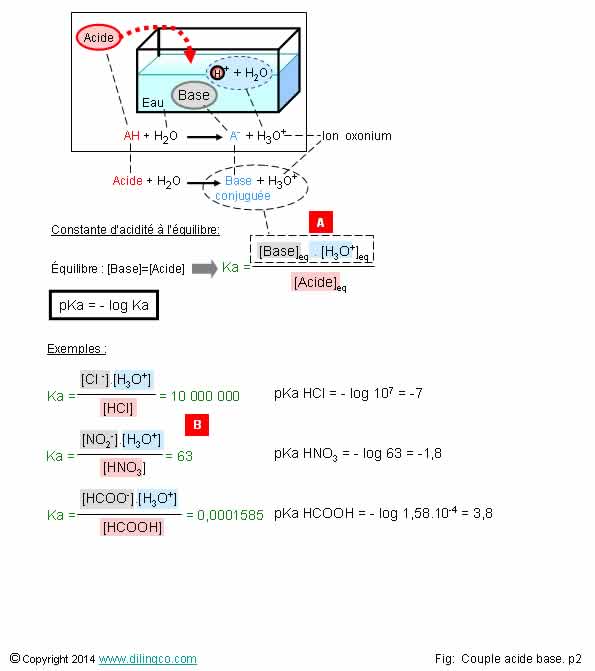
Sélectionner
les deux affirmations exactes :
1- Ka,
constante d’acidité, n’a rien à voir avec les notions de constante d’équilibre,
d’avancement d’une réaction chimique
2- LA
constante d’acidité Ka d’un couple acide-base = constante d’équilibre de la réaction
de l’acide avec l’eau
3- [A].
Plus Ka est fort, moins l’élément chimique se dissocie dans l’eau
4- pKa et
Ka : unité : mol/L
5- Plus
la constance d’acidité est forte, plus le pka est faible
6-
Connaissant le pka (exemple pka=3,8), on ne peut pas retrouver le Ka
Les
affirmations 2 et 5 sont exactes.
Affirmation
1
Si.
La
constante d’acidité Ka est la constante d’équilibre d’une réaction
particulière, la réaction d’un acide avec l’eau.
Acide :
réagit avec l’eau pour donner des protons H+, protons H+
qui s’hydrolysent en H3O+, oxoniums
Affirmation
3
Non.
[A]. Plus
Ka est fort, plus l’élément chimique s’est dissocié dans l’eau pour donner une
base conjuguée et des ion oxonium, H3O+
Ka caractérise le pouvoir d’acidité, l’aptitude à libérer des
protons H+, protons
H+ qui se combinent à l’eau pour former des ions oxonium H3O+.
Affirmation
4
Non.
pKa et Ka sont des rapports de grandeurs de mêmes dimensions = nombres sans unité.
Affirmation
5
Oui.
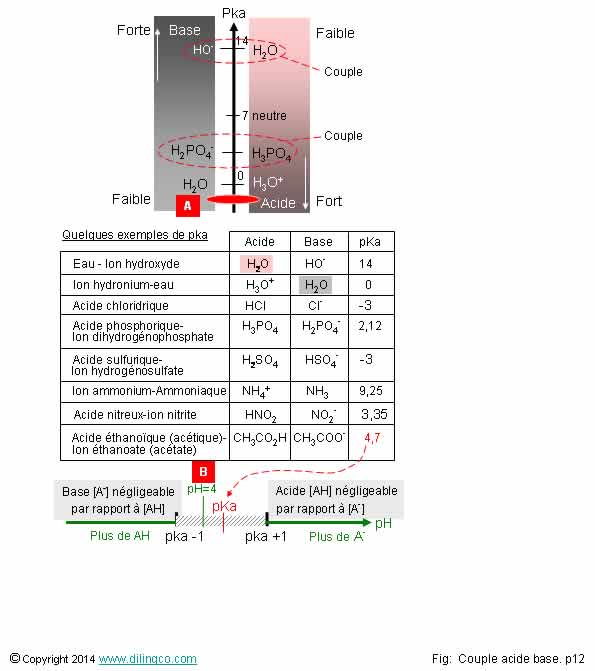
Plus la constance d’acidité est forte, plus le pka est faible.
Voir
figure [B].
L’utilisation
des logarithmes décimaux évite des nombres à rallonges.
(pka de
3,8 est plus parlant, et plus facile à comparer avec d’autres pka, que 6309)
L’acide
chlorhydrique, HCl, se dissocient plus, et est plus fort, que l’acide nitrique
HNO3.
Les
acides de pKa < -2 sont dits « acides
forts » et se dissocient presque entièrement dans l’eau.
L’acide
méthanoïque HCOOH est un acide (pKa < 7) faible.
Affirmation
6
Si
Connaissant
le pka (exemple pka=3,8), on peut retrouver le Ka :
-
log (Ka) = pka
ka
= 10^-pka
Exemple :
ka= 10^-3,8 = 1,585 . 10-4
Page 3.
Table de pKa
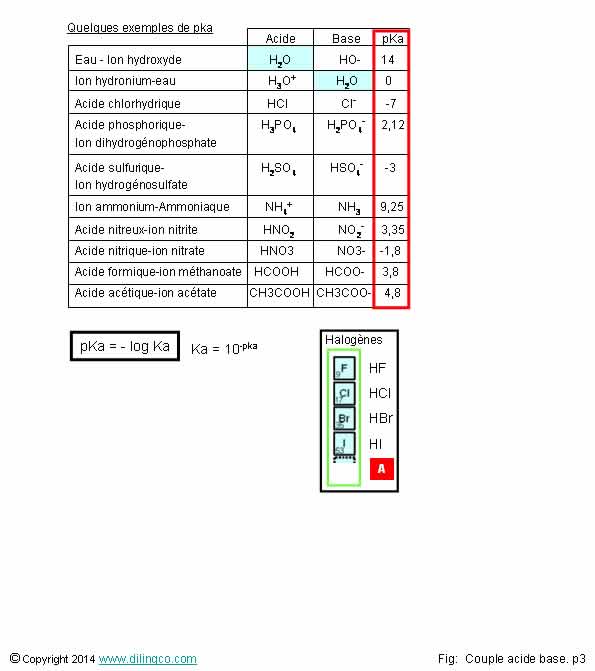
Sélectionner
l’affirmation exacte :
1- Les
halogénures d’hydrogène sont des bases fortes
2- Ka=10^-9,25
= [Ammonium].[Oxonium] / [Ammoniaque]
3-
L’acide formique pka=3,8 est plus fort que l’acide acétique pka=4,8
4- La
base conjuguée de l’acide formique (l’ion méthanoate) est plus forte que la
base conjuguée (ion acétate) de l’acide acétique
L’affirmation
3 est exacte.
On trouve ne nombreuses tables de pKa sur internet.
Affirmation
1
Non.
[A]. Les halogénures
d’hydrogène solvatés en un anion d’halogène F, Cl, Br, … et un proton H+, sont des acides hologénohydriques.
Les
acides hologénohydriques HF, HCl, HBr, … sont des acides
forts.
Affirmation
2
Non.
Une
constante d’acidité s’exprime :
[Concentration des produits]/[Concentration de l’acide].
Ka=10^-9,25
= [Ammoniaque].[Oxonium] / [Ammonium]
Affirmation
3
Oui.
L’acide
formique (acide méthanoïque) pka=3,8 est plus fort que l’acide acétique pka=4,8.
Plus le pKa est faible, plus l’acide est fort ; plus il se dissocie dans
l’eau.
L’acide
formique et l’acide acétique sont des acides faibles.
(Acides forts pka < -2)
L’acide
acétique est présent dans le vinaigre. C’est un antiseptique.
Affirmation
4
Non.
- Acide
formique HCOOH et ion méthanoate HCOO- :
pka=3,8
- Acide
acétique CH3COOH et ion acétate CH3COO- :
pka=4,8
Pour les bases, plus le pKa est fort, plus la base est forte.
L’ion
acétate CH3COO- est donc une base plus forte que l’ion méthanoate
HCOO-
Exemples
d’acides et de bases
Acides
forts
Acide
chlorhydrique. HCl
Acide
sulfurique. H2SO4
Acide
nitrique. HNO3
Acide
iodhydrique. HI
Acide
bromhydrique. HBr
Acide
perchlorique. HClO4
Ne pas
confondre :
Acide
nitrique (HNO3) pKa : -1
Acide
nitreux (HNO2) pKa : 3,35
Acides
faibles
Acide
méthanoïque
Acide
éthanoïque CH3COOH (acide acétique)
Acide
fluorhydrique HF
Acide
cyanhydrique HCN (acide prussique)
Acide
borique H3BO3 Antiseptique (lavage oculaire pour
l’irritation), absorbeur de neutrons dans les centrales nucléaires.
Bases
fortes
Ion amidure
NH2-
Ion éthanolate
CH3CH2O-RO- avec R=groupe alkyle
Ion oxyde
O2-
Base
faibles
Pyridine
C5H5N
Phénolate
C6H5O
Page 4.
Acide & Base en
solution aqueuse
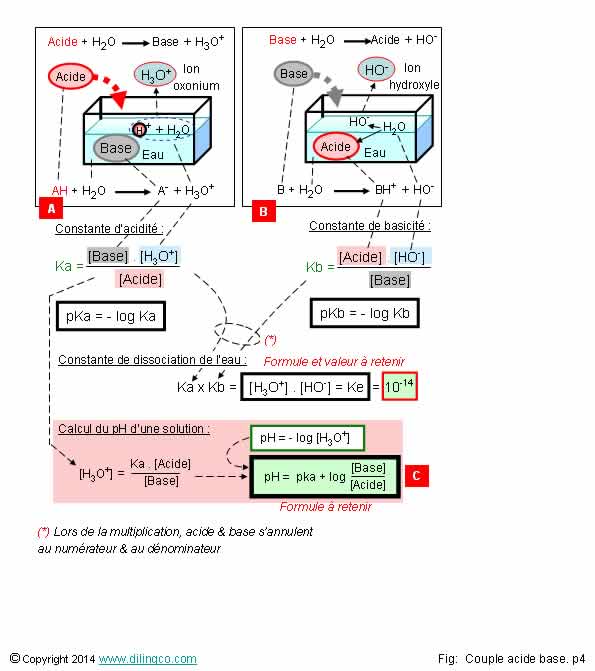
Sélectionner
les deux affirmations exactes :
1- H2O
apparaît dans la formule de la constante d’acidité Ka ou de la constante de
basicité kb
2- Les
réactions [A] et [B] ne sont pas des réactions acide-base (L’eau ne peut pas
être à la fois une base [A] et un acide [B])
3- Le pH
d’une solution n’est pas lié à la concentration des ions oxonium de la solution
4- [C].
pH = pKa si les concentrations [Acide]=[Base]
5- Le pH
d’une solution est égale au pKa du couple acide base + logarithme décimal du
rapport des concentrations base acide
6- Pas de
lien entre la constante d’acidité Ka et la constante d’équilibre d’une réaction
Les
affirmations 4 et 5 sont exactes.
Affirmation
1
Non.
L’eau est le solvant, elle n’apparaît pas ni dans la formule de la constante
d’acidité Ka, ni dans la formule de la constante de basicité Kb.
Affirmation
2
Si.
[A].
L’eau se comporte comme une base.
L’eau
capte un proton H de l’acide AH et forme un ion oxonium.
L’acide
AH dissocié donne une base conjuguée A-.
[B].
L’eau se comporte comme un acide.
L’eau libère un proton H capté par la base B qui donne un acide conjugué BH.
La
molécule H2O, avec sont proton en moins devient un ion hydroxyde HO-
Affirmation
3
Si.
Le pH
caractérise le fait qu’il y a plus ou moins d’ions
[H3O+] solvatés dans la solution.
Affirmation
4
Oui.
Log 1 = 0.
pH = pKa
+0
Affirmation 5
Oui.
pH d’une solution = pKa du couple acide base + logarithme décimal
du rapport des concentrations base acide.
pH = pka + log ([Base]/[Acide])
Affirmation
6
Si.
Ka, constante d’acidité, est le nom donné à la constante
d’équilibre K dans le cas d’une réaction de dissociation acide base.
Conformément
à la loi d’action des masses, Ka exprime le rapport produits/réactifs d’une dissociation
à l’équilibre d’un acide AH avec une base H2O.
L’eau,
solvant, n’apparaît pas dans la formule.
Voir aussi
Activités des espèces chimiques.
Page 5.
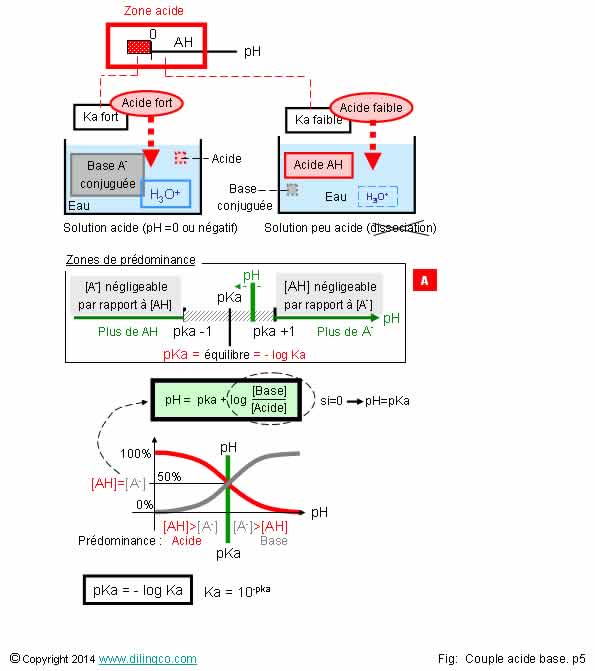
Forts & faibles
Sélectionner
les deux affirmations exactes :
1- Un
acide fort (Exemple HCl), ou une base forte, ne se dissocient pas dans une
solution aqueuse
2- Plus
un acide est fort, plus sa constante d’acidité Ka est élevée et plus son pka
est faible
3- pH et pKa
sont toujours égaux
4- si pH <
pka, la concentration d’acide prédomine sur la concentration de la base
5- On
verse de l’acide phosphorique dans de l’eau. Le pH mesuré = 2. L’acide est
prédominant dans la solution
6- Le pKa
d’un élément chimique dépend de sa concentration dans la solution
Les
affirmations 2 et 4 sont exactes.
Affirmation
1
Si.
Acide
fort
Un acide fort réagit entièrement avec l’eau pour se dissocier entièrement en proton
H+ et en base conjuguée inactive.
La base conjuguée d’un acide est dite inactive.
Le proton
libéré se lie avec une molécule d’eau pour former un cation oxonium H3O+.
Acide fort :
- pKa < -2
- dissociation complète
- solution, suivant la concentration, fortement acide.
HCl, acide fort, ne peut pas exister sous forme moléculaire dans
l’eau.
Acide
faible
Un acide faible se dissocie faiblement, libère peu de protons.
La
dissociation est réversible et limitée à un équilibre entre les diverses
concentrations de la formule :
AH + H2O
<=> A- + H3O+
Acide faible = solution faiblement acide.
(Dissociation partielle)
Acide faible = base conjuguée faible.
Base forte
Une base forte se dissocie totalement dans l’eau.
B+H2O = BH+ + OH-
Base
forte/faible = même principe qu’acide fort/faible.
Une mole de base entraîne en solution la formation d’une mole d’ion hydroxyde HO-(définition d’Arrhenus).
Affirmation
2
Oui.
Plus un acide est fort, plus sa constante d’acidité Ka est élevée (et son pKa
faible).
Le
dénominateur de la formule ka= ([Base conjuguée].[Oxonium]) / [Acide] est
supérieur au dénominateur = l’acide s’est entièrement dissocié = acide fort
Affirmation
2
Non.
pH = pka + log ([Base]/[Acide])
Lorsque
les concentration de base et d’acide sont égales (log
([Base]/[Acide]) = log 1 = 0), le pH = pka.
Affirmation
4
Non.
Le pH
d’une solution n’est pas forcément égal au pKa du couple Acide/base concerné.
Ka :
Constante
d’acidité d’un couple acide-base à l’équilibre = [Base conjuguée].[ions
oxonium] / [Acide]
pH d’une solution :
Caractérise
l’acidité, ou la basicité, d’une solution
aqueuse. Dépend des composants et des concentrations d’acides ou de bases
versées dans la solution.
Exemple :
verser très peu d’acide chlorhydrique dans une
solution basique donnera un pH de solution non égal à la constante d’acidité Ka
de l’acide chlorhydrique.
KaHCl : constante d’acidité (d’équilibre)
HCl = [Cl-].[H3O+] / [HCl]
pKa = -
log Ka
pH : voir explications et calculs pages suivantes.
Affirmation
6
No.
Le pKa caractérise la dissociation d’un élément chimique avec
la base H2O.
Les pka ont des valeurs différentes suivant les éléments chimiques.
Les tables de pKA, nombreuses sur Internet, sont données à 25°C.
Exemples :
L’acide
chlorhydrique est un acide fort, pKa=-7
L’acide
éthanoïque CH3CO2H est un acide faible, pKa = 4, 7.
Ka= 1,78
10-5
(13
molécules sur mille environ se dissocient en base et en ions oxonium H3O+)
Acides forts : HCl, HBr, HI, H2SO4, HClO4,
HNO3
Bases fortes : hydroxydes alcalins (NaOH,
KOH,…).
Acides faibles : acides organiques
(Voir en fin de chapitre)
Page 6.
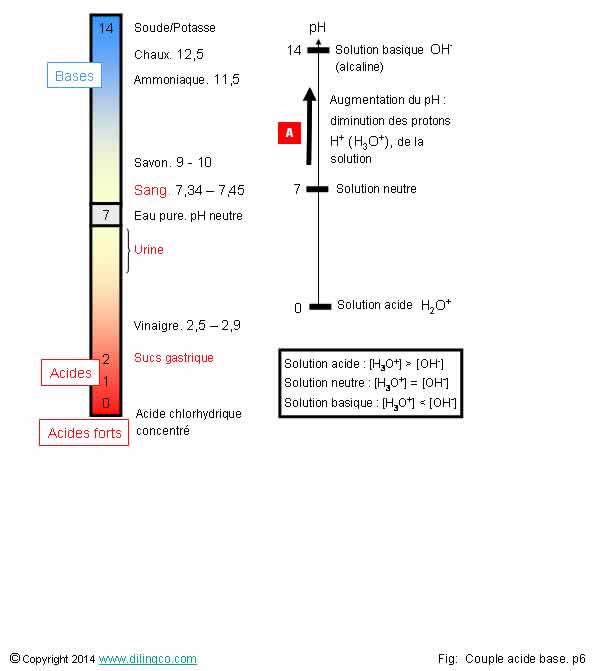
Echelle des pH. Potentiel
Hydrogène
Sélectionner
l’affirmation exacte :
1- [A].
Augmentation du pH = diminution des concentrations des ions oxonium dans la
solution
2- Une
augmentation d’une unité de pH se traduit par une multiplication par 100 de la
basicité d’une solution
3-
L’acide chlorhydrique a un pH inférieur et proche de 7
4- Plus
le pH est fort, plus la solution est acide
L’affirmation
1 est exacte.
Affirmation
1
Oui.
[A].
Augmentation du pH = la solution devient plus basique = diminution des
concentrations des ions oxonium H3O+ dans la solution.
Affirmation
2
Non.
pH est un
facteur logarithmique.
Solution 10 fois plus basique -> pH augmente d’une unité.
Solution 100 fois plus basique -> pH augmente de 2 unités.
Solution 1000 fois plus basique -> pH augmente de 3 unités.
Affirmation
3
Non.
L’acide
chlorhydrique est un acide fort, pKa = -3 (Voir table page précédente).
Même
dilué, le pH d’une solution d’acide chlorhydrique est loin d’être neutre,
proche de pH=7 !
Affirmation
4
Non.
Plus le pH est fort, plus la solution est basique.
Le pH d’une solution aqueuse est donc par définition l’opposé du
logarithme décimal de la concentration des ions hydronium :
pH = - Log [H3O+]
Le pH, concentration des ions hydronium, s’exprime en puissance 10 :
[H3O+] = 10-pH
Le pH est pris en valeur inverse de la constante d’acidité Ka.
Les valeurs de pH sont des chiffres positifs, 0 à 14, pour les
ions dans une solution aqueuse.
Le pH d’une solution aqueuse est donc par définition l’opposé du
logarithme décimal de la concentration des ions oxonium :
pH = - Log [H3O+]
(Approximation :
activité = concentration)
Valeurs
de pH
-
Solutions acides : pH tend vers 0
-
Solutions basiques : pH tend vers 14
Concentration
d’ions oxonium dans un milieu neutre (pH=7) :
[H3O+]
= 10-7 mol.L-1
Dans un
milieu acide (exemple pH=3) :
[H3O+]
= 10-3 mol.L-1
Le pH est logarithmique.
Page 7.
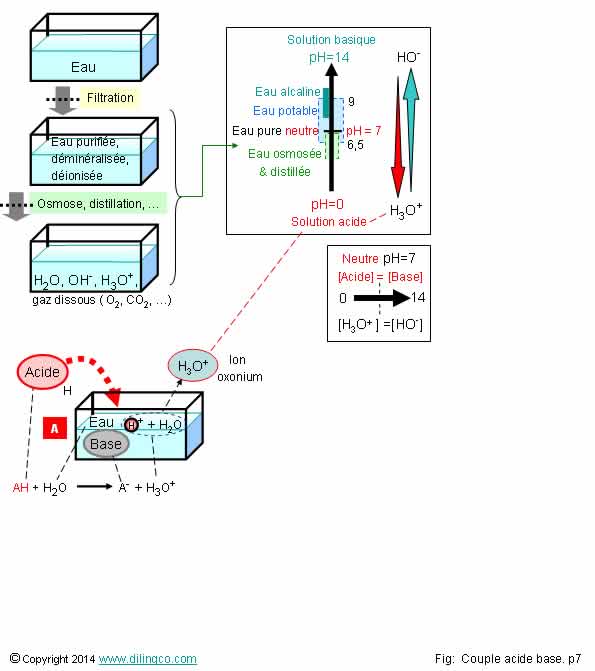
Eau. Acide. Base. pH
Sélectionner
les deux affirmations exactes :
1- pH=7 :
7 fois plus d’ions hydroxydes que d’ions oxonium
2- pH=7,
potentiel hydrogène de l’eau pure à 25°C = référence d’un milieu neutre
3- [A].
Verser un acide dans de l’eau : l’eau devient basique
4- Un
milieu acide a une forte concentration d’ions hydroxyde et un pH fort
5- pH
d’une solution = pKa : lorsque la concentration d’acide versée dans la
solution devient égale à la concentration d’équilibre de la réaction acide avec
H2O
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Non.
pH=7 :
autant d’ions hydroxydes HO-
que d’ions oxonium H3O+.
Le pKa de l’eau, élément acide = 14
Le pKa de l’eau, élément basique = 0
(Voir figure, table des pKa)
Voir aussi
Autoprotolyse de l’eau
Note :
pH est un
facteur logarithmique décimal.
Solution 10 fois plus acide -> pH diminue d’une unité.
Solution 100 fois plus acide -> pH diminue de 2 unités.
Solution 1000 fois plus acide -> pH diminue de 3 unités.
Log 0,1 =
-1
Log 1=0
Log 10 =
1
Log 100 =
2
Log 1000
= 3
Affirmation
2
Oui.
pH=7 :
eau pure référence d’un milieu neutre, ni « acide » ni
« basique ».
Affirmation
3
Non.
[A].
Verser un acide dans de l’eau : l’eau devient
acide.
Ce n’est
pas la présence d’ions basiques qui définit l’acidité ou la basicité d’une
solution mais la proportion d’ions hydroxydes / oxonium.
Affirmation
4
Non.
Le pH est
lié à la concentration d’ions oxonium :
[H3O+]
= 10 –pH
(ou pH = - log [H3O+])
pH faible = forte concentration H3O+ =
solution acide.
Produit ionique de l’eau
(Constante d’équilibre, Ke)
L’eau se dissocie en ions selon l’équation :
2 H2O = H3O+ aq + HO-
aq
Le
produit ionique de l’eau s’écrit Ke = [OH-][H+] = 10-14
à 25°C.
L’eau pure, à l’équilibre, est une solution neutre qui contient
des ions oxonium H3O+ et des ions hydroxyde HO- en quantités égales.
[H3O+]eq = [HO-
]eq
À 25°C, l’eau pure contient 1x10-7 mol.L-1
de H3O+
Le pH, logarithme de cette valeur, est de 7.
Le produit ionique des concentrations en ions oxonium et
hydroxyde est la constante d’équilibre Ke. (K eau)
Ke = [H3O+]eq [HO- ]eq
Valeur de la constante d’équilibre :
Ke = [H3O+]eq [HO- ]eq = (1x10-7)
(1x10-7) = (1x10-14)
pKe = -Log (Ke) = 14
[H3O+]eq = [HO-
]eq , pH = ½ pKe = 7
L’eau pure a un pH = 7 à 25° c
Page 8.
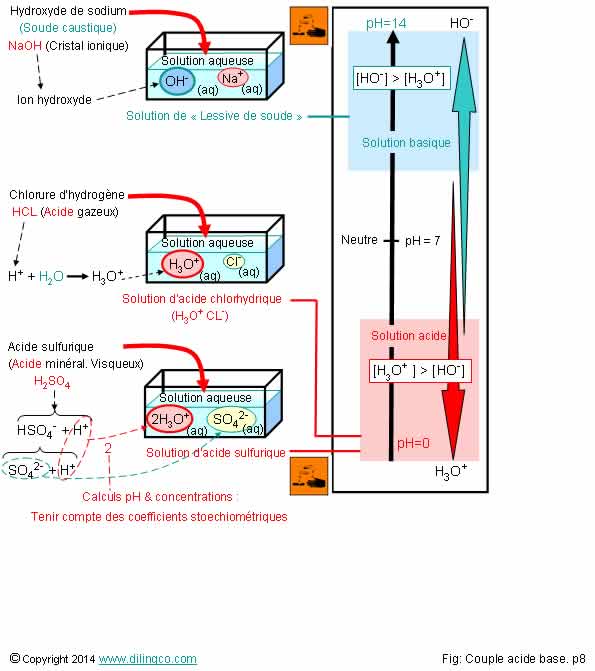
Solution acide & solution
basique
Sélectionner
l’affirmation exacte :
1-
L’acide sulfurique est un électrolyte faible (électrolyte, synonyme :
hydrolyse)
2- Plus
d’ions oxonium que d’ions hydroxyde = solution basique
3-
L’ajout d’un proton H+ à une molécule d’eau (protonation) peut résulter d’un
acide ou de l’autoprotolyse de l’eau
4-
L’hydroxyde sodium, la soude ou la lessive de soude, ne sont pas corrosifs
(Seuls les acides sont corrosifs ?)
L’affirmation
3 est exacte.
Affirmation
1
Non.
L’acide
sulfurique (vitriol) est un électrolyte
fort : mis en solution aqueuse, il se dissocie totalement
cation H3O+ hydraté et en anion sulfate SO42-
hydraté.
Electrolyte : substance conductrice ; présence d’ions.
Hydrolyse : coupure d’une molécule sous l’action de l’eau.
Voir Hydratation.
Hydrolyse
Affirmation
2
Non.
Plus d’ions oxonium H3O+ que d’ions hydroxyde HO-= solution acide.
Ion
oxonium = possibilité de libérer des protons H+.
Affirmation
3
Oui.
Ajout d’un proton H : Protonation.
Dans le
cas présenté, la protonation, est due à un acide.
Molécule
d’eau protonée (ajout H+) = Ion oxonium.
Acide : Fournisseur de protons H+.
Affirmation
4
Non.
Attention : Il n’y a pas que les acides qui peuvent être
corrosifs !
Mettre des protections, gants de protection chimique, lunettes, …
lorsqu’on manipule de la soude ou de la lessive de soude.
Définition
de Bronsted
Un acide est toute espèce qui peut libérer un ou plusieurs protons H.
Un acide
«AH» versé dans l’eau :
AH + H2O
<-> A- + H3O+
La base
découlant de la dissociation de l’acide, notée A-
dans cette équation générique, est chargée négativement.
H3O+
: un ion oxonium.
Note :
- La base
découle de la dissociation de l’acide et lui est propre :
Chaque acide a une base associée (et chaque base à un acide
associé).
Acide.
Définition de Lewis
La
définition de Lewis est plus large que la définition de Bronsted.
Un acide
de Lewis est un accepteur de doublet.
Un des
atomes possède une lacune électronique (une de ses orbitales est vide).
Un acide de Lewis est un électrophile
(a = acide = aime/attire
les électrons).
Base.
Définition de Lewis
Une base de Lewis est un donneur de doublets
(Ayant au
moins un doublet libre).
Exemple :
Un
donneur d’ion O2- (riche en électrons) est une base.
Page 9.
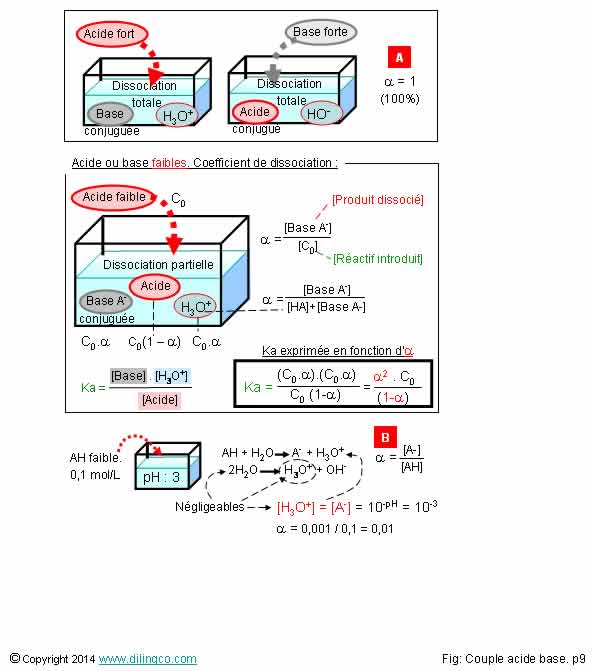
Coefficient de dissociation
alpha
Sélectionner
l’affirmation exacte :
1- [A]. Coefficient
de dissociation d’une base forte ou d’un acide fort : 0
2- Acide
faible : plus la concentration initiale d’acide est faible, plus l’acide
se dissocie
3- Le
degré de dissociation ne dépend pas de l’avancement de la réaction
4- Si
autoprotolyse de l’eau négligeable, on ne peut pas calculer le coefficient de
dissociation à partir de la concentration initiale et du pH (pH=-log [Oxonium])
L’affirmation
2 est exacte.
Coefficient de dissociation a = Moles dissociées / moles initiales introduites
Valeur
entre 0, pas de dissociation, et 1, dissociation totale (100%)
Affirmation
1
Non.
Les bases
et acides forts se dissocient entièrement en solution aqueuse :
a = 1.
Coefficient
(ou degrés) de dissociation d’une base forte ou d’un acide fort : 1
Affirmation
2
Oui.
Pour un acide faible, plus la concentration initiale d’acide est
faible, plus l’acide se dissocie.
Le
principe de Le Châtelier l’explique : concentration faible -> l’équilibre
se déplace vers une augmentation des produits, une augmentation de la
dissociation.
La
résolution de la relation Ka fonction du coefficient de dissociation le
montrerait aussi.
Affirmation
3
Si.
Le degré
de dissociation dépend de l’avancement de la réaction.
a est nul lorsque l’élément est
introduit pour atteindre sa valeur optimale lorsque la réaction est à
l’équilibre.
Avancement
d’une réaction
Affirmation
4
Si.
[B]. Si
l’autoprotolyse de l’eau est négligeable, on néglige les H3O+
apportés par l’autoprotolyse et on peut dire que la concentration de la base
conjuguée [A-] = [H3O+]
pH
= - log [H3O+] = - log [A-]
[A-]=
10^-pH
pH = 3
[A-]=10-3
a = [A-]/[AH] =
0,001/0,1 = 0,01
Degré
de dissociation
a = 10-4
(Très
faible dissociation)
AH
initial = 10 000 moles.
a= molécules dissociées / molécules
initiales = A- / 10-4 = 10-4
Après
dissociation on a :
1
molécule A-
9999
molécules AH
Page 10.
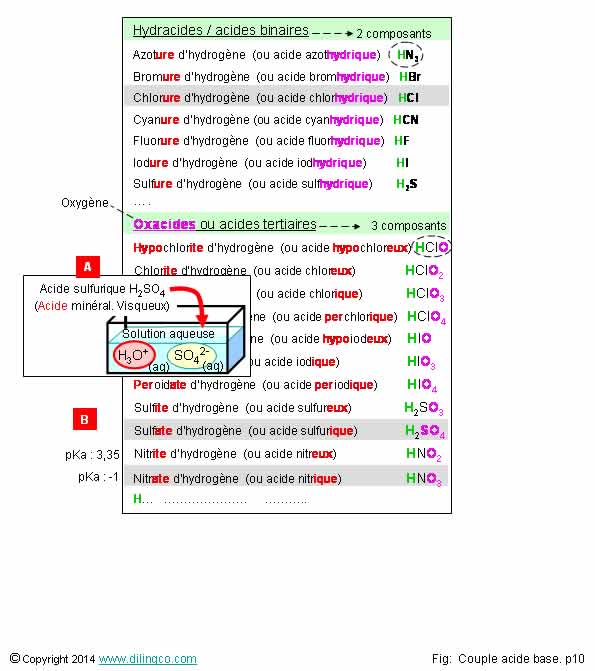
Acides minéraux
Sélectionner
les deux affirmations exactes :
1- Acide
nitreux et acide nitrique = même acide
2- Tous
les acides minéraux ont au moins un atome d’oxygène
3- [A].
Acide sulfurique
4- Les
acides minéraux sont généralement des acides faibles
5- [B].
Acide nitrique et acide nitreux : pKa différents, noms différents, et acides
différents
Les
affirmations 3 et 5 sont exactes.
Affirmation
1
Non.
Acide
nitreux (ou nitrite
d’hydrogène) HNO2
Acide
nitrique (ou nitrate
d’hydrogène) HNO3
Pour les oxacides, acides avec atome(s) d’oxygène, le nom de l’acide reflète le niveau d’oxydation.
2
niveaux d’oxydation possibles :
- 1er
niveau : ‘ite’, (ou acide … eux),
- 2ème
niveau ‘ate’, (ou acide … ique)
4 niveaux
d’oxydation possibles
(voir figure) :
-
1er niveau : Hypo … ‘ite’,
-
2ème niveau … ‘ite’.
- 3ème
niveau … ‘ate’.
- 4ème
niveau Per … ‘ate’.
Affirmation
2
Non.
Les
acides binaires sont composés d’un atome H et d’un atome minéral (pas d’atome
d’oxygène)
Affirmation
3
Oui.
[A].
Acide sulfurique
2
H2O + H2SO4 2 H3O+(aq)
+ SO42-(aq).
Affirmation
4
Non.
Les
acides minéraux peuvent être très forts, avec des pKa < 0
Exemples
d’acides minéraux forts :
Acide chlorydrique pKa :
-3
Acide
sulfurique pKa : -3
Affirmation
5
Oui.
Acide
nitrique (HNO3) pKa : -1
Acide
nitreux (HNO2) pKa : 3,35
Acides
minéraux
Un acide
minéral dérive d’un minéral.
-
Les hydracides ou acides binaires (HnA),
-
Les oxacides ou acides ternaires (HnMOm),
Oxacide : composé oxygène,
Ternaires : trois composés.
Acides
binaires
Première
nomenclature :
- Nom du non-méta_ure_
d’hydrogène
Exemple :
-
Chlorure
d’hydrogène (HCl)
Deuxième
nomenclature
- acide
nom du non-métal _hydrique
Exemple :
Acide
chlorhydrique (HCl)
L’acide chlorhydrique, HCl, en solution aqueuse : H3O++
Cl-(aq)) est couramment utilisé dans l'industrie.
Acides
ternaires
Trois
composants sont toujours présents dans un acide ternaire :
-
L’hydrogène,
-
Un non-métal,
-
L’oxygène. (D’où l’autre nom :
Oxacide)
Première
nomenclature :
- Nom du non-métal_ate
ou ite d’hydrogène
Exemple :
-
Chlorate
d’hydrogène (HClO3)
Deuxième
nomenclature
- acide
nom du non-métal _ ‘ique ou eux’
Exemple :
Acide chlorique (HClO3)
Page 11.
Acides organiques
Sélectionner
l’affirmation exacte :
1- Les
acides organiques, contrairement aux acides minéraux, ne sont pas capables de
libérer un proton H+
2- Les
acides organiques sont très solubles dans l’eau
3- Acides
organiques les plus courants : acides carboxyliques (généralement acides
faibles), et acides sulfoniques (acides relativement forts)
4- Les
acides gras sont solubles dans l’eau
L’affirmation
3 est exacte.
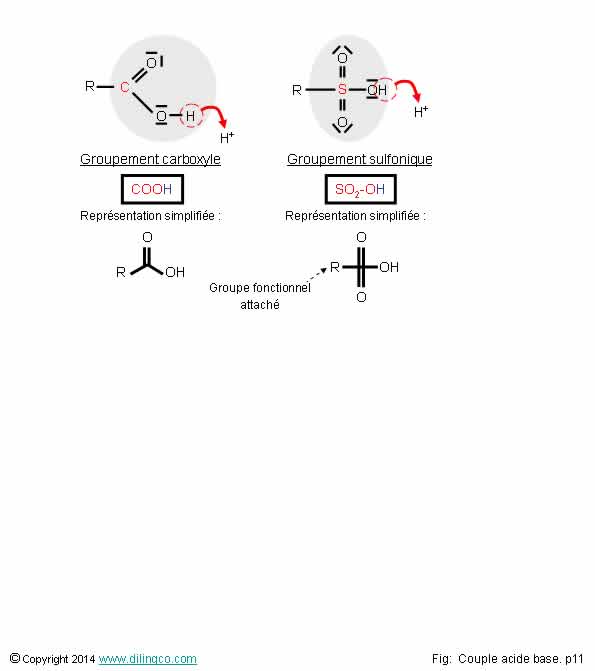
Affirmation
1
Si.
Les
acides organiques, comme les minéraux, libèrent des protons H+.
Le proton H+ provient de groupements fonctionnels
« acides » :
- carboxylique –COOH,
sous-classe : acide benzoïque,
- sulfonique -SO2OH,
-
hydroxyle –OH,
- sulfhydryle
–SH,
- les alcool,
énols, phénols,
- …
Affirmation
2
Non.
Les acides organiques sont très peu solubles dans l’eau
Ils sont
généralement très solubles dans des solvants
organiques.
Affirmation
3
Oui.
Acides
organiques les plus courants : acides carboxyliques (généralement des
acides faibles), et acides sulfoniques (acides relativement forts)
Les
acides organiques sont utilisés comme acidulants, conservateurs, émulsifiants,
antioxydants, …
Acide
citrique (E330), acide lactique
Affirmation
4
Correct.
Un acide
gras, hydrophobe, insoluble dans l’eau,
n’a pas la capacité de créer des liaisons hydrogène avec les molécules d’eau.
Il est
souvent apolaire et n’a pas la possibilité de créer une liaison
dipôle-dipôle.
Généralement soluble dans des solvants organiques
(Acétone,
hydrocarbures légers)
Acides
organiques
Acides
carboxyliques
Les
acides carboxyliques contiennent le groupement fonctionnel
carboxyle (-C(O)OH).
Les acides aminés, briques de base des protéines, sont des acides
carboxyliques.
Les bases
conjuguées des acides carboxyliques sont des « carboxylates ».
Exemples d’acides
carboxyliques
- Acide acétique, CH3COOH,
présente dans le vinaigre, antiseptique et désinfectant.
Acide acétique = acide étanoïque ; base
associée : acétate (ion éthanoate), CH3COO-
L’acide acétique est au centre de nombreuses molécules
complexes de la biologie, de synthèses et dégradations des aliments, etc.
-
Acide acétylsalicylique, HC9H7O4,
dans l’aspirine,
- Acide ascorbique, H2C6H6O6,
vitamine C.
- Acide citrique, H3C6H5O7,
dans les agrumes,
- acide formique, HCO2H.
Acides
sulfoniques
Les
acides sulfoniques contiennent le groupement fonctionnel
sulfonique (-SO2OH).
Exemples :
- Acide méthanesulfonique
CH3SO2OH, réactif
très utilisé en synthèse organique.
- Acide paratoluènesulfonique, appelé l’APTS
Groupes
fonctionnels
- Groupes
d’atomes utilisés en chimie organique,
-
Structure sub-moléculaire, assemblage d’atomes,
- Confère
des réactivités et des propriétés spécifiques
à la molécule qui le contient,
- Notés R, R’, … dans les formules
Voir Groupements
fonctionnels.
Page 12.
Résumé. pka
Sélectionner
les deux affirmations exactes :
1- pKA de
l’acide éthanoïde = 4,7 = acide fort
2- Le pH
d’une solution d’acide éthanoïque est à 4 : l’acide prédomine dans la
solution
3- Le pH
d’un acide fort : pH = pKa + log ([Base] / [Acide]
4- Pas de
relation entre les concentrations [Ion oxonium] et [Ion hydronium]
5- [A].
Une base est d’autant moins puissante que son acide conjugué est puissant
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Non.
Acide
éthanoïque :
- pKa =
4,7 à 25°C (voir table pKa de la figure),
- pKa
< 6,5 : acide, et >0
- acide
faible
Acides
forts : pka négatifs (<-2)
Affirmation
2
Oui.
Voir figure [B]
Affirmation
3
Non.
pH d’un acide fort :
pH= - Log [C]
pH directement lié à la concentration [C] de l’acide.
pH d’un
acide faible :
pH = pKa + log ([Base]/[Acide])
Affirmation
4
Si.
Potentiel
électronique de l’eau Ke = [H3O+].[HO-] = 10-14
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Acides & Bases. Définitions

Sélectionner les deux affirmations exactes :
1- Un acide est une espèce chimique capable de capter un proton H+
2- L’anion nitrate, NO3 est un acide (définition de Bronsted)
3- Une molécule avec des atomes d’hydrogène peut être un acide ou une base (Cela dépend de sa constante d’acidité Ka ; de son pka)
4- KOH est une base : KOH + H = KOH2
5- Polybase : capable de capter successivement plusieurs ions H+. Polyacide : capable de se dissocier en libérant plusieurs ions H+
6- Seuls les acides forts ont des base conjuguées
7- La formation d’un couple acide base, par mise en solution aqueuse d’un acide ou d’une base, n’est pas une réaction acido-basique
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Un acide (définition de Bronsted) est une espèce capable de céder au moins un proton H+.
La molécule formée par libération de proton(s) est une base
Une base est une espèce capable de capter au moins un proton H+.
La molécule formée par capture de proton(s) est un acide conjugué.
Affirmation 2
Non.
L’anion nitrate, NO3- est une base.
NO3- n’a pas de proton Hydrogène, il ne peut pas être un acide !
Un anion, charge électrique négative, n’a pas une surcharge positive (par excès d’un proton hydrogène), et donc : un anion ne peut pas céder un proton H+, qu’il n’a pas, et être un acide.
Affirmation 3
Oui.
[A].
Molécule avec des atomes d’hydrogène peut être un acide ou une base.
Exemple [A] : CH3CO2H et CH3CO2-
Le classement en acide ou base dépend de la constante d’acidité Ka de ces molécules.
Ka, pka : voir pages suivantes.
Affirmation 4
Non.
KOH est une base et aussi un « complexe » formé de 2 partie K et OH.
Mis en
solution aqueuse, KOH se dissocie, par une réaction de « complexation »,
en ion métallique K+ et ion hydroxyle OH-.
Par ses HO- qu’elle libère en solution aqueuse, la potasse est une
base.
L’eau ne participe pas à l’équilibre de la réaction.
Même principe pour la soude.
KOH, Hydroxyde de potassium, et NaOH, Hydoxyde de sodium (soude, soude caustique) sont 2 exemples de bases fortes : se dissocient entièrement dans l’eau.
Affirmation5
Oui.
Polybase : capte 2 (dibase), 3 (tribase), ions H+
Polyacide : libère 2 (diacide), 3 (triacide), ions H+
Affirmation 6
Non.
A tout acide est associé une base, base dite « conjuguée ».
Les HA et A- reliés forme un « couple acide-base ».
A la différence d’un acide faible, un acide fort se dissocie entièrement en solution aqueuse.
Affirmation 7
Si.
La formation d’un couple acide base, par mise en solution aqueuse d’un acide ou d’une base, est une réaction acido-basique
Par soucis de progression ordonnée, le thème « Acide base » a été divisé en chapitres :
- Couple acide-base (ce chapitre),
- Calcul du pH d’une solution,
- réaction acido-basique (L’eau joue le rôle du deuxième élément chimique de la réaction acido-basique),
- pH-métrie.
Acide : donneur de protons H+.
Base : accepteur de protons H+.
Exemple d’acidité : chaîne de transport mitochondrie
L’acide (souvent noté «AH»), est un élément chimique qui se dissocie en solution aqueuse pour donner une base (A-) et un proton H+
(Le proton H+ ne n’existe pas en solution, il se solvate en ion oxonium H3O+).
Définition de Bronsted
Un acide est toute espèce qui peut libérer un ou plusieurs protons H.
Un acide «AH» versé dans l’eau :
AH + H2O <-> A- + H3O+
La base découlant de la dissociation de l’acide, notée A- dans cette équation générique, est chargée négativement.
H3O+ : un ion oxonium.
Note :
- La base conjuguée découle de la dissociation de l’acide et lui est propre :
Chaque acide a une base conjuguée (et chaque base a un acide conjugué).
Acide. Définition de Lewis
La définition de Lewis est plus large que la définition de Bronsted.
Un acide de Lewis est un accepteur de doublet.
Un des atomes possède une lacune électronique (une de ses orbitales est vide).
Un acide de Lewis est un électrophile
(a = acide = aime/attire les électrons).
Base. Définition de Lewis
Une base de Lewis est un donneur de doublets
(Ayant au moins un doublet libre).
Exemple :
Un donneur d’ion O2- (riche en électrons) est une base.
Page 2.
Ka. pKa

Sélectionner les deux affirmations exactes :
1- Ka, constante d’acidité, n’a rien à voir avec les notions de constante d’équilibre, d’avancement d’une réaction chimique
2- LA constante d’acidité Ka d’un couple acide-base = constante d’équilibre de la réaction de l’acide avec l’eau
3- [A]. Plus Ka est fort, moins l’élément chimique se dissocie dans l’eau
4- pKa et Ka : unité : mol/L
5- Plus la constance d’acidité est forte, plus le pka est faible
6- Connaissant le pka (exemple pka=3,8), on ne peut pas retrouver le Ka
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Si.
La constante d’acidité Ka est la constante d’équilibre d’une réaction particulière, la réaction d’un acide avec l’eau.
Acide : réagit avec l’eau pour donner des protons H+, protons H+ qui s’hydrolysent en H3O+, oxoniums
Affirmation 3
Non.
[A]. Plus Ka est fort, plus l’élément chimique s’est dissocié dans l’eau pour donner une base conjuguée et des ion oxonium, H3O+
Ka caractérise le pouvoir d’acidité, l’aptitude à libérer des protons H+, protons H+ qui se combinent à l’eau pour former des ions oxonium H3O+.
Affirmation 4
Non.
pKa et Ka sont des rapports de grandeurs de mêmes dimensions = nombres sans unité.
Affirmation 5
Oui.
Plus la constance d’acidité est forte, plus le pka est faible.
Voir
figure [B].
L’utilisation des logarithmes décimaux évite des nombres à rallonges.
(pka de 3,8 est plus parlant, et plus facile à comparer avec d’autres pka, que 6309)
L’acide chlorhydrique, HCl, se dissocient plus, et est plus fort, que l’acide nitrique HNO3.
Les acides de pKa < -2 sont dits « acides forts » et se dissocient presque entièrement dans l’eau.
L’acide méthanoïque HCOOH est un acide (pKa < 7) faible.
Affirmation 6
Si
Connaissant le pka (exemple pka=3,8), on peut retrouver le Ka :
- log (Ka) = pka
ka = 10^-pka
Exemple : ka= 10^-3,8 = 1,585 . 10-4
Page 3.
Table de pKa

Sélectionner l’affirmation exacte :
1- Les halogénures d’hydrogène sont des bases fortes
2- Ka=10^-9,25 = [Ammonium].[Oxonium] / [Ammoniaque]
3- L’acide formique pka=3,8 est plus fort que l’acide acétique pka=4,8
4- La base conjuguée de l’acide formique (l’ion méthanoate) est plus forte que la base conjuguée (ion acétate) de l’acide acétique
L’affirmation 3 est exacte.
On trouve ne nombreuses tables de pKa sur internet.
Affirmation 1
Non.
[A]. Les halogénures d’hydrogène solvatés en un anion d’halogène F, Cl, Br, … et un proton H+, sont des acides hologénohydriques.
Les acides hologénohydriques HF, HCl, HBr, … sont des acides forts.
Affirmation 2
Non.
Une constante d’acidité s’exprime :
[Concentration des produits]/[Concentration de l’acide].
Ka=10^-9,25 = [Ammoniaque].[Oxonium] / [Ammonium]
Affirmation 3
Oui.
L’acide
formique (acide méthanoïque) pka=3,8 est plus fort que l’acide acétique pka=4,8.
Plus le pKa est faible, plus l’acide est fort ; plus il se dissocie dans
l’eau.
L’acide
formique et l’acide acétique sont des acides faibles.
(Acides forts pka < -2)
L’acide acétique est présent dans le vinaigre. C’est un antiseptique.
Affirmation 4
Non.
- Acide formique HCOOH et ion méthanoate HCOO- : pka=3,8
- Acide acétique CH3COOH et ion acétate CH3COO- : pka=4,8
Pour les bases, plus le pKa est fort, plus la base est forte.
L’ion acétate CH3COO- est donc une base plus forte que l’ion méthanoate HCOO-
Exemples d’acides et de bases
Acides forts
Acide chlorhydrique. HCl
Acide sulfurique. H2SO4
Acide nitrique. HNO3
Acide iodhydrique. HI
Acide bromhydrique. HBr
Acide perchlorique. HClO4
Ne pas confondre :
Acide nitrique (HNO3) pKa : -1
Acide nitreux (HNO2) pKa : 3,35
Acides faibles
Acide méthanoïque
Acide éthanoïque CH3COOH (acide acétique)
Acide fluorhydrique HF
Acide cyanhydrique HCN (acide prussique)
Acide borique H3BO3 Antiseptique (lavage oculaire pour l’irritation), absorbeur de neutrons dans les centrales nucléaires.
Bases fortes
Ion amidure NH2-
Ion éthanolate CH3CH2O-RO- avec R=groupe alkyle
Ion oxyde O2-
Base faibles
Pyridine C5H5N
Phénolate C6H5O
Page 4.
Acide & Base en solution aqueuse

Sélectionner les deux affirmations exactes :
1- H2O apparaît dans la formule de la constante d’acidité Ka ou de la constante de basicité kb
2- Les réactions [A] et [B] ne sont pas des réactions acide-base (L’eau ne peut pas être à la fois une base [A] et un acide [B])
3- Le pH d’une solution n’est pas lié à la concentration des ions oxonium de la solution
4- [C]. pH = pKa si les concentrations [Acide]=[Base]
5- Le pH d’une solution est égale au pKa du couple acide base + logarithme décimal du rapport des concentrations base acide
6- Pas de lien entre la constante d’acidité Ka et la constante d’équilibre d’une réaction
Les affirmations 4 et 5 sont exactes.
Affirmation 1
Non.
L’eau est le solvant, elle n’apparaît pas ni dans la formule de la constante d’acidité Ka, ni dans la formule de la constante de basicité Kb.
Affirmation 2
Si.
[A]. L’eau se comporte comme une base.
L’eau capte un proton H de l’acide AH et forme un ion oxonium.
L’acide AH dissocié donne une base conjuguée A-.
[B].
L’eau se comporte comme un acide.
L’eau libère un proton H capté par la base B qui donne un acide conjugué BH.
La molécule H2O, avec sont proton en moins devient un ion hydroxyde HO-
Affirmation 3
Si.
Le pH caractérise le fait qu’il y a plus ou moins d’ions [H3O+] solvatés dans la solution.
Affirmation 4
Oui.
Log 1 = 0.
pH = pKa +0
Affirmation 5
Oui.
pH d’une solution = pKa du couple acide base + logarithme décimal du rapport des concentrations base acide.
pH = pka + log ([Base]/[Acide])
Affirmation 6
Si.
Ka, constante d’acidité, est le nom donné à la constante
d’équilibre K dans le cas d’une réaction de dissociation acide base.
Conformément
à la loi d’action des masses, Ka exprime le rapport produits/réactifs d’une dissociation
à l’équilibre d’un acide AH avec une base H2O.
L’eau, solvant, n’apparaît pas dans la formule.
Voir aussi Activités des espèces chimiques.
Page 5.
Forts & faibles

Sélectionner les deux affirmations exactes :
1- Un acide fort (Exemple HCl), ou une base forte, ne se dissocient pas dans une solution aqueuse
2- Plus un acide est fort, plus sa constante d’acidité Ka est élevée et plus son pka est faible
3- pH et pKa sont toujours égaux
4- si pH < pka, la concentration d’acide prédomine sur la concentration de la base
5- On verse de l’acide phosphorique dans de l’eau. Le pH mesuré = 2. L’acide est prédominant dans la solution
6- Le pKa d’un élément chimique dépend de sa concentration dans la solution
Les affirmations 2 et 4 sont exactes.
Affirmation 1
Si.
Acide fort
Un acide fort réagit entièrement avec l’eau pour se dissocier entièrement en proton
H+ et en base conjuguée inactive.
La base conjuguée d’un acide est dite inactive.
Le proton libéré se lie avec une molécule d’eau pour former un cation oxonium H3O+.
Acide fort :
- pKa < -2
- dissociation complète
- solution, suivant la concentration, fortement acide.
HCl, acide fort, ne peut pas exister sous forme moléculaire dans l’eau.
Acide faible
Un acide faible se dissocie faiblement, libère peu de protons.
La dissociation est réversible et limitée à un équilibre entre les diverses concentrations de la formule :
AH + H2O <=> A- + H3O+
Acide faible = solution faiblement acide.
(Dissociation partielle)
Acide faible = base conjuguée faible.
Base forte
Une base forte se dissocie totalement dans l’eau.
B+H2O = BH+ + OH-
Base forte/faible = même principe qu’acide fort/faible.
Une mole de base entraîne en solution la formation d’une mole d’ion hydroxyde HO-(définition d’Arrhenus).
Affirmation 2
Oui.
Plus un acide est fort, plus sa constante d’acidité Ka est élevée (et son pKa faible).
Le dénominateur de la formule ka= ([Base conjuguée].[Oxonium]) / [Acide] est supérieur au dénominateur = l’acide s’est entièrement dissocié = acide fort
Affirmation 2
Non.
pH = pka + log ([Base]/[Acide])
Lorsque
les concentration de base et d’acide sont égales (log
([Base]/[Acide]) = log 1 = 0), le pH = pka.
Affirmation 4
Non.
Le pH d’une solution n’est pas forcément égal au pKa du couple Acide/base concerné.
Ka :
Constante d’acidité d’un couple acide-base à l’équilibre = [Base conjuguée].[ions oxonium] / [Acide]
pH d’une solution :
Caractérise l’acidité, ou la basicité, d’une solution aqueuse. Dépend des composants et des concentrations d’acides ou de bases versées dans la solution.
Exemple : verser très peu d’acide chlorhydrique dans une solution basique donnera un pH de solution non égal à la constante d’acidité Ka de l’acide chlorhydrique.
KaHCl : constante d’acidité (d’équilibre) HCl = [Cl-].[H3O+] / [HCl]
pKa = - log Ka
pH : voir explications et calculs pages suivantes.
Affirmation 6
No.
Le pKa caractérise la dissociation d’un élément chimique avec
la base H2O.
Les pka ont des valeurs différentes suivant les éléments chimiques.
Les tables de pKA, nombreuses sur Internet, sont données à 25°C.
Exemples :
L’acide chlorhydrique est un acide fort, pKa=-7
L’acide éthanoïque CH3CO2H est un acide faible, pKa = 4, 7.
Ka= 1,78 10-5
(13 molécules sur mille environ se dissocient en base et en ions oxonium H3O+)
Acides forts : HCl, HBr, HI, H2SO4, HClO4, HNO3
Bases fortes : hydroxydes alcalins (NaOH, KOH,…).
Acides faibles : acides organiques
(Voir en fin de chapitre)
Page 6.
Echelle des pH. Potentiel Hydrogène

Sélectionner l’affirmation exacte :
1- [A]. Augmentation du pH = diminution des concentrations des ions oxonium dans la solution
2- Une augmentation d’une unité de pH se traduit par une multiplication par 100 de la basicité d’une solution
3- L’acide chlorhydrique a un pH inférieur et proche de 7
4- Plus le pH est fort, plus la solution est acide
L’affirmation 1 est exacte.
Affirmation 1
Oui.
[A]. Augmentation du pH = la solution devient plus basique = diminution des concentrations des ions oxonium H3O+ dans la solution.
Affirmation 2
Non.
pH est un facteur logarithmique.
Solution 10 fois plus basique -> pH augmente d’une unité.
Solution 100 fois plus basique -> pH augmente de 2 unités.
Solution 1000 fois plus basique -> pH augmente de 3 unités.
Affirmation 3
Non.
L’acide chlorhydrique est un acide fort, pKa = -3 (Voir table page précédente).
Même dilué, le pH d’une solution d’acide chlorhydrique est loin d’être neutre, proche de pH=7 !
Affirmation 4
Non.
Plus le pH est fort, plus la solution est basique.
Le pH d’une solution aqueuse est donc par définition l’opposé du logarithme décimal de la concentration des ions hydronium :
pH = - Log [H3O+]
Le pH, concentration des ions hydronium, s’exprime en puissance 10 :
[H3O+] = 10-pH
Le pH est pris en valeur inverse de la constante d’acidité Ka.
Les valeurs de pH sont des chiffres positifs, 0 à 14, pour les ions dans une solution aqueuse.
Le pH d’une solution aqueuse est donc par définition l’opposé du logarithme décimal de la concentration des ions oxonium :
pH = - Log [H3O+]
(Approximation : activité = concentration)
Valeurs de pH
- Solutions acides : pH tend vers 0
- Solutions basiques : pH tend vers 14
Concentration d’ions oxonium dans un milieu neutre (pH=7) :
[H3O+] = 10-7 mol.L-1
Dans un milieu acide (exemple pH=3) :
[H3O+]
= 10-3 mol.L-1
Le pH est logarithmique.
Page 7.
Eau. Acide. Base. pH

Sélectionner les deux affirmations exactes :
1- pH=7 : 7 fois plus d’ions hydroxydes que d’ions oxonium
2- pH=7, potentiel hydrogène de l’eau pure à 25°C = référence d’un milieu neutre
3- [A]. Verser un acide dans de l’eau : l’eau devient basique
4- Un milieu acide a une forte concentration d’ions hydroxyde et un pH fort
5- pH d’une solution = pKa : lorsque la concentration d’acide versée dans la solution devient égale à la concentration d’équilibre de la réaction acide avec H2O
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
pH=7 : autant d’ions hydroxydes HO- que d’ions oxonium H3O+.
Le pKa de l’eau, élément acide = 14
Le pKa de l’eau, élément basique = 0
(Voir figure, table des pKa)
Voir aussi Autoprotolyse de l’eau
Note :
pH est un facteur logarithmique décimal.
Solution 10 fois plus acide -> pH diminue d’une unité.
Solution 100 fois plus acide -> pH diminue de 2 unités.
Solution 1000 fois plus acide -> pH diminue de 3 unités.
Log 0,1 = -1
Log 1=0
Log 10 = 1
Log 100 = 2
Log 1000 = 3
Affirmation 2
Oui.
pH=7 : eau pure référence d’un milieu neutre, ni « acide » ni « basique ».
Affirmation 3
Non.
[A]. Verser un acide dans de l’eau : l’eau devient acide.
Ce n’est pas la présence d’ions basiques qui définit l’acidité ou la basicité d’une solution mais la proportion d’ions hydroxydes / oxonium.
Affirmation 4
Non.
Le pH est lié à la concentration d’ions oxonium :
[H3O+] = 10 –pH
(ou pH = - log [H3O+])
pH faible = forte concentration H3O+ = solution acide.
Produit ionique de l’eau
(Constante d’équilibre, Ke)
L’eau se dissocie en ions selon l’équation :
2 H2O = H3O+ aq + HO- aq
Le produit ionique de l’eau s’écrit Ke = [OH-][H+] = 10-14 à 25°C.
L’eau pure, à l’équilibre, est une solution neutre qui contient des ions oxonium H3O+ et des ions hydroxyde HO- en quantités égales.
[H3O+]eq = [HO- ]eq
À 25°C, l’eau pure contient 1x10-7 mol.L-1 de H3O+
Le pH, logarithme de cette valeur, est de 7.
Le produit ionique des concentrations en ions oxonium et
hydroxyde est la constante d’équilibre Ke. (K eau)
Ke = [H3O+]eq [HO- ]eq
Valeur de la constante d’équilibre :
Ke = [H3O+]eq [HO- ]eq = (1x10-7) (1x10-7) = (1x10-14)
pKe = -Log (Ke) = 14
[H3O+]eq = [HO- ]eq , pH = ½ pKe = 7
L’eau pure a un pH = 7 à 25° c
Page 8.
Solution acide & solution basique

Sélectionner l’affirmation exacte :
1- L’acide sulfurique est un électrolyte faible (électrolyte, synonyme : hydrolyse)
2- Plus d’ions oxonium que d’ions hydroxyde = solution basique
3- L’ajout d’un proton H+ à une molécule d’eau (protonation) peut résulter d’un acide ou de l’autoprotolyse de l’eau
4- L’hydroxyde sodium, la soude ou la lessive de soude, ne sont pas corrosifs (Seuls les acides sont corrosifs ?)
L’affirmation 3 est exacte.
Affirmation 1
Non.
L’acide sulfurique (vitriol) est un électrolyte fort : mis en solution aqueuse, il se dissocie totalement cation H3O+ hydraté et en anion sulfate SO42- hydraté.
Electrolyte : substance conductrice ; présence d’ions.
Hydrolyse : coupure d’une molécule sous l’action de l’eau.
Voir Hydratation. Hydrolyse
Affirmation 2
Non.
Plus d’ions oxonium H3O+ que d’ions hydroxyde HO-= solution acide.
Ion oxonium = possibilité de libérer des protons H+.
Affirmation 3
Oui.
Ajout d’un proton H : Protonation.
Dans le cas présenté, la protonation, est due à un acide.
Molécule d’eau protonée (ajout H+) = Ion oxonium.
Acide : Fournisseur de protons H+.
Affirmation 4
Non.
Attention : Il n’y a pas que les acides qui peuvent être corrosifs !
Mettre des protections, gants de protection chimique, lunettes, … lorsqu’on manipule de la soude ou de la lessive de soude.
Définition de Bronsted
Un acide est toute espèce qui peut libérer un ou plusieurs protons H.
Un acide «AH» versé dans l’eau :
AH + H2O <-> A- + H3O+
La base découlant de la dissociation de l’acide, notée A- dans cette équation générique, est chargée négativement.
H3O+ : un ion oxonium.
Note :
- La base découle de la dissociation de l’acide et lui est propre :
Chaque acide a une base associée (et chaque base à un acide associé).
Acide. Définition de Lewis
La définition de Lewis est plus large que la définition de Bronsted.
Un acide de Lewis est un accepteur de doublet.
Un des atomes possède une lacune électronique (une de ses orbitales est vide).
Un acide de Lewis est un électrophile
(a = acide = aime/attire les électrons).
Base. Définition de Lewis
Une base de Lewis est un donneur de doublets
(Ayant au moins un doublet libre).
Exemple :
Un donneur d’ion O2- (riche en électrons) est une base.
Page 9.
Coefficient de dissociation alpha

Sélectionner l’affirmation exacte :
1- [A]. Coefficient de dissociation d’une base forte ou d’un acide fort : 0
2- Acide faible : plus la concentration initiale d’acide est faible, plus l’acide se dissocie
3- Le degré de dissociation ne dépend pas de l’avancement de la réaction
4- Si autoprotolyse de l’eau négligeable, on ne peut pas calculer le coefficient de dissociation à partir de la concentration initiale et du pH (pH=-log [Oxonium])
L’affirmation 2 est exacte.
Coefficient de dissociation a = Moles dissociées / moles initiales introduites
Valeur entre 0, pas de dissociation, et 1, dissociation totale (100%)
Affirmation 1
Non.
Les bases et acides forts se dissocient entièrement en solution aqueuse :
a = 1.
Coefficient (ou degrés) de dissociation d’une base forte ou d’un acide fort : 1
Affirmation 2
Oui.
Pour un acide faible, plus la concentration initiale d’acide est faible, plus l’acide se dissocie.
Le principe de Le Châtelier l’explique : concentration faible -> l’équilibre se déplace vers une augmentation des produits, une augmentation de la dissociation.
La résolution de la relation Ka fonction du coefficient de dissociation le montrerait aussi.
Affirmation 3
Si.
Le degré
de dissociation dépend de l’avancement de la réaction.
a est nul lorsque l’élément est
introduit pour atteindre sa valeur optimale lorsque la réaction est à
l’équilibre.
Avancement d’une réaction
Affirmation 4
Si.
[B]. Si l’autoprotolyse de l’eau est négligeable, on néglige les H3O+ apportés par l’autoprotolyse et on peut dire que la concentration de la base conjuguée [A-] = [H3O+]
pH = - log [H3O+] = - log [A-]
[A-]= 10^-pH
pH = 3
[A-]=10-3
a = [A-]/[AH] = 0,001/0,1 = 0,01
Degré de dissociation
a = 10-4
(Très faible dissociation)
AH initial = 10 000 moles.
a= molécules dissociées / molécules initiales = A- / 10-4 = 10-4
Après dissociation on a :
1 molécule A-
9999 molécules AH
Page 10.
Acides minéraux

Sélectionner les deux affirmations exactes :
1- Acide nitreux et acide nitrique = même acide
2- Tous les acides minéraux ont au moins un atome d’oxygène
3- [A]. Acide sulfurique
4- Les acides minéraux sont généralement des acides faibles
5- [B]. Acide nitrique et acide nitreux : pKa différents, noms différents, et acides différents
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Acide nitreux (ou nitrite d’hydrogène) HNO2
Acide nitrique (ou nitrate d’hydrogène) HNO3
Pour les oxacides, acides avec atome(s) d’oxygène, le nom de l’acide reflète le niveau d’oxydation.
2 niveaux d’oxydation possibles :
- 1er niveau : ‘ite’, (ou acide … eux),
- 2ème niveau ‘ate’, (ou acide … ique)
4 niveaux d’oxydation possibles (voir figure) :
- 1er niveau : Hypo … ‘ite’,
- 2ème niveau … ‘ite’.
- 3ème niveau … ‘ate’.
- 4ème niveau Per … ‘ate’.
Affirmation 2
Non.
Les acides binaires sont composés d’un atome H et d’un atome minéral (pas d’atome d’oxygène)
Affirmation 3
Oui.
[A]. Acide sulfurique
2 H2O + H2SO4 2 H3O+(aq) + SO42-(aq).
Affirmation 4
Non.
Les acides minéraux peuvent être très forts, avec des pKa < 0
Exemples d’acides minéraux forts :
Acide chlorydrique pKa : -3
Acide sulfurique pKa : -3
Affirmation 5
Oui.
Acide nitrique (HNO3) pKa : -1
Acide nitreux (HNO2) pKa : 3,35
Acides minéraux
Un acide minéral dérive d’un minéral.
- Les hydracides ou acides binaires (HnA),
- Les oxacides ou acides ternaires (HnMOm),
Oxacide : composé oxygène,
Ternaires : trois composés.
Acides binaires
Première nomenclature :
- Nom du non-méta_ure_ d’hydrogène
Exemple :
- Chlorure d’hydrogène (HCl)
Deuxième nomenclature
- acide nom du non-métal _hydrique
Exemple :
Acide
chlorhydrique (HCl)
L’acide chlorhydrique, HCl, en solution aqueuse : H3O++
Cl-(aq)) est couramment utilisé dans l'industrie.
Acides ternaires
Trois composants sont toujours présents dans un acide ternaire :
- L’hydrogène,
- Un non-métal,
- L’oxygène. (D’où l’autre nom : Oxacide)
Première nomenclature :
- Nom du non-métal_ate ou ite d’hydrogène
Exemple :
- Chlorate d’hydrogène (HClO3)
Deuxième nomenclature
- acide nom du non-métal _ ‘ique ou eux’
Exemple :
Acide chlorique (HClO3)
Page 11.
Acides organiques

Sélectionner l’affirmation exacte :
1- Les acides organiques, contrairement aux acides minéraux, ne sont pas capables de libérer un proton H+
2- Les acides organiques sont très solubles dans l’eau
3- Acides organiques les plus courants : acides carboxyliques (généralement acides faibles), et acides sulfoniques (acides relativement forts)
4- Les acides gras sont solubles dans l’eau
L’affirmation 3 est exacte.
Affirmation 1
Si.
Les acides organiques, comme les minéraux, libèrent des protons H+.
Le proton H+ provient de groupements fonctionnels « acides » :
- carboxylique –COOH, sous-classe : acide benzoïque,
- sulfonique -SO2OH,
- hydroxyle –OH,
- sulfhydryle –SH,
- les alcool, énols, phénols,
- …
Affirmation 2
Non.
Les acides organiques sont très peu solubles dans l’eau
Ils sont généralement très solubles dans des solvants organiques.
Affirmation 3
Oui.
Acides organiques les plus courants : acides carboxyliques (généralement des acides faibles), et acides sulfoniques (acides relativement forts)
Les acides organiques sont utilisés comme acidulants, conservateurs, émulsifiants, antioxydants, …
Acide
citrique (E330), acide lactique
Affirmation 4
Correct.
Un acide gras, hydrophobe, insoluble dans l’eau, n’a pas la capacité de créer des liaisons hydrogène avec les molécules d’eau.
Il est
souvent apolaire et n’a pas la possibilité de créer une liaison
dipôle-dipôle.
Généralement soluble dans des solvants organiques
(Acétone, hydrocarbures légers)
Acides organiques
Acides carboxyliques
Les acides carboxyliques contiennent le groupement fonctionnel carboxyle (-C(O)OH).
Les acides aminés, briques de base des protéines, sont des acides carboxyliques.
Les bases conjuguées des acides carboxyliques sont des « carboxylates ».
Exemples d’acides
carboxyliques
- Acide acétique, CH3COOH,
présente dans le vinaigre, antiseptique et désinfectant.
Acide acétique = acide étanoïque ; base
associée : acétate (ion éthanoate), CH3COO-
L’acide acétique est au centre de nombreuses molécules complexes de la biologie, de synthèses et dégradations des aliments, etc.
-
Acide acétylsalicylique, HC9H7O4,
dans l’aspirine,
- Acide ascorbique, H2C6H6O6,
vitamine C.
- Acide citrique, H3C6H5O7,
dans les agrumes,
- acide formique, HCO2H.
Acides sulfoniques
Les acides sulfoniques contiennent le groupement fonctionnel sulfonique (-SO2OH).
Exemples :
- Acide méthanesulfonique
CH3SO2OH, réactif
très utilisé en synthèse organique.
- Acide paratoluènesulfonique, appelé l’APTS
Groupes fonctionnels
- Groupes d’atomes utilisés en chimie organique,
- Structure sub-moléculaire, assemblage d’atomes,
- Confère des réactivités et des propriétés spécifiques à la molécule qui le contient,
- Notés R, R’, … dans les formules
Voir Groupements fonctionnels.
Page 12.
Résumé. pka

Sélectionner les deux affirmations exactes :
1- pKA de l’acide éthanoïde = 4,7 = acide fort
2- Le pH d’une solution d’acide éthanoïque est à 4 : l’acide prédomine dans la solution
3- Le pH d’un acide fort : pH = pKa + log ([Base] / [Acide]
4- Pas de relation entre les concentrations [Ion oxonium] et [Ion hydronium]
5- [A]. Une base est d’autant moins puissante que son acide conjugué est puissant
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
Acide éthanoïque :
- pKa = 4,7 à 25°C (voir table pKa de la figure),
- pKa < 6,5 : acide, et >0
- acide faible
Acides forts : pka négatifs (<-2)
Affirmation 2
Oui.
Voir figure [B]
Affirmation 3
Non.
pH d’un acide fort :
pH= - Log [C]
pH directement lié à la concentration [C] de l’acide.
pH d’un acide faible :
pH = pKa + log ([Base]/[Acide])
Affirmation 4
Si.
Potentiel électronique de l’eau Ke = [H3O+].[HO-] = 10-14