Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1
Réactions
chimiques équilibrées
Sélectionner
les deux affirmations exactes :
1- Loi
d’action des masse et constante d’équilibre : les quantités de produits
sont au dénominateur
2- À
l’équilibre, les quantités de réactifs et de produits sont stables
3- Réaction
chimique équilibrée : la réaction ne s’effectue que dans le sens réactifs
produits
4- Réaction
équilibrée : Si on diminue la quantité d’un produit, le système réagit
pour en récréer, et revenir à l’équilibre
5- Un
équilibre chimique ne dépend pas des conditions extérieures
Les
affirmations 2 et 4 sont exactes.
Affirmation
1
Non.
Loi
d’action des masse et constante d’équilibre : les quantités de produits
sont au numérateur.
Affirmation3
Non.
Réaction chimique équilibrée = Superposition
de réactions
- sens réactifs => produits et de réactions
inverses,
- sens produits => réactifs.
Affirmation
4
Oui.
La
constante d’équilibre K a une valeur constante qui dépend de la réaction chimique
considérée et des conditions extérieures.
Si le
numérateur diminue (on enlève des produits), les réactifs du dénominateur seront
consommés pour recréer du produit et rétablir l’équilibre.
Affirmation
5
Si.
L’équilibre
chimique est maintenu tant qu’on ne modifie pas les conditions extérieures
(température, pression, quantités mises en jeu), que le système reste un
système fermé.
Page 2
Constante
d’équilibre
Sélectionner
l’affirmation exacte :
1-
Constante d’équilibre : les coefficients stoechiométriques n’entrent pas
en ligne de compte
2- [A]. NO2
3- Pour
une réaction chimique donnée, à conditions extérieures constantes (température,
pression, etc.), la constante d’équilibre K a une valeur constante
4- Constante d’équilibre : en moles par litre
L’affirmation
3 est exacte.
Affirmation
1
Si.
Constante
d’équilibre : Les coefficients
stoechiométriques sont portés en exposants des concentrations.
Affirmation
2
Non.
[A].
Numérateur
=> produit => réponse correcte : NO
Affirmation
3
Oui.
La
constante d’équilibre K, (ou Kc ; c pour
concentration), pour une réaction chimique donnée, à conditions
extérieures données, a une valeur constante.
Les concentrations sont exprimées en moles par litre.
Les
constantes d'équilibre sont généralement données à 25 °C.
Affirmation
4
Non.
La
constante d’équilibre k est une grandeur sans
unité.
Page 3
Qr.
Homogène/hétérogène
Sélectionner
les deux affirmations exactes :
1- Si le
coefficient de réaction Qr est supérieur à la constante d’équilibre k, la
réaction s’arrête
2- La
quantité de solvant intervient dans l’expression d’une constante d’équilibre
3-
Milieux homogènes et milieux hétérogènes : Les éléments d’équilibre sont à
considérer de la même manière
4- Un
réactif solide et des produits en états ioniques peuvent établir un équilibre
chimique
5- Système
homogène : Les grandeurs intensives sont identiques en tous lieux du
système
6- Les
mélanges gazeux sont des systèmes hétérogènes
Les affirmations
4 et 5 sont exactes.
Affirmation
1
Non.
Qr,
quotient de réaction : expression des concentrations hors équilibre
(équilibre Qr = K)
Un
système tend à revenir à l’équilibre.
Si Qr
> K, le système tend à retourner à l’équilibre en augmentant les quantités
de réactifs et diminuant les quantités de produits.
Affirmation
2
Non.
Le solvant n’intervient pas dans l’expression d’une constante
d’équilibre.
Affirmation
3
Non.
L’activité d’un élément chimique dépend du milieu considéré.
L’avancement et l’équilibre d’une réaction chimique sont liés aux activités
chimiques des composants présents.
Voir page suivante.
Affirmation
4
Oui.
Un
équilibre chimique peut s’établir entre un réactif solide et des produits en
états ioniques.
Exemple :
CaSO4
<-> Ca++ + SO4-
Le milieu
est hétérogène :
- un
solide, le sulfate de calcium, CaSO4,
- en
milieu aqueux,
-
formations d’ions.
Affirmation
5
Oui.
Système homogène : Les grandeurs intensives sont identiques
en tous lieux du système.
Grandeurs
intensives :
Grandeurs
qui ne dépendent pas de la taille du système. Exemples : température,
masse volumique, concentration.
Grandeurs
extensives :
Grandeurs
qui dépendent de la taille du système. Exemples : volume, quantité de
matière, masse.
Affirmation
6
Non.
Les mélanges gazeux sont des systèmes homogènes.
Les
grandeurs intensives (température, pression, etc.) sont identiques en tous
points du système.
Page 4
Activités des
espèces chimiques
Sélectionner
les deux affirmations exactes :
1- [A].
Concentration de H2O
2- [B].
Les concentrations des produits ioniques n’interviennent pas dans le calcul de
K
3- Coefficient
d’activité : concentration active, potentiel de réactivité d’un composant
4- [B]. K
= [Ca++].[SO4-] / [CaSO4]
5- Activité
chimique d’un gaz : Pression du gaz par rapport à la pression de référence
6-
Activité chimique d’un soluté : [Concentration du soluté] / [Concentration
du solvant]
Les affirmations
3 et 5 sont exactes.
L’activité
chimique d’une espèce chimique est son activité effective en solution. Les
autres composants de la solution, par leur interaction d’ordre électrostatique,
ont un effet amoindrissant.
Pour
définir l’activité chimique réelle, la concentration active est la
concentration multipliée par coefficient d’activité <1.
Affirmation
1
Non.
[A] :
Activité = 1.
La
concentration de solvant ne varie pas lors d’une réaction chimique : Le solvant n’entre pas en ligne de compte dans
le calcul de Qr ou de K.
S’il apparaît dans l’équation chimique, remplacer sa concentration par son
activité, 1, dans les formules de Qr et de k.
1 = pas
d’action.
Formules Qr, K : Ne pas tenir compte des solides, des
liquides, du solvant
(Coefficient d’activité = 1)
Affirmation
4
Non.
[B].
Coefficient
d’un solide en milieu hétérogène =1 : n’intervient pas.
K = [Ca++].[SO4-]
/ 1 = [Ca++].[SO4-]
Affirmation
5
Oui.
L’activité d’un gaz est la pression du gaz par rapport à la pression de
référence.
La
pression de référence P0 est choisie égale à 1 bar.
Affirmation
6
Non.
Activité d’un soluté : [Concentration du soluté], la concentration de référence
étant prise égale à 1 mole par litre.
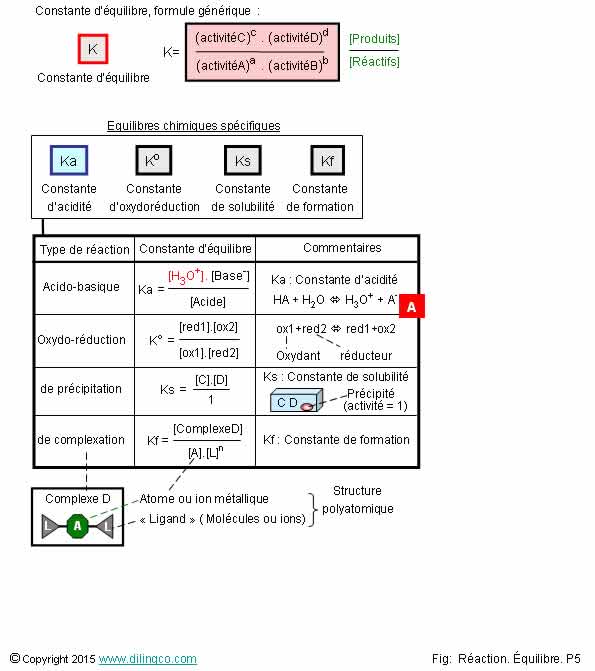
Page 5
Équilibres
chimiques particuliers
Sélectionner
les deux affirmations exactes :
1- Dans
une réaction acido-basique, l’acide est le produit de la réaction
2- Dans
une réaction de précipitation, le précipité apparaît dans la constante
d’équilibre
3- Réaction
d’oxydo-réduction : échange d’électron(s) entre un oxydant et un réducteur
4-
Acide : élément capable de capter des protons H+
5- Plus
Ka est grand, plus l’acide se dissocie dans l’eau, plus l’acide est fort
6- [A].
Dans la formule générique présentée, A est l’acide
7- La
solubilité s des produits n’intervient pas dans la constante de solubilité
Les affirmations
3 et 5 sont exactes.
Affirmation
3
Non.
Réaction
d’oxydo-réduction : échange d’électron(s) entre un oxydant et un
réducteur.
Oxydant : donneur d’électron(s).
Oxydation : perte d’électron(s).
Affirmation
4
Non.
Acide : élément capable de donner des protons H+.
En
solution aqueuse, ces protons s’associent immédiatement avec l’eau pour donner
des cations Oxonium H3O+.
Par
définition, les molécules d’acides ont des atomes
d’hydrogène.
Exemples
d’acides :
- HNO3, acide nitrique,
- HCL, acide chlorhydrique,
- HClO, acide perchlorique,
- H2SO4, acide sulfurique,
- etc.
Affirmation
6
Non.
[A].
Dans la formule
générique présenté, l’acide HA
(Contient un atome d’hydrogène), se dissocie en proton H (lié à l’eau :
cation oxonium)
et en base A.
La base A provient de l’acide HA.
HA et A
forme un couple acide-base.
Affirmation
7
Si.
S, solubilité = possibilité maximum de dissolution d’un soluté dans un solvant
avant saturation et dépôt.
Une solution saturée ne peut plus dissoudre de soluté.
La solubilité
s’exprime en moles par litre (mol.L-1).
Exemple :
S = 0,014 mol.L-1 pour le sulfate
d’argent.
Page 6
pK. pKa. pH
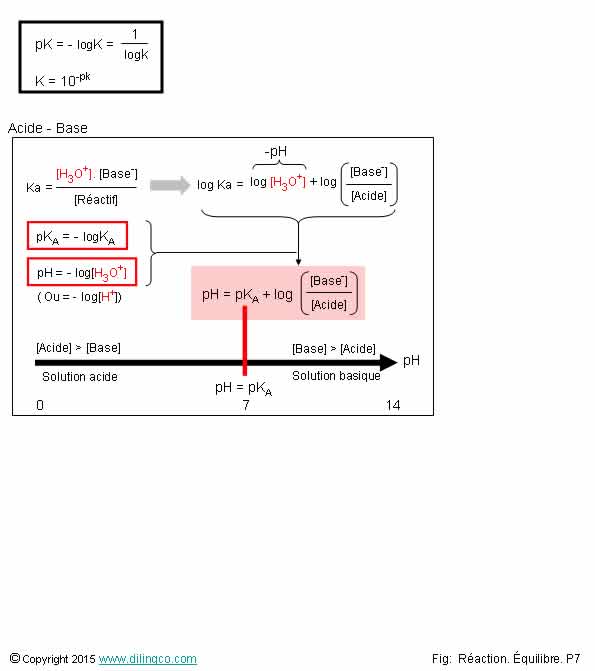
Sélectionner
l’affirmation exacte :
1- pH
n’est pas égal à –log[H+]
2- pK=-logK.
pk est défini comme étant l’inverse du log décimal de la constante d’équilibre k.
Si K est grand, pK est petit, et vice versa
3- Le pH
permet de définir le caractère oxyde ou réducteur d’une solution
L’affirmation
2 est exacte.
Affirmation
1
Si.
pH, potentiel hydrogène, activité des ions hydrogènes.
pH
= - log[H3O+] = - log[H+]
Les ion oxonium
étant l’hydratation des protons H+
Affirmation
3
Non.
Le pH
permet de définir le caractère acide ou basique d’une solution.
Le pH étant l’inverse du logarithme de la concentration de proton H, plus pH est petit, plus il y a d’H+, plus la solution
est acide.
Logarithme
Logarithme
de base b d’un nombre réel x = puissance à laquelle il faut élever la base b
pour obtenir le nombre x.
Logarithme
décimal, base
10 :
log
(x) = 10x
log
(1000) = 3 car 1000=103
Log (1) =
0
Log (10)
= 1
Logarithme
népérien, base e :
ln(x)
= ex
e, base
des ln = 2,718281828…
(2,7
suivis de 2 fois 1828!)
ln(1)=0
ln( e )
=1
Le
logarithme népérien, fonction notée ln, est la fonction primitive de 1/X.
(La
dérivée de ln(x) = 1/x)
Formules
indispensables
ln(x)
= Y <----> x=ey
ln(ab)
= ln(a)+ln(b)
ln(1/b) = -ln(b)
ln(a/b) = ln(a) – ln(b)
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1
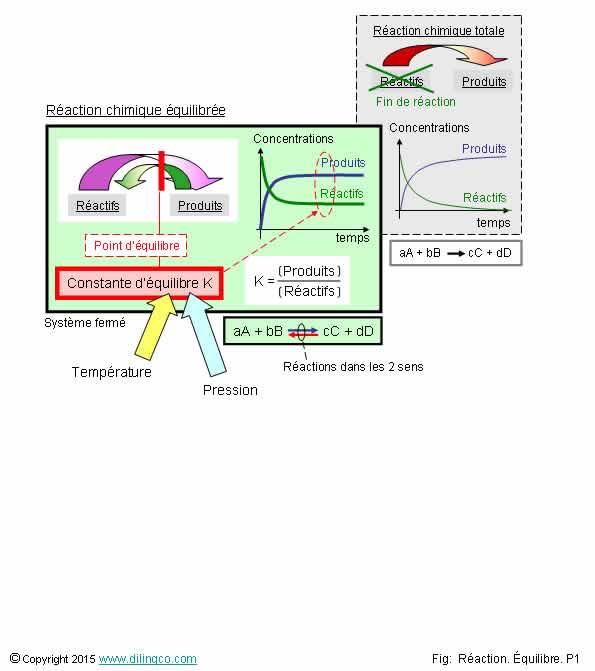
Réactions chimiques équilibrées

Sélectionner les deux affirmations exactes :
1- Loi d’action des masse et constante d’équilibre : les quantités de produits sont au dénominateur
2- À l’équilibre, les quantités de réactifs et de produits sont stables
3- Réaction chimique équilibrée : la réaction ne s’effectue que dans le sens réactifs produits
4- Réaction équilibrée : Si on diminue la quantité d’un produit, le système réagit pour en récréer, et revenir à l’équilibre
5- Un équilibre chimique ne dépend pas des conditions extérieures
Les affirmations 2 et 4 sont exactes.
Affirmation 1
Non.
Loi d’action des masse et constante d’équilibre : les quantités de produits sont au numérateur.
Affirmation3
Non.
Réaction chimique équilibrée = Superposition de réactions
- sens réactifs => produits et de réactions inverses,
- sens produits => réactifs.
Affirmation 4
Oui.
La constante d’équilibre K a une valeur constante qui dépend de la réaction chimique considérée et des conditions extérieures.
Si le numérateur diminue (on enlève des produits), les réactifs du dénominateur seront consommés pour recréer du produit et rétablir l’équilibre.
Affirmation 5
Si.
L’équilibre chimique est maintenu tant qu’on ne modifie pas les conditions extérieures (température, pression, quantités mises en jeu), que le système reste un système fermé.
Page 2
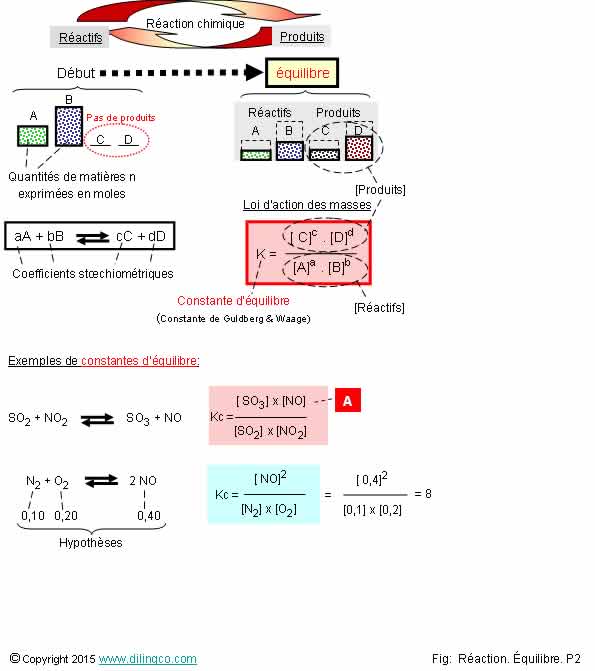
Constante d’équilibre

Sélectionner l’affirmation exacte :
1- Constante d’équilibre : les coefficients stoechiométriques n’entrent pas en ligne de compte
2- [A]. NO2
3- Pour
une réaction chimique donnée, à conditions extérieures constantes (température,
pression, etc.), la constante d’équilibre K a une valeur constante
4- Constante d’équilibre : en moles par litre
L’affirmation 3 est exacte.
Affirmation 1
Si.
Constante d’équilibre : Les coefficients stoechiométriques sont portés en exposants des concentrations.
Affirmation 2
Non.
[A].
Numérateur => produit => réponse correcte : NO
Affirmation 3
Oui.
La
constante d’équilibre K, (ou Kc ; c pour
concentration), pour une réaction chimique donnée, à conditions
extérieures données, a une valeur constante.
Les concentrations sont exprimées en moles par litre.
Les constantes d'équilibre sont généralement données à 25 °C.
Affirmation 4
Non.
La constante d’équilibre k est une grandeur sans unité.
Page 3
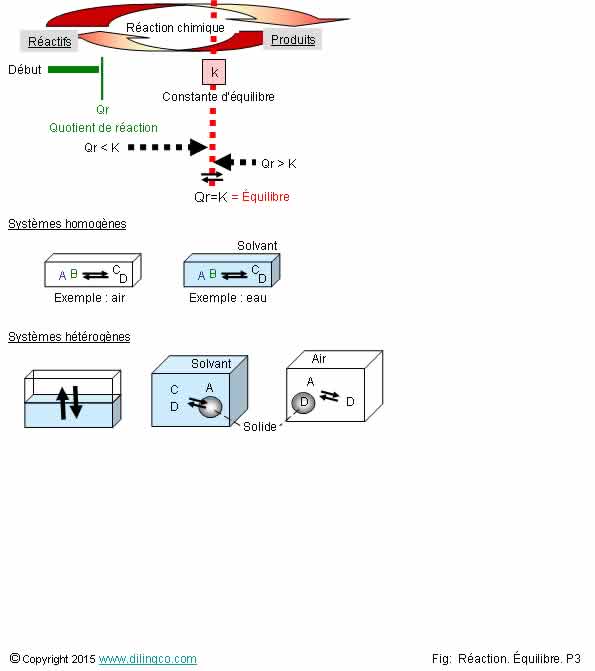
Qr. Homogène/hétérogène

Sélectionner les deux affirmations exactes :
1- Si le coefficient de réaction Qr est supérieur à la constante d’équilibre k, la réaction s’arrête
2- La quantité de solvant intervient dans l’expression d’une constante d’équilibre
3- Milieux homogènes et milieux hétérogènes : Les éléments d’équilibre sont à considérer de la même manière
4- Un réactif solide et des produits en états ioniques peuvent établir un équilibre chimique
5- Système homogène : Les grandeurs intensives sont identiques en tous lieux du système
6- Les mélanges gazeux sont des systèmes hétérogènes
Les affirmations 4 et 5 sont exactes.
Affirmation 1
Non.
Qr, quotient de réaction : expression des concentrations hors équilibre (équilibre Qr = K)
Un système tend à revenir à l’équilibre.
Si Qr > K, le système tend à retourner à l’équilibre en augmentant les quantités de réactifs et diminuant les quantités de produits.
Affirmation 2
Non.
Le solvant n’intervient pas dans l’expression d’une constante d’équilibre.
Affirmation 3
Non.
L’activité d’un élément chimique dépend du milieu considéré.
L’avancement et l’équilibre d’une réaction chimique sont liés aux activités
chimiques des composants présents.
Voir page suivante.
Affirmation 4
Oui.
Un équilibre chimique peut s’établir entre un réactif solide et des produits en états ioniques.
Exemple :
CaSO4 <-> Ca++ + SO4-
Le milieu est hétérogène :
- un solide, le sulfate de calcium, CaSO4,
- en milieu aqueux,
- formations d’ions.
Affirmation 5
Oui.
Système homogène : Les grandeurs intensives sont identiques en tous lieux du système.
Grandeurs intensives :
Grandeurs qui ne dépendent pas de la taille du système. Exemples : température, masse volumique, concentration.
Grandeurs extensives :
Grandeurs qui dépendent de la taille du système. Exemples : volume, quantité de matière, masse.
Affirmation 6
Non.
Les mélanges gazeux sont des systèmes homogènes.
Les grandeurs intensives (température, pression, etc.) sont identiques en tous points du système.
Page 4
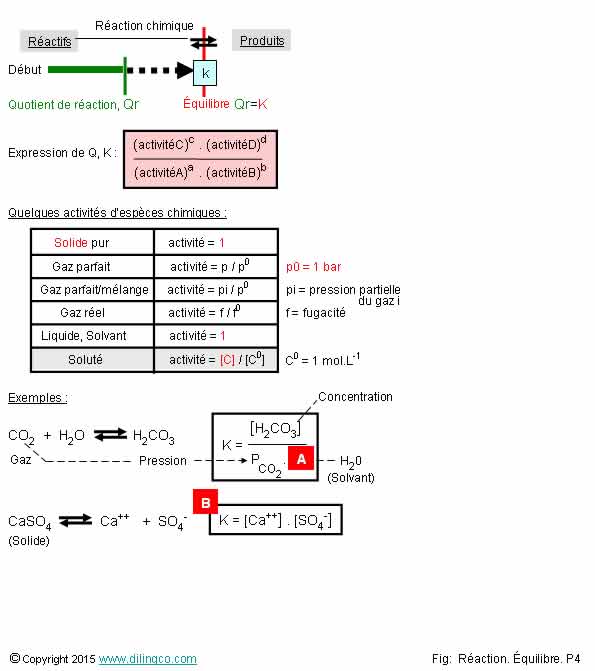
Activités des espèces chimiques

Sélectionner les deux affirmations exactes :
1- [A]. Concentration de H2O
2- [B]. Les concentrations des produits ioniques n’interviennent pas dans le calcul de K
3- Coefficient d’activité : concentration active, potentiel de réactivité d’un composant
4- [B]. K = [Ca++].[SO4-] / [CaSO4]
5- Activité chimique d’un gaz : Pression du gaz par rapport à la pression de référence
6- Activité chimique d’un soluté : [Concentration du soluté] / [Concentration du solvant]
Les affirmations 3 et 5 sont exactes.
L’activité chimique d’une espèce chimique est son activité effective en solution. Les autres composants de la solution, par leur interaction d’ordre électrostatique, ont un effet amoindrissant.
Pour définir l’activité chimique réelle, la concentration active est la concentration multipliée par coefficient d’activité <1.
Affirmation 1
Non.
[A] : Activité = 1.
La
concentration de solvant ne varie pas lors d’une réaction chimique : Le solvant n’entre pas en ligne de compte dans
le calcul de Qr ou de K.
S’il apparaît dans l’équation chimique, remplacer sa concentration par son
activité, 1, dans les formules de Qr et de k.
1 = pas d’action.
Formules Qr, K : Ne pas tenir compte des solides, des liquides, du solvant (Coefficient d’activité = 1)
Affirmation 4
Non.
[B].
Coefficient d’un solide en milieu hétérogène =1 : n’intervient pas.
K = [Ca++].[SO4-] / 1 = [Ca++].[SO4-]
Affirmation 5
Oui.
L’activité d’un gaz est la pression du gaz par rapport à la pression de référence.
La pression de référence P0 est choisie égale à 1 bar.
Affirmation 6
Non.
Activité d’un soluté : [Concentration du soluté], la concentration de référence étant prise égale à 1 mole par litre.
Page 5
Équilibres chimiques particuliers

Sélectionner les deux affirmations exactes :
1- Dans une réaction acido-basique, l’acide est le produit de la réaction
2- Dans une réaction de précipitation, le précipité apparaît dans la constante d’équilibre
3- Réaction d’oxydo-réduction : échange d’électron(s) entre un oxydant et un réducteur
4- Acide : élément capable de capter des protons H+
5- Plus Ka est grand, plus l’acide se dissocie dans l’eau, plus l’acide est fort
6- [A]. Dans la formule générique présentée, A est l’acide
7- La solubilité s des produits n’intervient pas dans la constante de solubilité
Les affirmations 3 et 5 sont exactes.
Affirmation 3
Non.
Réaction d’oxydo-réduction : échange d’électron(s) entre un oxydant et un réducteur.
Oxydant : donneur d’électron(s).
Oxydation : perte d’électron(s).
Affirmation 4
Non.
Acide : élément capable de donner des protons H+.
En solution aqueuse, ces protons s’associent immédiatement avec l’eau pour donner des cations Oxonium H3O+.
Par définition, les molécules d’acides ont des atomes d’hydrogène.
Exemples d’acides :
- HNO3, acide nitrique,
- HCL, acide chlorhydrique,
- HClO, acide perchlorique,
- H2SO4, acide sulfurique,
- etc.
Affirmation 6
Non.
[A].
Dans la formule
générique présenté, l’acide HA
(Contient un atome d’hydrogène), se dissocie en proton H (lié à l’eau :
cation oxonium)
et en base A.
La base A provient de l’acide HA.
HA et A forme un couple acide-base.
Affirmation 7
Si.
S, solubilité = possibilité maximum de dissolution d’un soluté dans un solvant avant saturation et dépôt.
Une solution saturée ne peut plus dissoudre de soluté.
La solubilité s’exprime en moles par litre (mol.L-1).
Exemple :
S = 0,014 mol.L-1 pour le sulfate d’argent.
Page 6
pK. pKa. pH

Sélectionner l’affirmation exacte :
1- pH n’est pas égal à –log[H+]
2- pK=-logK. pk est défini comme étant l’inverse du log décimal de la constante d’équilibre k. Si K est grand, pK est petit, et vice versa
3- Le pH permet de définir le caractère oxyde ou réducteur d’une solution
L’affirmation 2 est exacte.
Affirmation 1
Si.
pH, potentiel hydrogène, activité des ions hydrogènes.
pH = - log[H3O+] = - log[H+]
Les ion oxonium étant l’hydratation des protons H+
Affirmation 3
Non.
Le pH
permet de définir le caractère acide ou basique d’une solution.
Le pH étant l’inverse du logarithme de la concentration de proton H, plus pH est petit, plus il y a d’H+, plus la solution
est acide.
Logarithme
Logarithme de base b d’un nombre réel x = puissance à laquelle il faut élever la base b pour obtenir le nombre x.
Logarithme décimal, base 10 :
log (x) = 10x
log (1000) = 3 car 1000=103
Log (1) = 0
Log (10) = 1
Logarithme népérien, base e :
ln(x) = ex
e, base des ln = 2,718281828…
(2,7 suivis de 2 fois 1828!)
ln(1)=0
ln( e ) =1
Le logarithme népérien, fonction notée ln, est la fonction primitive de 1/X.
(La dérivée de ln(x) = 1/x)
Formules indispensables
ln(x) = Y <----> x=ey
ln(ab) = ln(a)+ln(b)
ln(1/b) = -ln(b)
ln(a/b) = ln(a) – ln(b)