Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Ordre réactionnel
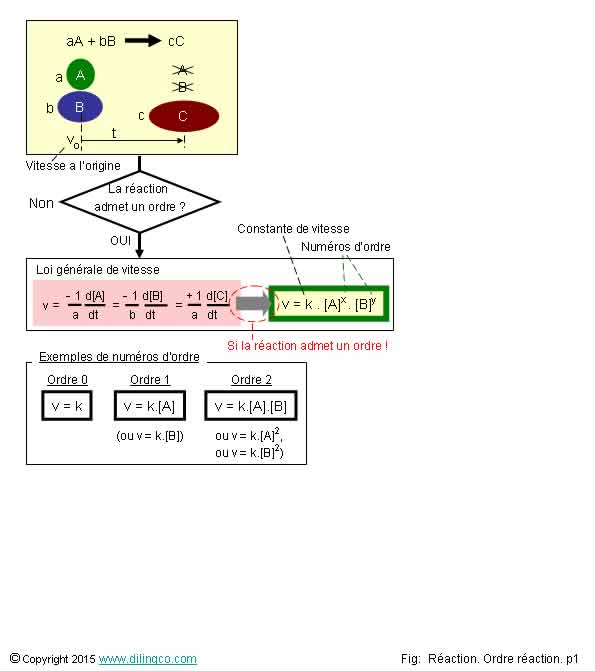
Sélectionner
l’affirmation exacte :
1- Ordre
réactionnel : influence d’un réactif dans la cinétique d’une réaction
chimique
2- Toutes
les réactions chimiques admettent un ordre réactionnel
3- La
réalisation et la vitesse d’une réaction chimique dépendent toujours des concentrations
de réactifs
4- La
vitesse d’une réaction d’ordre 2 décroît à la même vitesse que la concentration
du composé chimique d’ordre 2
L’affirmation
1 est exacte.
Affirmation
2
Non.
Les réactions chimiques n’admettent pas toujours un ordre.
Les
vitesses réactionnelles ne peuvent pas toujours se réduire à des formules
simples :
v=k, v=k.[C], v=k.[C]2, v=k.[C1][C2]
K :
-
coefficient de vitesse (ou constante de vitesse),
- ne
dépend pas des concentrations,
- dépend
de la température (Exprimée en Kelvin),
- se
calcule avec la loi d’Arrhenius.
Affirmation
3
Non.
La
réalisation d’une réaction chimique dépend des réactifs, des énergies d’activation,
des catalyseurs eventuels, …
La vitesse de réaction ne dépend pas toujours des réactifs.
Voir résumé ci-dessous.
Affirmation
4
Non.
La
vitesse d’une réaction d’ordre 2 décroît beaucoup moins vite (k x concentration
au carré) que la vitesse de disparition du réactif d’ordre 2.
Ordre 0 :
La
vitesse de réaction ne dépend pas des
concentrations des réactifs.
Elle est constante, égale à K, coefficient de vitesse, calculable par la loi d’Arrhenius.
Ordre 1 :
La
vitesse de réaction est proportionnelle à la
concentration d’un seul des réactifs ; réactif A, ou
réactif B.
Mais pas
aux deux (si tel était le cas, ce serait une réaction d’ordre 2)
Ordre 2 :
La
vitesse de réaction est égale à :
V = K.[A]2, si le réactif A est d’ordre 2,
V = K.[A].[B], si les réactifs A et B sont tous deux d’ordre 1.
Page 2.
Ordre global. Ordre
partiel
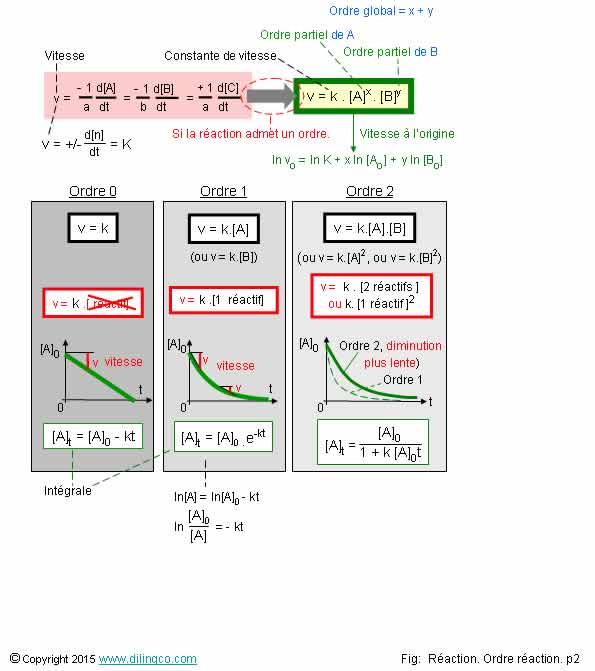
Sélectionner
les deux affirmations exactes :
1- K,
constante de vitesse, ne dépend pas de la température
2- Une
réaction aA+bB=cC admet un ordre si l’expérience montre que v peut s’exprimer
en fonction des concentrations des réactifs
3- Ordre
0 : La vitesse de réaction dépend de la concentration d’un réactif
4- Une
réaction d’ordre global 2 peut être d’ordre partiel 2 pour un des réactifs et d’ordre
partiel 0 pour l’autre, ou d’ordre 1 pour les 2 réactifs
5- Les ordres
partiels sont égaux aux coefficients stœchiométriques
6- La
vitesse d’une réaction chimique admettant un ordre >0 augmente au cours du
temps
Les
affirmations 2 et 4 sont exactes.
Affirmation
1
Si.
K, coefficient de vitesse :
- dépend
de la température,
- est
calculable par la loi d’Arrhenius.
Affirmation
2
Oui.
Une
réaction aA+bB=cC admet un ordre (0, 1, 2, ..) si, par expérience, on voit que la
vitesse peut s’exprimer en fonction des concentration des réactifs suivant un
monôme v=k.[A]x. [B]y
Avec :
K :
Constante de vitesse de réaction
x,y : ordres partiels des réactifs A et B
x+y : ordre global de la réaction.
Affirmation
3
Non.
Ordre 0 : La vitesse est constante, indépendante de la concentration
d’un quelconque des réactif.
Affirmation
4
Oui.
Cas général : Les réactions d’ordre 2 sont proportionnelles
aux concentrations des 2 réactifs. V=k [A].[B]
(Total
des ordres partiels x+y =2)
Une réaction
d’ordre global 2 peut être d’ordre partiel 2 pour un des réactifs ((proportionnel
au carré de la concentration), d’ordre partiel 0 pour l’autre (insensible à la
concentration).
Dans ce
cas : V=k [A]2 (ou V=k [B]2)
Exemple :
NO2
+ CO => NO+CO2
V=k.[NO2]2, vitesse indépendante
de la concentration de CO.
NO, ordre
partiel x=2
CO2,
ordre partiel y=0
Ordre
global X+y=2
Affirmation
5
Non.
Pas de lien entre les coefficients stœchiométriques et les
ordres partiels.
Exemple :
Réaction :
2 NO + 2
H2 => 2H2O + N2
Coefficients stœchiométriques : 2 et 2
Vitesse : v = k. [NO]2 . [H2]1
Ordres
partiels : 2 et 1
Ordre
global de la réaction : 2 + 1 = 3
Notes :
- Les ordres partiels, et donc les ordres globaux, ne sont pas toujours
des nombres entiers,
- Les
ordres de réaction peuvent inclure des produits
Voir page « Exemples d’équations »
Affirmation
6
Non.
La vitesse d’une réaction chimique admettant un ordre supérieur
à zéro :
- diminue au cours du temps (les concentrations en
réactifs ne pouvant que diminuer,
- a sa valeur maximum en début de réaction.
Note :
Ordre 0 =
vitesse constante, indépendante des concentrations.
Ordre
0
Variation
de la concentration du réactif A en fonction du temps:
[A] = [A0] - kt
Variation
de A : Droite de pente –k
Ordre 1
Variation
de la concentration du réactif A en fonction du temps:
ln[A]/[A]0 = - kt
Variation
de ln[A] : Droite de pente –k
Ordre 2
Variation
de la concentration du réactif A en fonction du temps:
1/[A]-1/[A]0 = - kt
Variation
de 1[A] : Droite de pente –k
Logarithme népérien
Fonction
notée ln,
Définie sur
]0, et +[
>
Primitive de 1/X qui s’annule en x = 1
(Dérivée
de ln(x) = 1/x)
Formules
indispensables
ln(x)
= Y <----> x=ey
ln(ab)
= ln(a)+ln(b)
ln(1/b) = -ln(b)
ln(a/b) = ln(a) – ln(b)
ln(an)
= n ln(a)
ln(racine de a ) = ½ ln(a)
Page 3.
Unités de K, constante de
vitesse
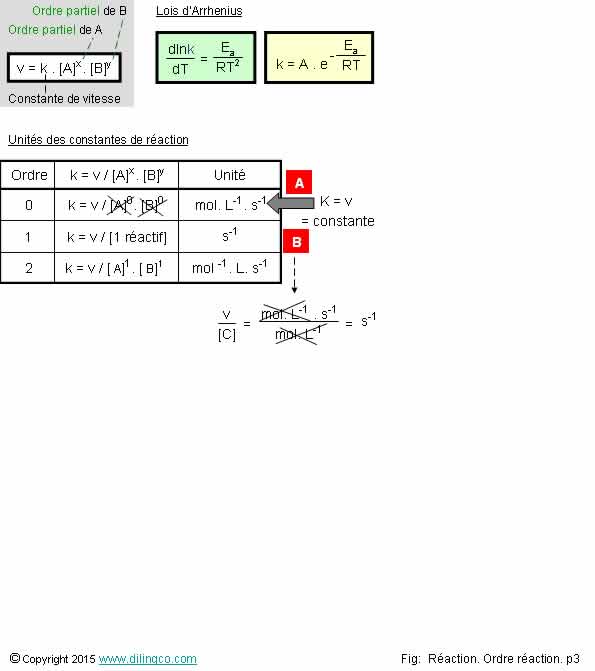
Sélectionner l’affirmation exacte :
1- L’unité
de la constante de vitesse k, est la même pour tous les ordres réactionnels
2- K ne
dépend pas de la température
3- [A].
Ordre 0 : K = v. Unité de K : moles par litre et par seconde
4- [B].
Ordre 1 : K en mole par secondes
L’affirmation
3 est exacte.
Affirmation
1
Non.
L’unité
de la constante de vitesse k n’est pas la même d’un ordre réactionnel à
l’autre.
Dans les
exercices, l’unité de k est un indice pour trouver
le numéro d’ordre d’une réaction chimique.
Affirmation
2
Si.
La
constante de vitesse k (ou coefficient de vitesse), dépend de la
température. K augmente avec la température.
Voir Loi d’Arrhenius.
Affirmation
3
Oui.
Si k = v,
la constante de vitesse et la vitesse v ont la même unité.
Moles par
litre et par seconde, mol.L-1.s
Affirmation
4
Non.
[B].
Ordre 1 : K en s-1
Page 4.
Temps de demi-réaction
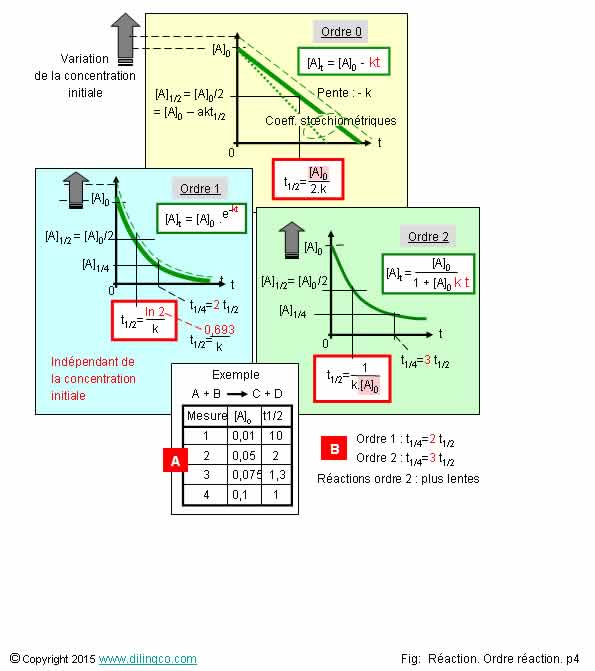
Sélectionner
les deux affirmations exactes :
1- Ordre
0 : Le temps de demi-réaction est proportionnel à la concentration initiale
2- Aucun
ordre de réaction n’a un temps de demi-réaction indépendant de la concentration
initiale
3- Ordre
1 : Le temps de demi-réaction est inversement proportionnel à la
concentration initiale
4- [A].
D’après les mesures, le temps de demi-réaction est inversement proportionnel à
la concentration initiale [A] = réaction d’ordre 2
5- [B] :
Les réactions d’ordre 2 sont plus rapides que les réactions d’ordre 1
Les affirmations
1 et 4 sont exactes.
Ordre 0 :
t de demi-réaction proportionnel à [A]0
Ordre 1 :
t de demi-réaction indépendant de [A]0
Ordre 2 :
t de demi-réaction inversement proportionnel à [A]0
Affirmation
2
Si.
L’ordre
de réaction 1 a un temps de demi-réaction indépendant de la concentration
initiale.
Affirmation 3
Non.
Ordre 1 : le temps de demi-réaction (ou de quart de réaction) est indépendant des concentrations initiales.
Ordre 2 :
le temps de demi-réaction est inversement proportionnel à la concentration
initiale.
Affirmation
4
Oui.
[A].
4 mesures
successives avec 4 concentrations initiales de A différentes.
Les temps
de ½ réaction obtenus sont inversement
proportionnels aux concentrations initiales : réaction d’ordre 2.
Affirmation
5
Non.
[B].
Les réactions d’ordre 2 sont plus lentes que les réactions d’ordre 1.
t1/4 = 2 t/2 = réaction d’ordre
1.
t1/4 = 3 t/2 = réaction d’ordre
2.
Page 5.
Déterminer l’ordre. t1/2.
V initiale
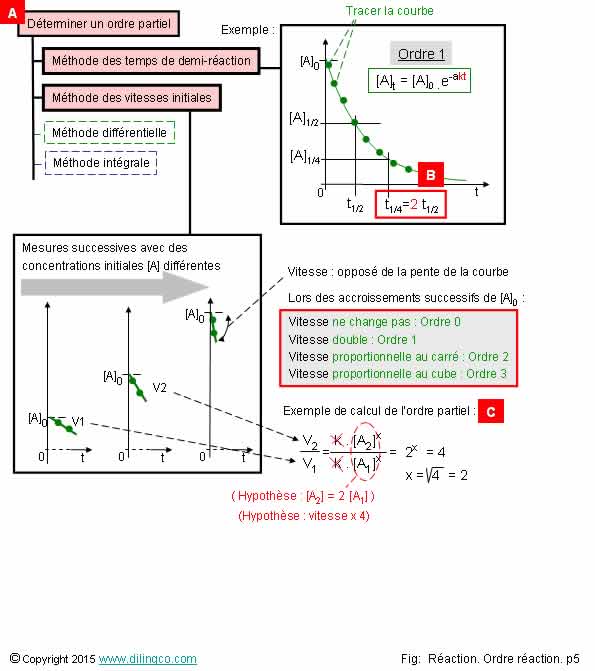
Sélectionner
l’affirmation exacte :
1- Un
réactif introduit en grand excès est le seul réactif à intervenir dans une
réaction
2- [A].
Les méthodes supposent que la vitesse de réaction ne dépend que d’un réactif.
Condition des expériences : être en dégénérescence d’ordre
3- [B]. Temps
¼ réaction = temps de ½ réaction multiplié par 2 = Ordre 2
4- [C]. Vitesse
initiale est multipliée par 4 pour des concentrations initiales doublées :
ordre partiel de la réaction = 4
L’affirmation
2 est exacte.
Affirmation
1
Non.
Un réactif introduit en grand excès :
- sa variation de concentration est négligeable
lors de la réaction,
- son ordre
partiel n’est à considérer, le réactif n’intervient plus dans l’ordre global de
la réaction,
(On dit
qu’il y a dégénérescence de l’ordre pour ce réactif très en excès)
- s’annuler
dans les formules
Exemple :
A en excès : v=k.[A]x.[B]y=k.[B]y
Mettre un
réactif en grand excès de concentration, provoquer sa dégénérescence d’ordre (l’annuler dans la
formule de vitesse), permet, par mesures successives, de déterminer l’ordre partiel des autres réactifs.
Affirmation
2
Oui.
[A]. Les méthodes présentées supposent que la vitesse de
réaction ne dépend que d’un réactif.
Condition
des expériences pour y parvenir : être en
dégénérescence d’ordre.
Dégénérescence d’ordre pour tous les réactifs sauf celui dont on veut définir.
Par des prélèvements successifs et des comparaisons des résultats avec les
courbes habituelles, trouver l’ordre partiel.
Affirmation
3
Non.
[B].
Après avoir tracé la courbe v=ft, si :
- on
trouve une courbe en décroissance exponentielle,
- et que
le temps de ¼ réaction = 2 fois le temps ½ réaction,
la réactif à un ordre 1.
Voir page précédente « Temps de
demi-réaction ».
Affirmation
4
Non.
[C].
Si la
vitesse initiale est multipliée par 4 pour des concentration initiales
doublées, l’ordre partiel = racine carré de 4 = 2.
Si la
vitesse initiale est multipliée par 8 pour des concentration initiales
doublées, l’ordre partiel = racine cubique de 8 = 3.
Si la
vitesse initiale est multipliée par n …
Notes :
- Les
ordres partiels peuvent être des nombres fractionnaires,
- k se déduit facilement si on connaît la vitesse initiale, la concentration initiale, l’ordre
partiel.
Réaction
d’ordre 0
La vitesse de réaction ne dépend pas des concentrations (initiales ou non).
Réaction
d’ordre 1
Proportionnalité accroissement de vitesse - accroissement de concentration
Pour un accroissement d de la concentration initiale, la vitesse initiale augmente aussi de d.
Réaction
d’ordre 2
Proportionnalité au carré.
Pour un accroissement d de la concentration initiale, la vitesse initiale augmente du carré de d.
Mesure des ordres partiels
Les ordres partiels (influencent ou non de la concentration d’un réactif), peuvent
être connus pour une réaction chimique considérée, ou peuvent être déterminés expérimentalement.
Procédure :
- mettre
un réactif en très grande concentration (en
dégénérescence) pour que son % de consommation soit négligeable, [A]t
= [A]0,
- mesurer
par prélèvements l’influence de l’autre réactif pour déterminer l’action de sa
concentration sur la vitesse de la réaction,
- en déduire
son ordre partiel,
-
procéder de manière inverse pour déterminer l’ordre partiel du premier réactif.
Page 6.
Méthode différentielle.
Méthode intégrale
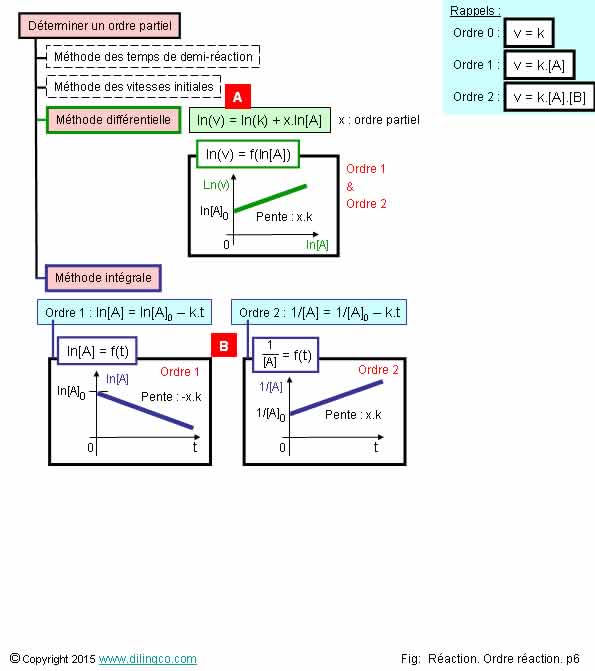
Sélectionner
les deux affirmations exactes :
1- Ordre
0 : la vitesse de réaction est nulle
2- [A]. Différentiation
des courbes "Concentration/temps" = courbes
"Vitesse/temps"
3- [A].
Méthode différentielle, ordres partiels 1 & 2. Dans les 2 cas, ln(v)
fonction ln(concentration) = droite de pente k
4- [B]. Méthode
intégrale, réaction d’ordre 1 : ln [Concentration] par rapport à t est une
exponentielle décroissante
5- [B]. Méthode
intégrale, réaction d’ordre 2 : ln [Concentration] par rapport à t est linéaire
Les affirmations
2 et 3 sont exactes.
Affirmation
1
Non.
Ordre 0 :
la vitesse de réaction est constante : v = a.k
a = coefficient
stœchiométrique
(Égal ou
différent de 1 dans l’équation chimique considérée)
Affirmation
3
Oui.
[A]. Méthode différentielle, ordres partiels 1 &
2. Dans les 2 cas, ln(v) fonction ln(concentration)
= droite de pente k
Affirmation
4
Non.
[B].
Réaction d’ordre
1 : ln [Concentration] par rapport à t est
linéaire.
Affirmation
5
Non.
[B].
Réaction d’ordre
2 : 1/[Concentration] par
rapport à t est linéaire.
Méthode différentielle
La
méthode différentielle peut être utilisée si on a la concentration [A] en
fonction de t.
- Tracer
la courbe [A] f (t),
- Trouver
la vitesse volumique de disparition du réactif A,
- Pour
les réactions admettant un ordre on a v=k.[A]x,
- Trouver
si la loi de vitesse peut être linéarisée ln(v) = ln (k) + x.ln[A],
- Si on
trouve une droite, la pente donne l’ordre partiel.
Méthode intégrale
On essaie
de trouver si :
- ln[A] f(t) est une droite.
Oui : la réaction admet un ordre. Ordre 1.
Pente de la droite : - a.x.k
- 1/[A] f(t) est une droite.
Oui : la réaction admet un ordre. Ordre 2.
Pente de la droite : a.x.k
Page 7.
Exemples de relevés expérimentaux
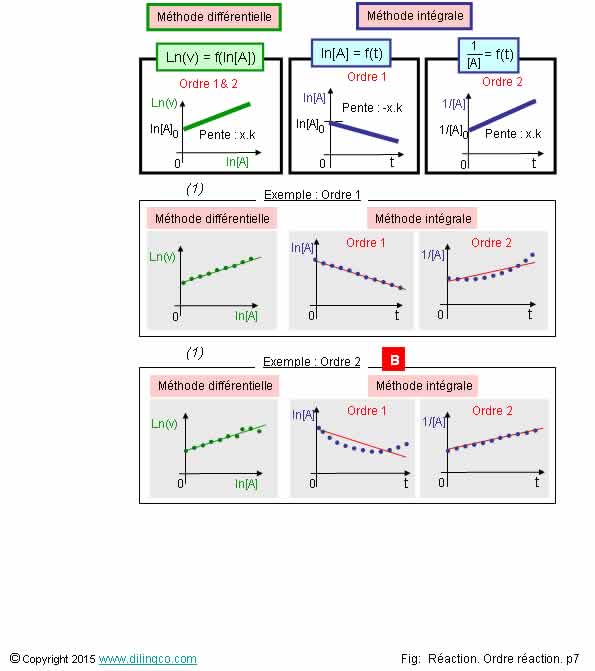
Sélectionner
l’affirmation exacte :
1- Si les
relevés expérimentaux peuvent être linéarisés par la méthode
différentielle = ordre 1
2-
L’intégration des relevés expérimentaux ne permet pas de faire la différence
entre un ordre 1 ou un ordre 2
3-
[A] : ordre partiel 2
L’affirmation
3 est exacte.
Affirmation
1
Non.
Figure (1) :
Dans les 2 cas, ordre 1 et ordre 2, les
relevés expérimentaux, portés à ln(v) = ln(k) + x.ln[A],
donnent une droite.
Page 8.
Ordre partiel négatif,
fractionnaire
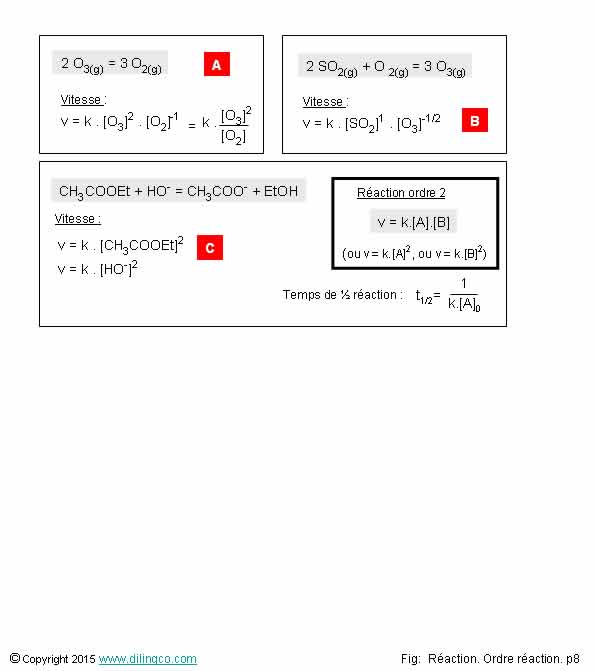
Sélectionner
l’affirmation exacte :
1- La vitesse
d’une réaction ne dépend jamais des produits
2- Ordre
partiel négatif : la vitesse de réaction diminue lorsque la concentration
du composé diminue
3- Un ordre partiel ne peut pas être fractionnaire et
négatif à la fois
4- [C].
Vitesse proportionnelle à la concentration au carré = ordre global 2
L’affirmation
4 est exacte.
Affirmation
1
Si
parfois.
L’exemple
[A], décomposition de l’ozone dans l’atmosphère, montre que la loi de vitesse d’une réaction peut dépendre aussi bien des réactifs que des produits.
L’expérimentation
permet de définir les lois de vitesses des réactions chimiques.
Affirmation
2
Non.
Ordre partiel négatif : la vitesse de réaction
diminue lorsque la concentration du composé
augmente.
Exemple
[A] :
La
vitesse de décomposition de l’ozone diminue lorsque la concentration en oxygène
augmente.
Note :
Les ordres partiels négatifs sont très souvent liés aux
produits d’une réaction chimique.
Affirmation
3
Si.
Exemple
[B] : Un ordre partiel peut être
fractionnaire et négatif à la fois.
Page 9.
Résumé. Ordres 0, 1, 2
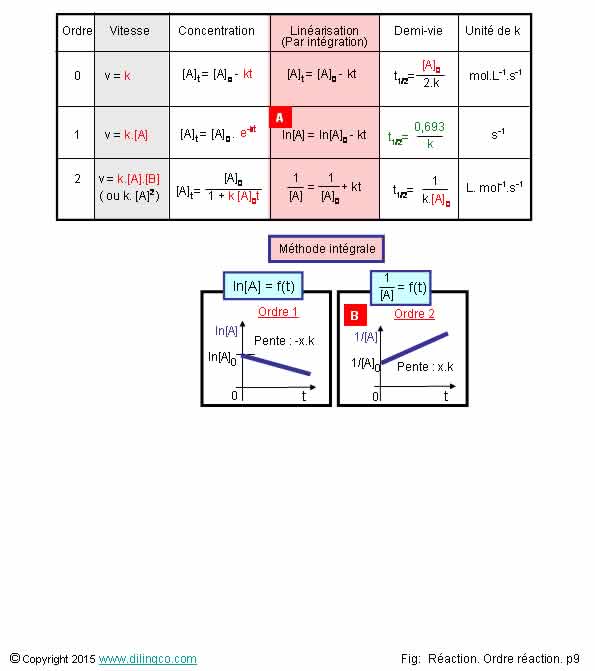
Sélectionner
l’affirmation exacte :
1- La
constante de vitesse a la même unité pour tous les ordres
2- Ordre
0 : Temps de demi-réaction indépendante de la concentration initiale
3- [A].
Méthode intégrale, les relevés successifs donnent une droite ln[A]=ln[A]0 – kt
4- [B]. Ordre
2 : Intégration des mesures successives = droite, axe des ordonnées :
ln[A]
L’affirmation
3 est exacte.
Affirmation
2
Non.
Ordre 1 : Demi-vie indépendante des concentrations.
Affirmation
4
Non.
[B]. Ordre 2 : Intégration des relevés
successives = droite, axe des ordonnées : 1/[A]
Page
10.
Résumé. Déterminer
l’ordre

Sélectionner
les deux affirmations exactes :
1- Temps
de demi-réaction indépendant de la concentration initiale = réaction
d’ordre 0
2- (Temps
de quart-réaction) = 3 (temps de demi-réaction) = réaction d’ordre 2
3- [A].
Réaction d’ordre 1
4- [B].
Le réactif B n’intervient pas dans la réaction chimique
5- [B].
Réaction d’ordre 1 : v=K.[A]
6- [C].
Vitesse de diminution de A, d[A]/dt = - 0,16 mol/L/s
Les
affirmations 1 et 6 sont exactes.
Affirmation
1
Non.
Temps de
demi-réaction indépendant de la concentration
initiale :
- réaction d’ordre 1,
- t1/2 =
ln2/k = 0,693/k
Affirmation
2
Oui.
Ordre
0 : t1/2 proportionnel à la concentration initiale.
Ordre
1 : t1/2 indépendant de la concentration initiale.
Ordre
2 : t1/2 inversement proportionnel à la concentration initiale.
Ordre 1 :
t1/4=2 t1/2
Ordre 2 :
t1/4=3 t1/2
Les réactions ordre 2 sont plus lentes que les réactions d’ordre 1.
Affirmation
3
Non.
[A].
Réaction d’ordre 2.
Entre les
mesures 1 et 3 :
-
Diminution de la concentration : 0,02/0,01 = 2
-
Diminution de la vitesse : 0,01/0,0025 = 4 = 22
La vitesse diminue du carré de la diminution de la
concentration : réaction d’ordre 2.
Affirmation
4
Non.
[B]. Le réactif
B n’intervient pas dans la cinétique
de la réaction chimique.
(Mais
bien évidemment dans la réaction de combinaison)
Le
réactif B est en excès de concentration, en dégénérescence d’ordre.
Affirmation
5
Non.
[B].
Expériences 1 et 2 : Pour un triplement de la concentration initiale de A,
la vitesse est multipliée par 9
(Variation de concentrations au carré, v=K.[A]2) :
= Réaction d’ordre 2.
Affirmation
6
Oui.
[C]. Expériences
1 et 3 : concentration de A quadruplée
Expériences
1 et 2 : réaction d’ordre 2
Réaction
d’ordre 2 : 42 = 16
2 Vitesse
de diminution de A, d[A]/dt = - 0,16 mol/L/s
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Ordre réactionnel

Sélectionner l’affirmation exacte :
1- Ordre réactionnel : influence d’un réactif dans la cinétique d’une réaction chimique
2- Toutes les réactions chimiques admettent un ordre réactionnel
3- La réalisation et la vitesse d’une réaction chimique dépendent toujours des concentrations de réactifs
4- La vitesse d’une réaction d’ordre 2 décroît à la même vitesse que la concentration du composé chimique d’ordre 2
L’affirmation 1 est exacte.
Affirmation 2
Non.
Les réactions chimiques n’admettent pas toujours un ordre.
Les vitesses réactionnelles ne peuvent pas toujours se réduire à des formules simples :
v=k, v=k.[C], v=k.[C]2, v=k.[C1][C2]
K :
- coefficient de vitesse (ou constante de vitesse),
- ne dépend pas des concentrations,
- dépend de la température (Exprimée en Kelvin),
- se calcule avec la loi d’Arrhenius.
Affirmation 3
Non.
La réalisation d’une réaction chimique dépend des réactifs, des énergies d’activation, des catalyseurs eventuels, …
La vitesse de réaction ne dépend pas toujours des réactifs.
Voir résumé ci-dessous.
Affirmation 4
Non.
La vitesse d’une réaction d’ordre 2 décroît beaucoup moins vite (k x concentration au carré) que la vitesse de disparition du réactif d’ordre 2.
Ordre 0 :
La vitesse de réaction ne dépend pas des concentrations des réactifs.
Elle est constante, égale à K, coefficient de vitesse, calculable par la loi d’Arrhenius.
Ordre 1 :
La vitesse de réaction est proportionnelle à la concentration d’un seul des réactifs ; réactif A, ou réactif B.
Mais pas aux deux (si tel était le cas, ce serait une réaction d’ordre 2)
Ordre 2 :
La vitesse de réaction est égale à :
V = K.[A]2, si le réactif A est d’ordre 2,
V = K.[A].[B], si les réactifs A et B sont tous deux d’ordre 1.
Page 2.
Ordre global. Ordre partiel

Sélectionner les deux affirmations exactes :
1- K, constante de vitesse, ne dépend pas de la température
2- Une réaction aA+bB=cC admet un ordre si l’expérience montre que v peut s’exprimer en fonction des concentrations des réactifs
3- Ordre 0 : La vitesse de réaction dépend de la concentration d’un réactif
4- Une réaction d’ordre global 2 peut être d’ordre partiel 2 pour un des réactifs et d’ordre partiel 0 pour l’autre, ou d’ordre 1 pour les 2 réactifs
5- Les ordres partiels sont égaux aux coefficients stœchiométriques
6- La vitesse d’une réaction chimique admettant un ordre >0 augmente au cours du temps
Les affirmations 2 et 4 sont exactes.
Affirmation 1
Si.
K, coefficient de vitesse :
- dépend de la température,
- est calculable par la loi d’Arrhenius.
Affirmation 2
Oui.
Une réaction aA+bB=cC admet un ordre (0, 1, 2, ..) si, par expérience, on voit que la vitesse peut s’exprimer en fonction des concentration des réactifs suivant un monôme v=k.[A]x. [B]y
Avec :
K : Constante de vitesse de réaction
x,y : ordres partiels des réactifs A et B
x+y : ordre global de la réaction.
Affirmation 3
Non.
Ordre 0 : La vitesse est constante, indépendante de la concentration d’un quelconque des réactif.
Affirmation 4
Oui.
Cas général : Les réactions d’ordre 2 sont proportionnelles aux concentrations des 2 réactifs. V=k [A].[B]
(Total des ordres partiels x+y =2)
Une réaction d’ordre global 2 peut être d’ordre partiel 2 pour un des réactifs ((proportionnel au carré de la concentration), d’ordre partiel 0 pour l’autre (insensible à la concentration).
Dans ce cas : V=k [A]2 (ou V=k [B]2)
Exemple :
NO2 + CO => NO+CO2
V=k.[NO2]2, vitesse indépendante de la concentration de CO.
NO, ordre partiel x=2
CO2, ordre partiel y=0
Ordre global X+y=2
Affirmation 5
Non.
Pas de lien entre les coefficients stœchiométriques et les ordres partiels.
Exemple :
Réaction : 2 NO + 2 H2 => 2H2O + N2
Coefficients stœchiométriques : 2 et 2
Vitesse : v = k. [NO]2 . [H2]1
Ordres partiels : 2 et 1
Ordre global de la réaction : 2 + 1 = 3
Notes :
- Les ordres partiels, et donc les ordres globaux, ne sont pas toujours des nombres entiers,
- Les ordres de réaction peuvent inclure des produits
Voir page « Exemples d’équations »
Affirmation 6
Non.
La vitesse d’une réaction chimique admettant un ordre supérieur à zéro :
- diminue au cours du temps (les concentrations en réactifs ne pouvant que diminuer,
- a sa valeur maximum en début de réaction.
Note :
Ordre 0 = vitesse constante, indépendante des concentrations.
Ordre 0
Variation de la concentration du réactif A en fonction du temps:
[A] = [A0] - kt
Variation de A : Droite de pente –k
Ordre 1
Variation de la concentration du réactif A en fonction du temps:
ln[A]/[A]0 = - kt
Variation de ln[A] : Droite de pente –k
Ordre 2
Variation de la concentration du réactif A en fonction du temps:
1/[A]-1/[A]0 = - kt
Variation de 1[A] : Droite de pente –k
Logarithme népérien
Fonction notée ln,
Définie sur ]0, et +[
>Primitive de 1/X qui s’annule en x = 1
(Dérivée de ln(x) = 1/x)
Formules indispensables
ln(x) = Y <----> x=ey
ln(ab) = ln(a)+ln(b)
ln(1/b) = -ln(b)
ln(a/b) = ln(a) – ln(b)
ln(an) = n ln(a)
ln(racine de a ) = ½ ln(a)
Page 3.
Unités de K, constante de vitesse

Sélectionner l’affirmation exacte :
1- L’unité de la constante de vitesse k, est la même pour tous les ordres réactionnels
2- K ne dépend pas de la température
3- [A]. Ordre 0 : K = v. Unité de K : moles par litre et par seconde
4- [B]. Ordre 1 : K en mole par secondes
L’affirmation 3 est exacte.
Affirmation 1
Non.
L’unité de la constante de vitesse k n’est pas la même d’un ordre réactionnel à l’autre.
Dans les exercices, l’unité de k est un indice pour trouver le numéro d’ordre d’une réaction chimique.
Affirmation 2
Si.
La constante de vitesse k (ou coefficient de vitesse), dépend de la température. K augmente avec la température.
Voir Loi d’Arrhenius.
Affirmation 3
Oui.
Si k = v, la constante de vitesse et la vitesse v ont la même unité.
Moles par litre et par seconde, mol.L-1.s
Affirmation 4
Non.
[B]. Ordre 1 : K en s-1
Page 4.
Temps de demi-réaction

Sélectionner les deux affirmations exactes :
1- Ordre 0 : Le temps de demi-réaction est proportionnel à la concentration initiale
2- Aucun ordre de réaction n’a un temps de demi-réaction indépendant de la concentration initiale
3- Ordre 1 : Le temps de demi-réaction est inversement proportionnel à la concentration initiale
4- [A]. D’après les mesures, le temps de demi-réaction est inversement proportionnel à la concentration initiale [A] = réaction d’ordre 2
5- [B] : Les réactions d’ordre 2 sont plus rapides que les réactions d’ordre 1
Les affirmations 1 et 4 sont exactes.
Ordre 0 : t de demi-réaction proportionnel à [A]0
Ordre 1 : t de demi-réaction indépendant de [A]0
Ordre 2 : t de demi-réaction inversement proportionnel à [A]0
Affirmation 2
Si.
L’ordre de réaction 1 a un temps de demi-réaction indépendant de la concentration initiale.
Affirmation 3
Non.
Ordre 1 : le temps de demi-réaction (ou de quart de réaction) est indépendant des concentrations initiales.
Ordre 2 : le temps de demi-réaction est inversement proportionnel à la concentration initiale.
Affirmation 4
Oui.
[A].
4 mesures successives avec 4 concentrations initiales de A différentes.
Les temps de ½ réaction obtenus sont inversement proportionnels aux concentrations initiales : réaction d’ordre 2.
Affirmation 5
Non.
[B].
Les réactions d’ordre 2 sont plus lentes que les réactions d’ordre 1.
t1/4 = 2 t/2 = réaction d’ordre 1.
t1/4 = 3 t/2 = réaction d’ordre 2.
Page 5.
Déterminer l’ordre. t1/2. V initiale

Sélectionner l’affirmation exacte :
1- Un réactif introduit en grand excès est le seul réactif à intervenir dans une réaction
2- [A]. Les méthodes supposent que la vitesse de réaction ne dépend que d’un réactif. Condition des expériences : être en dégénérescence d’ordre
3- [B]. Temps ¼ réaction = temps de ½ réaction multiplié par 2 = Ordre 2
4- [C]. Vitesse initiale est multipliée par 4 pour des concentrations initiales doublées : ordre partiel de la réaction = 4
L’affirmation 2 est exacte.
Affirmation 1
Non.
Un réactif introduit en grand excès :
- sa variation de concentration est négligeable lors de la réaction,
- son ordre partiel n’est à considérer, le réactif n’intervient plus dans l’ordre global de la réaction,
(On dit qu’il y a dégénérescence de l’ordre pour ce réactif très en excès)
- s’annuler dans les formules
Exemple : A en excès : v=k.[A]x.[B]y=k.[B]y
Mettre un réactif en grand excès de concentration, provoquer sa dégénérescence d’ordre (l’annuler dans la formule de vitesse), permet, par mesures successives, de déterminer l’ordre partiel des autres réactifs.
Affirmation 2
Oui.
[A]. Les méthodes présentées supposent que la vitesse de réaction ne dépend que d’un réactif.
Condition
des expériences pour y parvenir : être en
dégénérescence d’ordre.
Dégénérescence d’ordre pour tous les réactifs sauf celui dont on veut définir.
Par des prélèvements successifs et des comparaisons des résultats avec les
courbes habituelles, trouver l’ordre partiel.
Affirmation 3
Non.
[B]. Après avoir tracé la courbe v=ft, si :
- on trouve une courbe en décroissance exponentielle,
- et que
le temps de ¼ réaction = 2 fois le temps ½ réaction,
la réactif à un ordre 1.
Voir page précédente « Temps de
demi-réaction ».
Affirmation 4
Non.
[C].
Si la vitesse initiale est multipliée par 4 pour des concentration initiales doublées, l’ordre partiel = racine carré de 4 = 2.
Si la vitesse initiale est multipliée par 8 pour des concentration initiales doublées, l’ordre partiel = racine cubique de 8 = 3.
Si la vitesse initiale est multipliée par n …
Notes :
- Les ordres partiels peuvent être des nombres fractionnaires,
- k se déduit facilement si on connaît la vitesse initiale, la concentration initiale, l’ordre partiel.
Réaction d’ordre 0
La vitesse de réaction ne dépend pas des concentrations (initiales ou non).
Réaction d’ordre 1
Proportionnalité accroissement de vitesse - accroissement de concentration
Pour un accroissement d de la concentration initiale, la vitesse initiale augmente aussi de d.
Réaction d’ordre 2
Proportionnalité au carré.
Pour un accroissement d de la concentration initiale, la vitesse initiale augmente du carré de d.
Mesure des ordres partiels
Les ordres partiels (influencent ou non de la concentration d’un réactif), peuvent être connus pour une réaction chimique considérée, ou peuvent être déterminés expérimentalement.
Procédure :
- mettre un réactif en très grande concentration (en dégénérescence) pour que son % de consommation soit négligeable, [A]t = [A]0,
- mesurer par prélèvements l’influence de l’autre réactif pour déterminer l’action de sa concentration sur la vitesse de la réaction,
- en déduire son ordre partiel,
- procéder de manière inverse pour déterminer l’ordre partiel du premier réactif.
Page 6.
Méthode différentielle. Méthode intégrale

Sélectionner les deux affirmations exactes :
1- Ordre 0 : la vitesse de réaction est nulle
2- [A]. Différentiation des courbes "Concentration/temps" = courbes "Vitesse/temps"
3- [A]. Méthode différentielle, ordres partiels 1 & 2. Dans les 2 cas, ln(v) fonction ln(concentration) = droite de pente k
4- [B]. Méthode intégrale, réaction d’ordre 1 : ln [Concentration] par rapport à t est une exponentielle décroissante
5- [B]. Méthode intégrale, réaction d’ordre 2 : ln [Concentration] par rapport à t est linéaire
Les affirmations 2 et 3 sont exactes.
Affirmation 1
Non.
Ordre 0 : la vitesse de réaction est constante : v = a.k
a = coefficient stœchiométrique
(Égal ou différent de 1 dans l’équation chimique considérée)
Affirmation 3
Oui.
[A]. Méthode différentielle, ordres partiels 1 & 2. Dans les 2 cas, ln(v) fonction ln(concentration) = droite de pente k
Affirmation 4
Non.
[B]. Réaction d’ordre 1 : ln [Concentration] par rapport à t est linéaire.
Affirmation 5
Non.
[B]. Réaction d’ordre 2 : 1/[Concentration] par rapport à t est linéaire.
Méthode différentielle
La méthode différentielle peut être utilisée si on a la concentration [A] en fonction de t.
- Tracer la courbe [A] f (t),
- Trouver la vitesse volumique de disparition du réactif A,
- Pour les réactions admettant un ordre on a v=k.[A]x,
- Trouver si la loi de vitesse peut être linéarisée ln(v) = ln (k) + x.ln[A],
- Si on trouve une droite, la pente donne l’ordre partiel.
Méthode intégrale
On essaie de trouver si :
- ln[A] f(t) est une droite.
Oui : la réaction admet un ordre. Ordre 1.
Pente de la droite : - a.x.k
- 1/[A] f(t) est une droite.
Oui : la réaction admet un ordre. Ordre 2.
Pente de la droite : a.x.k
Page 7.
Exemples de relevés expérimentaux

Sélectionner l’affirmation exacte :
1- Si les relevés expérimentaux peuvent être linéarisés par la méthode différentielle = ordre 1
2- L’intégration des relevés expérimentaux ne permet pas de faire la différence entre un ordre 1 ou un ordre 2
3- [A] : ordre partiel 2
L’affirmation 3 est exacte.
Affirmation 1
Non.
Figure (1) : Dans les 2 cas, ordre 1 et ordre 2, les relevés expérimentaux, portés à ln(v) = ln(k) + x.ln[A], donnent une droite.
Page 8.
Ordre partiel négatif, fractionnaire

Sélectionner l’affirmation exacte :
1- La vitesse d’une réaction ne dépend jamais des produits
2- Ordre partiel négatif : la vitesse de réaction diminue lorsque la concentration du composé diminue
3- Un ordre partiel ne peut pas être fractionnaire et négatif à la fois
4- [C]. Vitesse proportionnelle à la concentration au carré = ordre global 2
L’affirmation 4 est exacte.
Affirmation 1
Si parfois.
L’exemple [A], décomposition de l’ozone dans l’atmosphère, montre que la loi de vitesse d’une réaction peut dépendre aussi bien des réactifs que des produits.
L’expérimentation permet de définir les lois de vitesses des réactions chimiques.
Affirmation 2
Non.
Ordre partiel négatif : la vitesse de réaction diminue lorsque la concentration du composé augmente.
Exemple [A] :
La vitesse de décomposition de l’ozone diminue lorsque la concentration en oxygène augmente.
Note :
Les ordres partiels négatifs sont très souvent liés aux produits d’une réaction chimique.
Affirmation 3
Si.
Exemple [B] : Un ordre partiel peut être fractionnaire et négatif à la fois.
Page 9.
Résumé. Ordres 0, 1, 2

Sélectionner l’affirmation exacte :
1- La constante de vitesse a la même unité pour tous les ordres
2- Ordre 0 : Temps de demi-réaction indépendante de la concentration initiale
3- [A]. Méthode intégrale, les relevés successifs donnent une droite ln[A]=ln[A]0 – kt
4- [B]. Ordre 2 : Intégration des mesures successives = droite, axe des ordonnées : ln[A]
L’affirmation 3 est exacte.
Affirmation 2
Non.
Ordre 1 : Demi-vie indépendante des concentrations.
Affirmation 4
Non.
[B]. Ordre 2 : Intégration des relevés successives = droite, axe des ordonnées : 1/[A]
Page 10.
Résumé. Déterminer l’ordre

Sélectionner les deux affirmations exactes :
1- Temps de demi-réaction indépendant de la concentration initiale = réaction d’ordre 0
2- (Temps de quart-réaction) = 3 (temps de demi-réaction) = réaction d’ordre 2
3- [A]. Réaction d’ordre 1
4- [B]. Le réactif B n’intervient pas dans la réaction chimique
5- [B]. Réaction d’ordre 1 : v=K.[A]
6- [C]. Vitesse de diminution de A, d[A]/dt = - 0,16 mol/L/s
Les affirmations 1 et 6 sont exactes.
Affirmation 1
Non.
Temps de demi-réaction indépendant de la concentration initiale :
- réaction d’ordre 1,
- t1/2 = ln2/k = 0,693/k
Affirmation 2
Oui.
Ordre 0 : t1/2 proportionnel à la concentration initiale.
Ordre 1 : t1/2 indépendant de la concentration initiale.
Ordre 2 : t1/2 inversement proportionnel à la concentration initiale.
Ordre 1 : t1/4=2 t1/2
Ordre 2 : t1/4=3 t1/2
Les réactions ordre 2 sont plus lentes que les réactions d’ordre 1.
Affirmation 3
Non.
[A]. Réaction d’ordre 2.
Entre les mesures 1 et 3 :
- Diminution de la concentration : 0,02/0,01 = 2
- Diminution de la vitesse : 0,01/0,0025 = 4 = 22
La vitesse diminue du carré de la diminution de la concentration : réaction d’ordre 2.
Affirmation 4
Non.
[B]. Le réactif B n’intervient pas dans la cinétique de la réaction chimique.
(Mais bien évidemment dans la réaction de combinaison)
Le réactif B est en excès de concentration, en dégénérescence d’ordre.
Affirmation 5
Non.
[B]. Expériences 1 et 2 : Pour un triplement de la concentration initiale de A, la vitesse est multipliée par 9
(Variation de concentrations au carré, v=K.[A]2) :
= Réaction d’ordre 2.
Affirmation 6
Oui.
[C]. Expériences 1 et 3 : concentration de A quadruplée
Expériences 1 et 2 : réaction d’ordre 2
Réaction d’ordre 2 : 42 = 16
2 Vitesse de diminution de A, d[A]/dt = - 0,16 mol/L/s