Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Réaction chimique.
Rappels
Lors d’une réaction chimique …
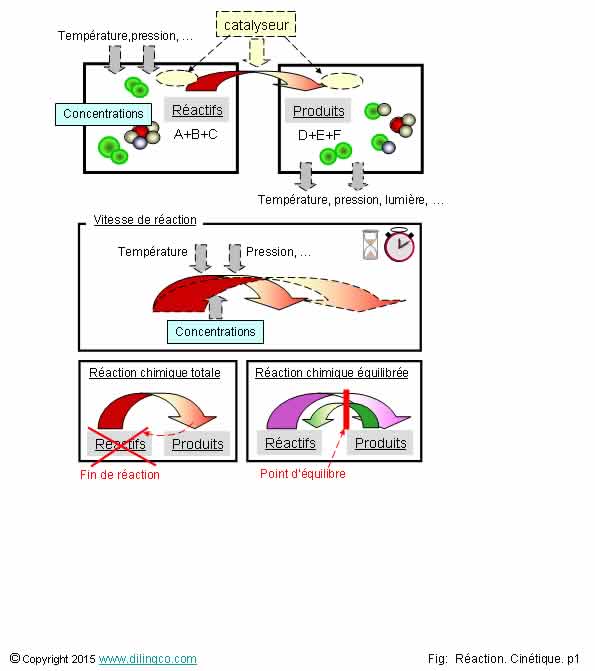
Sélectionner
les deux affirmations exactes :
1- Si un
catalyseur est nécessaire, la quantité finale de catalyseur est égale à sa
quantité initiale
2- Une
réaction chimique peut nécessiter un apport d’énergie mais jamais dégager de
l’énergie
3- Toutes
les réactions chimiques sont des réactions totales (Plus de réactifs en fin de
réaction)
4- La
température, la concentration des réactifs sont des facteurs qui agissent sur
la cinétique d’une réaction
5- La
formation de la rouille est une réaction d’oxydoréduction plus rapide que la
combustion du méthane
Les
affirmations 1 et 4 sont exactes.
Affirmation
1
Non.
Une
réaction chimique qui dégage de l’énergie est dite « exothermique ».
Une combustion est une réaction chimique exothermique d’oxydoréduction.
Une
réaction chimique qui nécessite un apport d’énergie
est dite
« endothermique ».
L’énergie
peut être de la chaleur et/ou de la lumière.
La thermochimie est l’étude énergétique
des systèmes chimiques.
Affirmation
4
Oui.
Température :
Elever la température des réactifs peut déclencher et accroître la
vitesse d’une
réaction chimique.
Exemple :
cuissons des aliments.
Abaisser la température peut stopper ou diminuer la vitesse d’une réaction chimique.
Exemple :
conservation des aliments par le froid. Trempe des matériaux.
Concentration :
La
concentration des réactifs est aussi un élément qui joue sur la cinétique d’une
réaction.
Exemple :
diluer les réactifs pour stopper ou ralentir une réaction.
En général, plus les concentrations en réactifs sont grandes, plus
la vitesse de réaction est élevée.
Affirmation
5
Non.
C’est
l’inverse :
La formation de la rouille est une réaction d’oxydoréduction lente.
La combustion du méthane est une réaction d’oxydoréduction rapide.
Page 2.
Mécanisme réactionnel
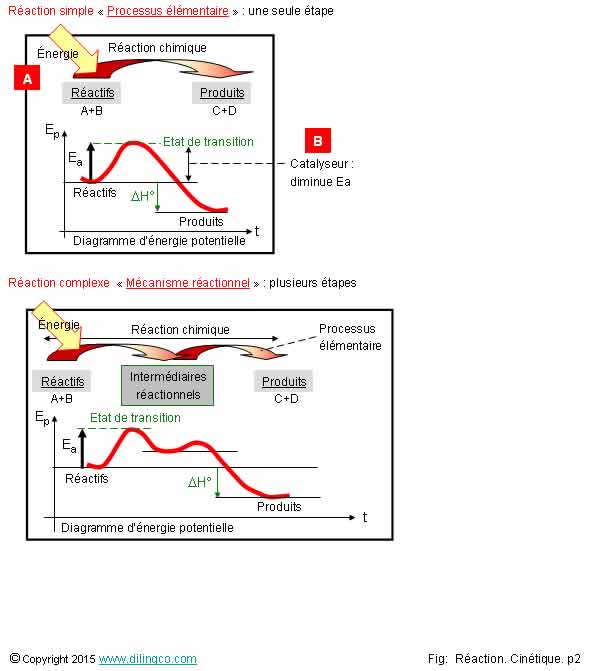
Sélectionner
les deux affirmations exactes :
1- Les
intermédiaires de réaction sont des molécules ou ions stables, produits de
réactions chimiques
2- Carbanions,
carbocations : intermédiaires de réaction en chimie minérale
3-
[A] : L’énergie à fournir doit être supérieure à l’énergie d’activation
pour démarrer la réaction chimique
4-
[B] : Un catalyseur augmente la valeur de l’énergie d’activation
5- Les
réactions chimiques à plus de 3 réactifs sont des mécanismes réactionnels
Les affirmations
3 et 5 sont exactes.
Mécanisme réactionnel : enchaînement d’étapes élémentaires lors d’une réaction chimique.
Affirmation
1
Non.
Les intermédiaires de réaction sont des ions ou
des molécules très instables, de courtes durées de vie, qui apparaissent
temporairement au cours d’une réaction chimique complexe.
Les intermédiaires de réaction ne sont pas des produits de réactions chimiques. Ils ne
sont pas présents en fin de réaction.
Exemples d’intermédiaires de
réaction en chimie organique :
- Les
carbocations, cations (charge positive
qui les rend instables).
- Les carbanions, anions (charge négative qui les rend
instables).
Voir Carbo
anion & cation
- Les radicaux
libres.
Rappels :
Les
radicaux libres peuvent être dus à une rupture homolytique d’une liaison
covalente.
Homolytique : partage symétrique des électrons du doublet rompu.
Hétérolytique :
partage non symétrique
Affirmation
2
Non.
Carbanions,
carbocations : Carbone => chimie organique
Affirmation
3
Oui.
Energie :
chaleur, lumière, …
Enthalpie
standard de réaction DH°, voir
Thermodynamique
Affirmation
5
Oui.
Du fait de l’improbabilité des chocs momentanés de plusieurs réactifs, dans les
conditions demandées par les coefficients stœchiométriques de l’équation, les réactions chimiques à plus de trois réactifs se
déroulent par étapes ; Ce sont des mécanismes
réactionnels.
Exemple :
A
+ 5 B +8 C => D + 5 E + 12 F
La
probabilité de rencontre des éléments chimiques A, B, C, dans les proportions
indiquées par les coefficients stœchiométriques 1, 5 8 est très faible.
Rappels :
- coefficients
stœchiométriques 1, 5, 8, 1, 5, 12 sont les quantités de A, B, C, D, E, F
de la formule chimique.
- Molécularité : nombre d’espèces chimiques qui participent
à une réaction élémentaire.
Décomposition
d’une molécule : molécularité = 1.
La
plupart des réactions élémentaires (en une seule étape) sont bi moléculaires.
- Espèces
chimiques : molécules, ions, …
Page 3.
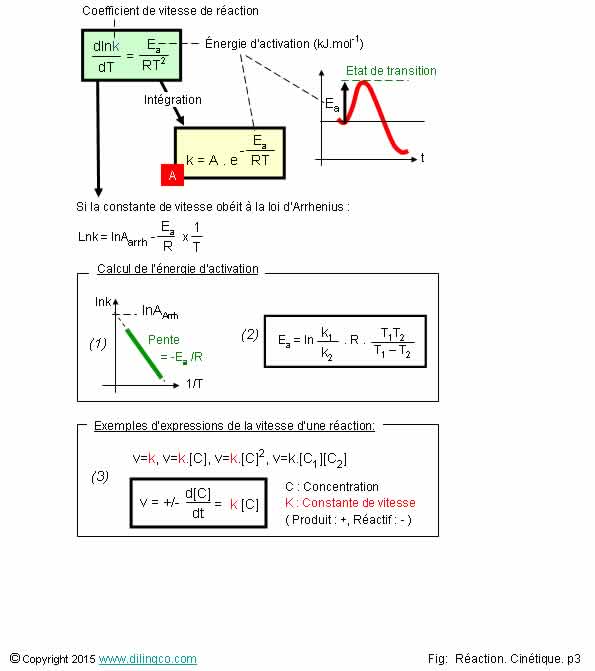
Loi d’Arrhenius. K & Ea
Sélectionner
l’affirmation exacte :
1- Toutes
les réactions chimiques suivent la loi d’Arrhenius (Variation de la vitesse en
fonction de la température)
2- Les
réactions qui ont les énergies d’activation les plus faibles sont les plus
rapides
3- La loi
d’Arrhenius ne permet pas de calculer l’énergie d’activation d’une réaction
4-
Lorsque la température augmente, la constante de vitesse k diminue
L’affirmation
2 est exacte.
Affirmation
1
Non.
La loi
d’Arrhenius :
- est une
loi empirique,
- suivie
par un grand nombre de réactions chimiques,
(Mais pas
toutes. Pas par les réactions enzymatiques)
- dérivée du logarithme népérien de la constante de vitesse
par rapport à la température = énergie d’activation / RT2
Avec :
A :
constante d’Arrhenius
R :
Constante des gaz parfaits (8,314 J.mol-1.K-1)
T :
Température absolue (en K)
Affirmation
2
Oui.
La loi
d’Arrhenius montre que :
- l’énergie
d’activation à une importance prépondérante sur la vitesse de réaction,
- les énergies d’activation les plus faibles sont les plus
rapides (et inversement)
Affirmation
3
Si.
La loi
d’Arrhenius permet de calculer l’énergie d’activation d’une réaction
connaissant des températures.
Tracer
la droite Figure
(1)
Si on a
un tableau de résultats expérimentaux « Températures/constante
de vitesse k », pour chaque point :
-
calculer lnK,
-
calculer 1/T,
- tracer
la droite lnK fonction de 1/T
= la pente/R = énergie d’activation.
Utiliser
la formule Figure
(2)
Pendre le
logarithme népérien du rapport K1, K2 pour 2 températures différentes.
Figure
(2)
Affirmation
4.
Non.
Lorsque
la température augmente, k, coefficient
de vitesse de réaction augmentent.
K = f T
Voir la
formule [A] de k (Exponentielle –Ea/RT)
Figure (3) :
Les
vitesses des réactions chimiques ne peuvent pas toutes s’exprimer sous formes
simples : v=k, v=k.[C], v=k.[C]2,
v=k.[C1][C2]
Page 4.
Vitesse d’une réaction
chimique
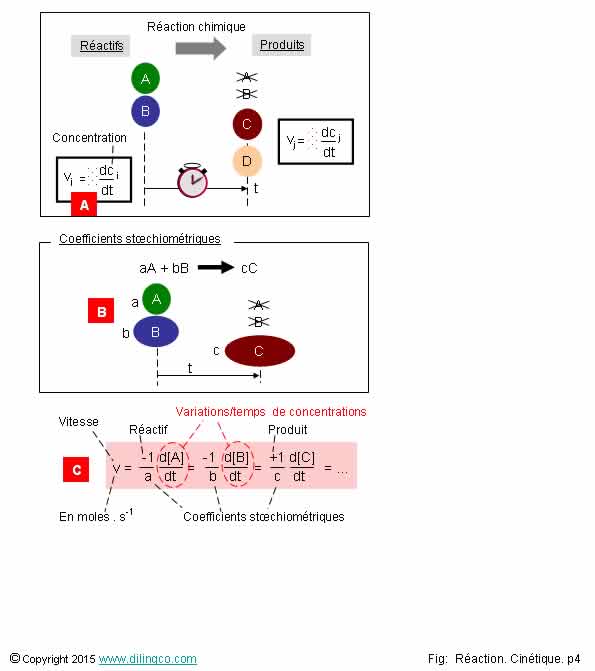
Sélectionner
les deux affirmations exactes :
1- La
vitesse d’une réaction chimique ne dépend que des concentrations
2- Toutes
les réactions chimiques ont les mêmes vitesses de réaction
3- [A].
La vitesse volumique de disparition d’un réactif est positive
4- [B]. Coefficient
stoechiométrique b supérieur à celui du réactif A : la vitesse volumique de disparition
de B est inférieure à la vitesse de disparition de A
5- [C]. La
vitesse d’une réaction est inversement proportionnelle aux coefficients
stœchiométriques
6- [C] :
Tous les composés d’une réaction permettent de calculer la vitesse de réaction
Les affirmations
5 et 6 sont exactes.
Cinétique chimique = étude de la vitesse des
réactions chimiques
Vitesse d’une réaction chimique = variation des concentrations
en fonction du temps.
Vitesse volumique = Variation dans le temps des concentrations par
unité de volume.
Affirmation
1
Non.
La
vitesse d’une réaction chimique dépend de facteurs tels que :
-
concentrations des réactifs,
-
température,
(La
vitesse des réactions chimiques augmente avec la température)
-
catalyseur éventuel,
-
solvant, …
Affirmations
2
Non.
Certaines
réactions chimiques sont très rapides,
comme les réactions acide-base.
Certaines
réactions de combustion peuvent être explosives.
D’autres réactions chimiques peuvent être très
lentes, oxydation des métaux, et prendre des années : réaction
de H2O sur les minéraux.
Affirmation
3
Non.
[A].
La
vitesse volumique de disparition d’un réactif est
négative.
La
vitesse volumique d’apparition d’un produit est
positive.
Affirmation
4
Non.
[B]. Si
les éléments chimiques A et B sont dans les proportions stoechiométriques, ils
disparaissent dans le même temps t.
Pour une
même temps de réaction, la vitesse de disparition de B, présent en
concentration supérieure, est plus rapide que celle de A.
Affirmation
5
Oui.
[C].
La vitesse de réaction est inversement proportionnelle
aux coefficients stœchiométriques des
éléments de l’équation chimique.
Le signe
négatif indique une diminution de la concentration (pour les réactifs), le
signe positif indique une augmentation de la concentration (pour les produits).
Affirmation
6
Oui.
[C].
Même vitesse v de réaction.
Vitesses volumiques de chaque composé différentes
(Mais
proportionnelles, au signe, et à l’inverse des coefficients stœchiométriques
près).
Page 5
Vitesses constantes &
vitesses variables
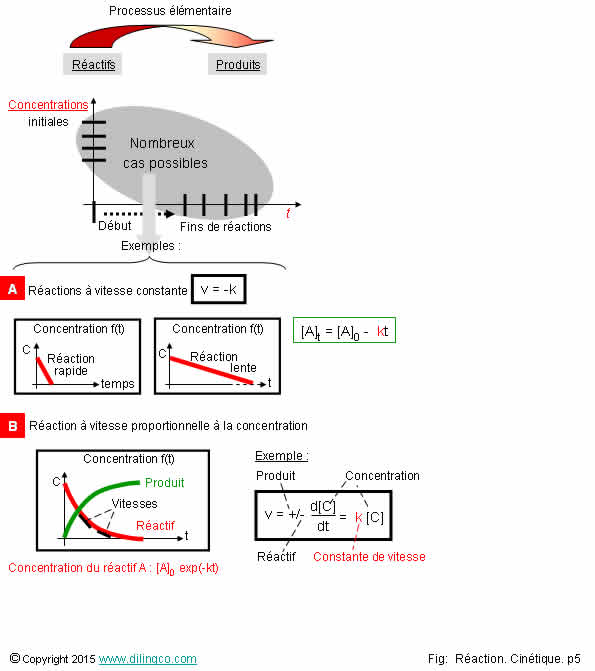
Sélectionner
l’affirmation exacte :
1- [A]. Exemples
de réactions chimiques à vitesses décroissantes
2- [A]. La pente de la droite concentration/temps ne dépend pas du coefficient stœchiométrique
du composé chimique
3- [B]. Dans
cet exemple, la vitesse instantanée de la réaction varie en fonction de la
concentration
4- [B].
Quand la concentration diminue, la vitesse augmente
L’affirmation
3 est exacte.
Vitesse = dérivée de la fonction = pente de la courbe
Concentration = intégrale de la fonction = aire
sous la courbe
Affirmation
1
Non.
[A]. Exemples
de réactions à vitesses constantes.
La vitesse de disparition des réactifs est constante.
Vitesse = pente droite = -k
La
vitesse d’évolution de la concentration ne dépend pas de la concentration. Elle
est la même du début à la fin de la réaction.
La
réaction rapide a une pente (une vitesse de réaction, une constante de réaction),
plus importante que celle de la réaction lente.
Affirmation
2
Non.
[A].
Exemple :
1A + 2B
La diminution
de concentration du réactif B est 2 fois plus rapide que la diminution de
concentration du réactif A.
Pour que
la réaction soit complète, qu’il ne manque pas de réactif B, il faut que les composés soient au départ dans les proportions
stœchiométriques, 2 fois plus de moles B que de moles A.
Si tel
n’est pas le cas, il reste un réactif en fin de réaction.
Le
réactif en insuffisance pour que la réaction soit complète est dit réactif limitant.
Affirmation
3
Oui.
[B] :
Dans ces exemples, la vitesse de réaction décroît en fonction de
la concentration du réactif.
Pour le
réactif A, la vitesse correspond à la pente de la droite :
v=- 1/a d[A]/dt
(a est le
coefficient stœchiométriques assigné au réactif dans l’équation)
L’intégration
de la vitesse donne les courbes d’évolution de la concentration présentées.
ln
[A] = ln [A]0 – akt
[A] = [A]0 exp(-akt)
(a est le
coefficient stœchiométriques assigné au réactif dans l’équation)
Affirmation
4
Non.
[B].
Proportionnalité vitesse-concentration : Quand la concentration diminue,
la vitesse diminue.
Notes :
K,
coefficient de vitesse, dépend de la température.
Les
vitesses des réactions chimiques ne peuvent pas toutes s’exprimer sous formes
simples : v=k, v=k.[C], v=k.[C]2, v=k.[C1][C2]
Page 6
Avancement d’une
réaction
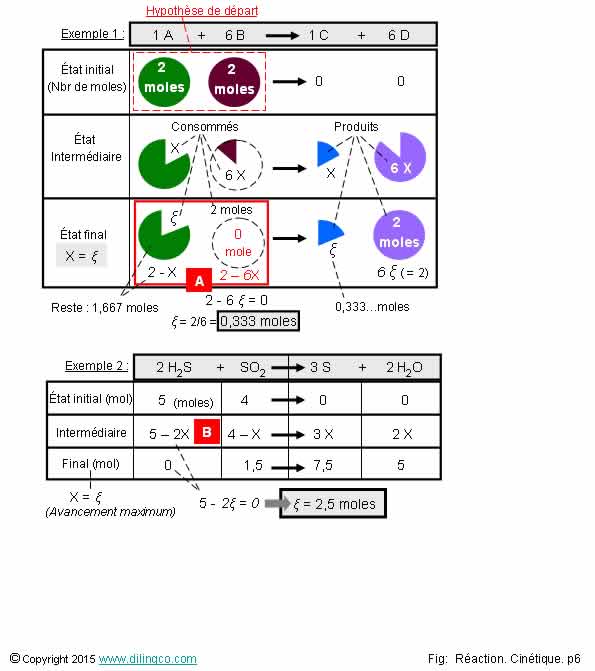
Sélectionner
les deux affirmations exactes :
1-
L’avancement maximal d’une réaction chimique : lorsque tous les réactifs
ont disparu
2- [A].
L’avancement a pour valeur le plus petit nombre qui annule l’un des nombres de
moles de réactifs
3- [A].
2-X=0 ; 2-6X=0 ; l’avancement maximal de la réaction est de 2 moles
4- [B].
5-1X et 4-2
5-
L’avancement (ou lettre grecque « Ksi »), s’exprime en moles. Il a la
même valeur pour toutes les molécules de la réaction chimique
6-
Exemple 2 : le réactif limitant est le dioxyde de soufre
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Non.
L’avancement maximal d’une réaction chimique : lorsque l’un au moins des réactifs a disparu.
Affirmation
3
Non.
[A] :
2-X=0 =>
X =2
2-6X=0
=> X=2/6=0 => X=0,3333… moles.
L’avancement
maximal a pour valeur le plus petit nombre qui annule l’un des nombres de moles
de réactifs.
L’avancement
maximal de la réaction présentée, noté ξ
(Ksi) = 0,333 moles
Affirmation
4
Non.
[B]. 5-2X
et 4-1X
5 moles au départ – 2X moles de H2S qui ont déjà réagi.
(2 est le
coefficient stoechiométrique de H2S dans la réaction)
4 moles
au départ – 1X moles de SO2 qui ont déjà réagi.
Affirmation
5
Oui.
Lettre
grecque « Ksi » : ξ.
Exemple
1 de la figure : avancement ξ = 0,333moles.
Exemple
2 de la figure : avancement ξ = 2,5 moles.
Affirmation
6
Non.
Exemple
2 : le réactif limitant est le sulfure d’hydrogène H2S.
Réactif limitant : réactif qui, ayant totalement disparu,
provoque l’arrêt de la réaction.
Il n’y a
pas de réactif limitant si tous les réactifs sont dans les proportions
stœchiométriques.
Page 7
Avancement relatif
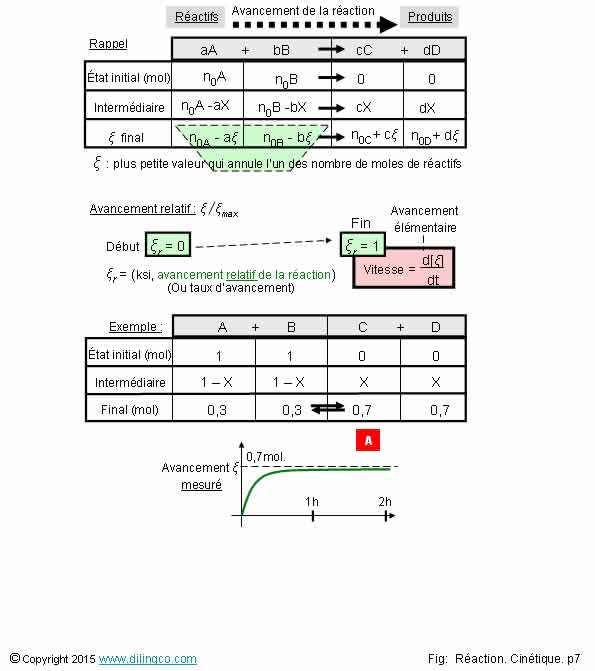
Sélectionner
les deux affirmations exactes :
1- État
final : Le taux relatif d’avancement d’une réaction chimique totale = 1
2- La
valeur de l’avancement de réaction dépend de la substance, réactif ou produit,
utilisée pour la calculer
3- [A].
L’avancement de réaction mesuré, 0,7 moles, correspond à l’avancement attendu
4- [A].
La vitesse de réaction est constante
5- [A].
Le taux d’avancement final mesuré, 70% = réaction chimique équilibrée (non
totale)
6- Le déclenchement
d’une réaction et la vitesse d’une réaction ne dépendent que des réactifs
impliqués
Les
affirmations 1 et 5 sont exactes.
Affirmation
1
Oui.
[A].
Le taux d’avancement :
- nombre
de mole réaction en cours / nombre de moles en final d’une réaction totale,
- est un rapport, grandeur sans unité,
- Le taux maximal d’avancement d’une réaction totale
= 1,
- Si le
taux d’avancement reste < 1 : réaction
chimique en équilibre.
Affirmation
2
Non.
La valeur
de l’avancement de réaction ξ ne dépend pas de la substance
utilisée pour la calculer.
Les concentrations sont divisées par les coefficients stœchiométriques
respectifs.
Affirmation
3
Non.
[A].
Avancement
de réaction maximum mesuré = 0,7 moles
Avancement
de réaction maximum prévu = 1 mole
Affirmation
4
Non.
[A]. La
vitesse de réaction est la pente de la courbe obtenue par mesure. Cette pente
n’est pas constante.
La
réaction est plus rapide en début, mais globalement c’est un exemple de
réaction chimique lente : l’échelle des temps est en heures.
Vitesse
d’une réaction = d[ξ ]/dt = d[Avancement de la réaction]/dt
Affirmation
5
Oui.
[A]. Le
taux d’avancement final mesuré, 70% = réaction
chimique équilibrée (non totale)
Une réaction totale est caractérisée par un taux final
d’avancement = 1.
À l’équilibre,
on ne détecte pas de variation des concentrations : l’équation est,
macroscopiquement, à l’équilibre.
Dans le
détail, à l’échelle microscopique, la réaction (réactifs => produits) est
annulée par une réaction inverse (produits => réactifs) ; il y a un
équilibre dynamique qui n’affecte pas les quantités de substances.
Affirmation
6
Non
Le déclenchement d’une réaction, la vitesse d’une réaction, dépendent de
facteurs d’environnement :
- la
température peut être augmentée pour déclencher ou augmenter la vitesse d’une
réaction,
- un
catalyseur peut être nécessaire pour déclencher ou augmenter la vitesse d’une
réaction.
Rappels :
Unité
de masse atomique
Unité de masse
unifiée
L’unité de
référence de la masse atomique, 1u, a été choisie
comme étant le douzième de la masse d’un atome
carbone 12
(Le carbone 12 est un isotope courant du carbone)
1u= 1/12
de la masse carbonne12 = 1, 66… x 10-27 kg
Une
unité = 1,66… x 10-27 kg
Exemples
de masse atomique :
La masse atomique du carbone12 est de 1 u.
La masse
atomique du fer est 55,845 u.
(Le fer est plus de 55 fois plus lourd que le carbone)
Le
Dalton
En
biochimie, le Dalton, symbole Da, est aussi utilisé.
1 Da = 1/12 de la masse d’un atome de carbone
1 Da = 1u
1 Da = approximativement la masse d’un atome d’hydrogène.
En
pratique, on utilise le Kilo Da.
La
mole
- La mole est une unité de comptage,
- Utilisée pour compter les nombres très importants d’éléments,
(Pour
éviter les « 10 puissances n »)
- Symbole
mol,
- 1 mol =
6,023 x 1023 , entités
6,023 x 1023 , est
appelé le nombre d’Avogadro.
La référence du nombre d’Avogadro est le nombre d’atomes contenu dans 12
grammes de carbone 12.
La quantité de matière n
d’un élément microscopique, exprimées en moles,
est donc le nombre d’éléments divisé par le nombre d’Avogadro:
n = N
/ Na
Voir aussi
Masse molaire
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Réaction chimique. Rappels
Lors d’une réaction chimique …

Sélectionner les deux affirmations exactes :
1- Si un catalyseur est nécessaire, la quantité finale de catalyseur est égale à sa quantité initiale
2- Une réaction chimique peut nécessiter un apport d’énergie mais jamais dégager de l’énergie
3- Toutes les réactions chimiques sont des réactions totales (Plus de réactifs en fin de réaction)
4- La température, la concentration des réactifs sont des facteurs qui agissent sur la cinétique d’une réaction
5- La formation de la rouille est une réaction d’oxydoréduction plus rapide que la combustion du méthane
Les affirmations 1 et 4 sont exactes.
Affirmation 1
Non.
Une
réaction chimique qui dégage de l’énergie est dite « exothermique ».
Une combustion est une réaction chimique exothermique d’oxydoréduction.
Une réaction chimique qui nécessite un apport d’énergie est dite « endothermique ».
L’énergie
peut être de la chaleur et/ou de la lumière.
La thermochimie est l’étude énergétique
des systèmes chimiques.
Affirmation 4
Oui.
Température :
Elever la température des réactifs peut déclencher et accroître la vitesse d’une réaction chimique.
Exemple : cuissons des aliments.
Abaisser la température peut stopper ou diminuer la vitesse d’une réaction chimique.
Exemple : conservation des aliments par le froid. Trempe des matériaux.
Concentration :
La concentration des réactifs est aussi un élément qui joue sur la cinétique d’une réaction.
Exemple : diluer les réactifs pour stopper ou ralentir une réaction.
En général, plus les concentrations en réactifs sont grandes, plus la vitesse de réaction est élevée.
Affirmation 5
Non.
C’est l’inverse :
La formation de la rouille est une réaction d’oxydoréduction lente.
La combustion du méthane est une réaction d’oxydoréduction rapide.
Page 2.
Mécanisme réactionnel

Sélectionner les deux affirmations exactes :
1- Les intermédiaires de réaction sont des molécules ou ions stables, produits de réactions chimiques
2- Carbanions, carbocations : intermédiaires de réaction en chimie minérale
3- [A] : L’énergie à fournir doit être supérieure à l’énergie d’activation pour démarrer la réaction chimique
4- [B] : Un catalyseur augmente la valeur de l’énergie d’activation
5- Les réactions chimiques à plus de 3 réactifs sont des mécanismes réactionnels
Les affirmations 3 et 5 sont exactes.
Mécanisme réactionnel : enchaînement d’étapes élémentaires lors d’une réaction chimique.
Affirmation 1
Non.
Les intermédiaires de réaction sont des ions ou des molécules très instables, de courtes durées de vie, qui apparaissent temporairement au cours d’une réaction chimique complexe.
Les intermédiaires de réaction ne sont pas des produits de réactions chimiques. Ils ne sont pas présents en fin de réaction.
Exemples d’intermédiaires de réaction en chimie organique :
- Les carbocations, cations (charge positive qui les rend instables).
- Les carbanions, anions (charge négative qui les rend instables).
Voir Carbo anion & cation
- Les radicaux libres.
Rappels :
Les radicaux libres peuvent être dus à une rupture homolytique d’une liaison covalente.
Homolytique : partage symétrique des électrons du doublet rompu.
Hétérolytique : partage non symétrique
Affirmation 2
Non.
Carbanions, carbocations : Carbone => chimie organique
Affirmation 3
Oui.
Energie : chaleur, lumière, …
Enthalpie standard de réaction DH°, voir Thermodynamique
Affirmation 5
Oui.
Du fait de l’improbabilité des chocs momentanés de plusieurs réactifs, dans les
conditions demandées par les coefficients stœchiométriques de l’équation, les réactions chimiques à plus de trois réactifs se
déroulent par étapes ; Ce sont des mécanismes
réactionnels.
Exemple :
A + 5 B +8 C => D + 5 E + 12 F
La probabilité de rencontre des éléments chimiques A, B, C, dans les proportions indiquées par les coefficients stœchiométriques 1, 5 8 est très faible.
Rappels :
- coefficients stœchiométriques 1, 5, 8, 1, 5, 12 sont les quantités de A, B, C, D, E, F de la formule chimique.
- Molécularité : nombre d’espèces chimiques qui participent à une réaction élémentaire.
Décomposition d’une molécule : molécularité = 1.
La plupart des réactions élémentaires (en une seule étape) sont bi moléculaires.
- Espèces chimiques : molécules, ions, …
Page 3.
Loi d’Arrhenius. K & Ea

Sélectionner l’affirmation exacte :
1- Toutes les réactions chimiques suivent la loi d’Arrhenius (Variation de la vitesse en fonction de la température)
2- Les réactions qui ont les énergies d’activation les plus faibles sont les plus rapides
3- La loi d’Arrhenius ne permet pas de calculer l’énergie d’activation d’une réaction
4- Lorsque la température augmente, la constante de vitesse k diminue
L’affirmation 2 est exacte.
Affirmation 1
Non.
La loi d’Arrhenius :
- est une loi empirique,
- suivie par un grand nombre de réactions chimiques,
(Mais pas toutes. Pas par les réactions enzymatiques)
- dérivée du logarithme népérien de la constante de vitesse par rapport à la température = énergie d’activation / RT2
Avec :
A : constante d’Arrhenius
R : Constante des gaz parfaits (8,314 J.mol-1.K-1)
T : Température absolue (en K)
Affirmation 2
Oui.
La loi d’Arrhenius montre que :
- l’énergie d’activation à une importance prépondérante sur la vitesse de réaction,
- les énergies d’activation les plus faibles sont les plus rapides (et inversement)
Affirmation 3
Si.
La loi d’Arrhenius permet de calculer l’énergie d’activation d’une réaction connaissant des températures.
Tracer la droite Figure (1)
Si on a un tableau de résultats expérimentaux « Températures/constante de vitesse k », pour chaque point :
- calculer lnK,
- calculer 1/T,
- tracer la droite lnK fonction de 1/T
= la pente/R = énergie d’activation.
Utiliser la formule Figure (2)
Pendre le logarithme népérien du rapport K1, K2 pour 2 températures différentes.
Figure (2)
Affirmation 4.
Non.
Lorsque la température augmente, k, coefficient de vitesse de réaction augmentent.
K = f T
Voir la formule [A] de k (Exponentielle –Ea/RT)
Figure (3) :
Les vitesses des réactions chimiques ne peuvent pas toutes s’exprimer sous formes simples : v=k, v=k.[C], v=k.[C]2, v=k.[C1][C2]
Page 4.
Vitesse d’une réaction chimique

Sélectionner les deux affirmations exactes :
1- La vitesse d’une réaction chimique ne dépend que des concentrations
2- Toutes les réactions chimiques ont les mêmes vitesses de réaction
3- [A]. La vitesse volumique de disparition d’un réactif est positive
4- [B]. Coefficient stoechiométrique b supérieur à celui du réactif A : la vitesse volumique de disparition de B est inférieure à la vitesse de disparition de A
5- [C]. La vitesse d’une réaction est inversement proportionnelle aux coefficients stœchiométriques
6- [C] : Tous les composés d’une réaction permettent de calculer la vitesse de réaction
Les affirmations 5 et 6 sont exactes.
Cinétique chimique = étude de la vitesse des réactions chimiques
Vitesse d’une réaction chimique = variation des concentrations en fonction du temps.
Vitesse volumique = Variation dans le temps des concentrations par unité de volume.
Affirmation 1
Non.
La vitesse d’une réaction chimique dépend de facteurs tels que :
- concentrations des réactifs,
- température,
(La vitesse des réactions chimiques augmente avec la température)
- catalyseur éventuel,
- solvant, …
Affirmations 2
Non.
Certaines réactions chimiques sont très rapides, comme les réactions acide-base.
Certaines
réactions de combustion peuvent être explosives.
D’autres réactions chimiques peuvent être très
lentes, oxydation des métaux, et prendre des années : réaction
de H2O sur les minéraux.
Affirmation 3
Non.
[A].
La vitesse volumique de disparition d’un réactif est négative.
La vitesse volumique d’apparition d’un produit est positive.
Affirmation 4
Non.
[B]. Si les éléments chimiques A et B sont dans les proportions stoechiométriques, ils disparaissent dans le même temps t.
Pour une même temps de réaction, la vitesse de disparition de B, présent en concentration supérieure, est plus rapide que celle de A.
Affirmation 5
Oui.
[C].
La vitesse de réaction est inversement proportionnelle aux coefficients stœchiométriques des éléments de l’équation chimique.
Le signe négatif indique une diminution de la concentration (pour les réactifs), le signe positif indique une augmentation de la concentration (pour les produits).
Affirmation 6
Oui.
[C].
Même vitesse v de réaction.
Vitesses volumiques de chaque composé différentes
(Mais proportionnelles, au signe, et à l’inverse des coefficients stœchiométriques près).
Page 5
Vitesses constantes & vitesses variables

Sélectionner l’affirmation exacte :
1- [A]. Exemples
de réactions chimiques à vitesses décroissantes
2- [A]. La pente de la droite concentration/temps ne dépend pas du coefficient stœchiométrique
du composé chimique
3- [B]. Dans cet exemple, la vitesse instantanée de la réaction varie en fonction de la concentration
4- [B]. Quand la concentration diminue, la vitesse augmente
L’affirmation 3 est exacte.
Vitesse = dérivée de la fonction = pente de la courbe
Concentration = intégrale de la fonction = aire sous la courbe
Affirmation 1
Non.
[A]. Exemples de réactions à vitesses constantes.
La vitesse de disparition des réactifs est constante.
Vitesse = pente droite = -k
La vitesse d’évolution de la concentration ne dépend pas de la concentration. Elle est la même du début à la fin de la réaction.
La réaction rapide a une pente (une vitesse de réaction, une constante de réaction), plus importante que celle de la réaction lente.
Affirmation 2
Non.
[A].
Exemple : 1A + 2B
La diminution de concentration du réactif B est 2 fois plus rapide que la diminution de concentration du réactif A.
Pour que la réaction soit complète, qu’il ne manque pas de réactif B, il faut que les composés soient au départ dans les proportions stœchiométriques, 2 fois plus de moles B que de moles A.
Si tel n’est pas le cas, il reste un réactif en fin de réaction.
Le réactif en insuffisance pour que la réaction soit complète est dit réactif limitant.
Affirmation 3
Oui.
[B] : Dans ces exemples, la vitesse de réaction décroît en fonction de la concentration du réactif.
Pour le réactif A, la vitesse correspond à la pente de la droite :
v=- 1/a d[A]/dt
(a est le coefficient stœchiométriques assigné au réactif dans l’équation)
L’intégration de la vitesse donne les courbes d’évolution de la concentration présentées.
ln [A] = ln [A]0 – akt
[A] = [A]0 exp(-akt)
(a est le coefficient stœchiométriques assigné au réactif dans l’équation)
Affirmation 4
Non.
[B]. Proportionnalité vitesse-concentration : Quand la concentration diminue, la vitesse diminue.
Notes :
K, coefficient de vitesse, dépend de la température.
Les vitesses des réactions chimiques ne peuvent pas toutes s’exprimer sous formes simples : v=k, v=k.[C], v=k.[C]2, v=k.[C1][C2]
Page 6
Avancement d’une réaction

Sélectionner les deux affirmations exactes :
1- L’avancement maximal d’une réaction chimique : lorsque tous les réactifs ont disparu
2- [A]. L’avancement a pour valeur le plus petit nombre qui annule l’un des nombres de moles de réactifs
3- [A]. 2-X=0 ; 2-6X=0 ; l’avancement maximal de la réaction est de 2 moles
4- [B]. 5-1X et 4-2
5- L’avancement (ou lettre grecque « Ksi »), s’exprime en moles. Il a la même valeur pour toutes les molécules de la réaction chimique
6- Exemple 2 : le réactif limitant est le dioxyde de soufre
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
L’avancement maximal d’une réaction chimique : lorsque l’un au moins des réactifs a disparu.
Affirmation 3
Non.
[A] :
2-X=0 => X =2
2-6X=0 => X=2/6=0 => X=0,3333… moles.
L’avancement maximal a pour valeur le plus petit nombre qui annule l’un des nombres de moles de réactifs.
L’avancement maximal de la réaction présentée, noté ξ (Ksi) = 0,333 moles
Affirmation 4
Non.
[B]. 5-2X et 4-1X
5 moles au départ – 2X moles de H2S qui ont déjà réagi.
(2 est le coefficient stoechiométrique de H2S dans la réaction)
4 moles au départ – 1X moles de SO2 qui ont déjà réagi.
Affirmation 5
Oui.
Lettre grecque « Ksi » : ξ.
Exemple 1 de la figure : avancement ξ = 0,333moles.
Exemple 2 de la figure : avancement ξ = 2,5 moles.
Affirmation 6
Non.
Exemple 2 : le réactif limitant est le sulfure d’hydrogène H2S.
Réactif limitant : réactif qui, ayant totalement disparu, provoque l’arrêt de la réaction.
Il n’y a pas de réactif limitant si tous les réactifs sont dans les proportions stœchiométriques.
Page 7
Avancement relatif

Sélectionner les deux affirmations exactes :
1- État final : Le taux relatif d’avancement d’une réaction chimique totale = 1
2- La valeur de l’avancement de réaction dépend de la substance, réactif ou produit, utilisée pour la calculer
3- [A]. L’avancement de réaction mesuré, 0,7 moles, correspond à l’avancement attendu
4- [A]. La vitesse de réaction est constante
5- [A]. Le taux d’avancement final mesuré, 70% = réaction chimique équilibrée (non totale)
6- Le déclenchement d’une réaction et la vitesse d’une réaction ne dépendent que des réactifs impliqués
Les affirmations 1 et 5 sont exactes.
Affirmation 1
Oui.
[A].
Le taux d’avancement :
- nombre de mole réaction en cours / nombre de moles en final d’une réaction totale,
- est un rapport, grandeur sans unité,
- Le taux maximal d’avancement d’une réaction totale = 1,
- Si le taux d’avancement reste < 1 : réaction chimique en équilibre.
Affirmation 2
Non.
La valeur
de l’avancement de réaction ξ ne dépend pas de la substance
utilisée pour la calculer.
Les concentrations sont divisées par les coefficients stœchiométriques
respectifs.
Affirmation 3
Non.
[A].
Avancement de réaction maximum mesuré = 0,7 moles
Avancement de réaction maximum prévu = 1 mole
Affirmation 4
Non.
[A]. La vitesse de réaction est la pente de la courbe obtenue par mesure. Cette pente n’est pas constante.
La réaction est plus rapide en début, mais globalement c’est un exemple de réaction chimique lente : l’échelle des temps est en heures.
Vitesse d’une réaction = d[ξ ]/dt = d[Avancement de la réaction]/dt
Affirmation 5
Oui.
[A]. Le taux d’avancement final mesuré, 70% = réaction chimique équilibrée (non totale)
Une réaction totale est caractérisée par un taux final d’avancement = 1.
À l’équilibre, on ne détecte pas de variation des concentrations : l’équation est, macroscopiquement, à l’équilibre.
Dans le détail, à l’échelle microscopique, la réaction (réactifs => produits) est annulée par une réaction inverse (produits => réactifs) ; il y a un équilibre dynamique qui n’affecte pas les quantités de substances.
Affirmation 6
Non
Le déclenchement d’une réaction, la vitesse d’une réaction, dépendent de
facteurs d’environnement :
- la température peut être augmentée pour déclencher ou augmenter la vitesse d’une réaction,
- un catalyseur peut être nécessaire pour déclencher ou augmenter la vitesse d’une réaction.
Rappels :
Unité
de masse atomique
Unité de masse
unifiée
L’unité de référence de la masse atomique, 1u, a été choisie comme étant le douzième de la masse d’un atome carbone 12
(Le carbone 12 est un isotope courant du carbone)
1u= 1/12 de la masse carbonne12 = 1, 66… x 10-27 kg
Une unité = 1,66… x 10-27 kg
Exemples
de masse atomique :
La masse atomique du carbone12 est de 1 u.
La masse atomique du fer est 55,845 u.
(Le fer est plus de 55 fois plus lourd que le carbone)
Le Dalton
En biochimie, le Dalton, symbole Da, est aussi utilisé.
1 Da = 1/12 de la masse d’un atome de carbone
1 Da = 1u
1 Da = approximativement la masse d’un atome d’hydrogène.
En pratique, on utilise le Kilo Da.
La
mole
- La mole est une unité de comptage,
- Utilisée pour compter les nombres très importants d’éléments,
(Pour éviter les « 10 puissances n »)
- Symbole mol,
- 1 mol = 6,023 x 1023 , entités
6,023 x 1023 , est
appelé le nombre d’Avogadro.
La référence du nombre d’Avogadro est le nombre d’atomes contenu dans 12
grammes de carbone 12.
La quantité de matière n d’un élément microscopique, exprimées en moles, est donc le nombre d’éléments divisé par le nombre d’Avogadro:
n = N / Na
Voir aussi Masse molaire