Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Equation chimique
Sélectionner
les deux affirmations exactes :
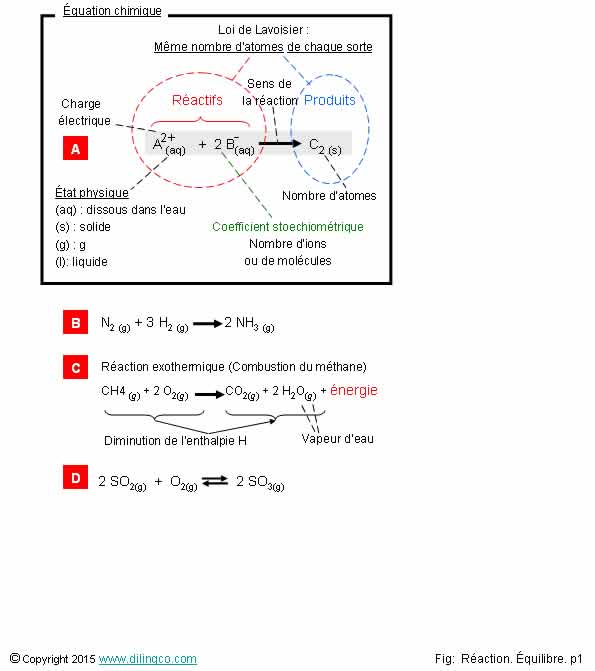
1- [A].
La réaction présentée n’est pas équilibrée électriquement
2- [B]. Coefficient
stoechiométrique : 3
3- La loi
de conservation de la matière s’applique aux molécules
4- On a
toujours : Energie potentielle des réactifs = énergie potentielle des
produits (Enthalpie H réactifs = Enthalpie H produits)
5- [C].
Réaction chimique exothermique : même quantité de matière en début et en
fin de réaction
6- [D].
Réaction chimique équilibrée : à l’équilibre, il ne se passe plus de
réaction
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Si.
[A] :
somme des charges réactifs : (2+) + (2–)
= somme
des charges côté produits = 0
Affirmation
2
Oui.
[B]. Coefficient
stoechiométrique : 3
Une mole
d’azote réagit avec 3 moles d’hydrogène pour produire 2 moles d’ammoniac.
L’équation chimique donne le type et les quantités relatives de réactifs consommés et de
produits formés.
Affirmation
3
Non.
La loi de
conservation de la matière : la matière, la somme des atomes qui la
constitue, est la même des 2 côtés de l’équation chimique.
Le nombre
de molécules côté réactifs et côté produits n’est pas forcément identique.
Affirmation
4
Non.
Les
espèces chimiques ont une énergie potentielle, l’enthalpie H.
Si
l’énergie, l’enthalpie H, diminue lors de la
transformation des réactifs en produits, la
réaction est exothermique.
Une
réaction qui a besoin d’énergie pour démarrer est endothermique.
Voir aussi
la page « Concept d’entropie » du chapitre Principes de
thermodynamique,
L’énergie et la masse sont liées. e=mc2 , Lavoisier : « Rien ne se perd, rien ne se crée, tout se transforme. »
Affirmation
5
Oui.
[C].
Réaction chimique exothermique : même quantité de matière en début et en
fin de réaction, mais l’énergie potentielle, l’enthalpie
H, a diminué.
Compter
les nombres d’atomes pour s’en convaincre.
Affirmation
6
Si.
[D]. Réaction chimique équilibrée, à
l’équilibre :
- 2 réactions en activités, une dans le sens
direct, une dans le sens inverse, qui s’équilibrent
- les
vitesses de réactions, directe et inverse, sont égales ; il y a équilibre
dynamique.
- le bilan énergétique est nul (chaleur dégagée =
chaleur absorbée)
- une constante d’équilibre K entraîne la loi d’action
des masses.
Page 2.
Equilibrer une équation
chimique
Sélectionner
l’affirmation exacte :
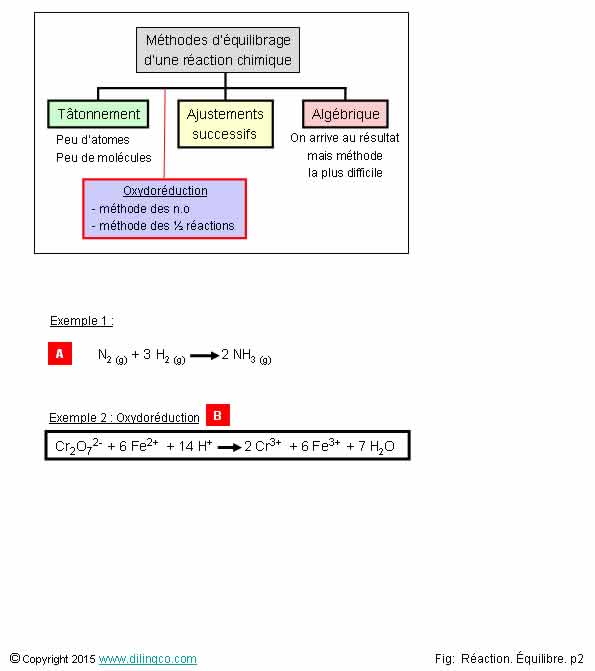
1- [A]. Equilibrage
par tâtonnement : 2 molécules d’hydrogène, 3 molécules de NH3
2- [B].
L’équation a été équilibrée par la méthode de tâtonnement
3- [B].
L’équation est équilibrée
4- [B].
Les charges électriques ne sont pas équilibrées
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A]. Le
total d’atomes d’hydrogène serait : 4 H en réactif, 9 H en produit !
Étapes
d’équilibrage par tâtonnement :
2 atomes
d’azote => 2 molécules de d’ammoniac NH3
2
molécules de d’ammoniac NH3 = > 3 H2
Affirmation
2
Non.
[B]. L’équation
présentée est une oxydoréduction entre les couples redox :
- Fe3+
/ Fe2+
- Cr2O72-
/ Cr3+
Pour le
fer et pour le chrome, il y a changement du nombre d’oxydation.
Fe
s’oxyde en passant du n.o=+2 à un n.o=+3 (Fe perd un électrons)
Cr se
réduit en passant du n.o=+6 à un n.o=+3 (Cr gagne des électrons)
Oxydation = perte d’électrons
Réduction = gain d’électrons.
Voir « Table des potentiels
standards » sur
le net.
L’équation
[B] a été équilibrée par la méthode du n.o nombre d’oxydation ou par la méthode
des ½ équations.
Page 3.
Equilibrage par ajustements
successifs
Sélectionner
l’affirmation exacte :
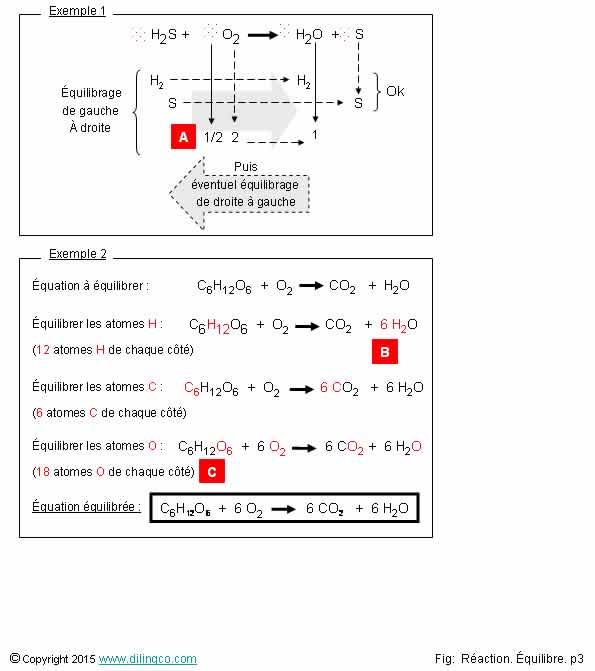
1- [A]. Coefficient
stœchiométrique = 1, (1 O2) : l’équation est équilibrée
2-
Méthode d’équilibrage par tâtonnement : il est conseillé de commencer par
équilibrer les atomes apparaissant le plus dans les molécules la réaction
3- [B].
6, pour équilibrer les atomes d’hydrogène
4- [C].
Équation équilibrée : 12 atomes d’oxygène de chaque côté
L’affirmation
3 est exacte.
Affirmation
1
Non.
Equilibrer de gauche à droite :
1 O2 = 2
atomes d’oxygène
Pour
équilibrer les atomes d’oxygène, multiplier par 2 la molécule d’eau (2H2O),
mais on obtient 4 atomes d’hydrogène.
Equilibrer de droite à gauche :
Multiplier
par 2 la molécule H2S
Rétablir l’équilibre de gauche à droite en multipliant la molécule de
soufre.
Equation
équilibrée :
2
H2S + O2 => 2H2O +2 S et diviser par 2
toutes les molécules.
Note:
Si on
choisit directement ½ O2, on arrive plus vite au résultat :
H2S
+ ½ O2 => H2O + S
Affirmation
2
Non.
Méthode
d’équilibrage par tâtonnement :
- commencer par équilibrer les atomes apparaissant le moins
dans les molécules la réaction,
-
équilibrer de gauche à droite,
- puis de
droite à gauche,
- équilibrer en conséquences les atomes liés suite
aux diverses passes d’équilibrage.
Affirmation
4
Non.
[C].
Équation équilibrée : 18 atomes
d’oxygène de chaque côté
Page 4.
Équilibrage par la
méthode algébrique
Sélectionner
l’affirmation exacte :
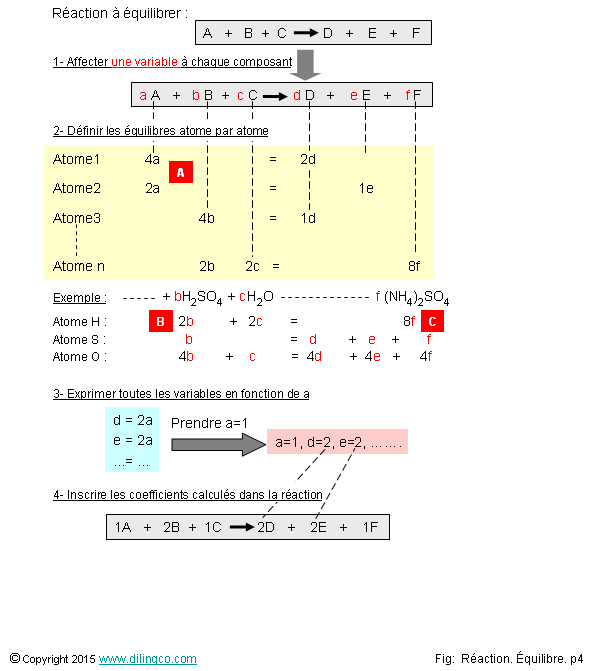
1- [A]. Les
chiffres trouvés pour chaque atome ne dépendent pas des formules moléculaires
2- [B].
H:2b, S:1b, O:4b
3- [C].
4f pour l’atome d’hydrogène
4- La
méthode algébrique donne toujours des coefficients stœchiométriques entiers
L’affirmation
2 est exacte.
Affirmation
3
Non.
[C]. 8f pour l’atome d’hydrogène
f(NH4)2SO4
Affirmation
4
Non.
La
méthode algébrique peut donner des coefficients stœchiométriques fractionnaires.
Exemple :
CO + ¼ Fe3O4
=> CO2 + ¾ Fe
Multiplier
par 4 pour obtenir des coefficients stœchiométriques entiers :
4 CO + Fe3O4
=> 4 CO2 + 3 Fe
Page 5.
Méthode algébrique.
Exemple

Sélectionner
l’affirmation exacte :
1-
[A] : 1b
2-
[B] : ¼
3-
[B] : ¾
4-
[C] : ¼
L’affirmation
2 est exacte.
Méthode
algébrique
Méthode d’équilibrage par la méthode algébrique :
0- Écrire l’équation à équilibrer
1- Affecter une variable à chaque réactif et à
chaque produit
2- Déterminer les chiffres affectés à chaque atome dans
chaque molécule
3- Résoudre les équations
- Prendre une variable = 1, plus petit nombre entier positif
- progressivement exprimer chaque variable en fonction de x=1
4- Inscrire les coefficients stœchiométriques calculés
dans l’équation à équilibrer
5- Simplifier pour obtenir des coefficients stoechiométriques entiers.
Figure :
en multipliant par 4 les molécules côté réactifs et côté produits.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Equation chimique

Sélectionner les deux affirmations exactes :
1- [A]. La réaction présentée n’est pas équilibrée électriquement
2- [B]. Coefficient stoechiométrique : 3
3- La loi de conservation de la matière s’applique aux molécules
4- On a toujours : Energie potentielle des réactifs = énergie potentielle des produits (Enthalpie H réactifs = Enthalpie H produits)
5- [C]. Réaction chimique exothermique : même quantité de matière en début et en fin de réaction
6- [D]. Réaction chimique équilibrée : à l’équilibre, il ne se passe plus de réaction
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Si.
[A] : somme des charges réactifs : (2+) + (2–)
= somme des charges côté produits = 0
Affirmation 2
Oui.
[B]. Coefficient stoechiométrique : 3
Une mole d’azote réagit avec 3 moles d’hydrogène pour produire 2 moles d’ammoniac.
L’équation chimique donne le type et les quantités relatives de réactifs consommés et de produits formés.
Affirmation 3
Non.
La loi de conservation de la matière : la matière, la somme des atomes qui la constitue, est la même des 2 côtés de l’équation chimique.
Le nombre de molécules côté réactifs et côté produits n’est pas forcément identique.
Affirmation 4
Non.
Les espèces chimiques ont une énergie potentielle, l’enthalpie H.
Si l’énergie, l’enthalpie H, diminue lors de la transformation des réactifs en produits, la réaction est exothermique.
Une réaction qui a besoin d’énergie pour démarrer est endothermique.
Voir aussi la page « Concept d’entropie » du chapitre Principes de thermodynamique,
L’énergie et la masse sont liées. e=mc2 , Lavoisier : « Rien ne se perd, rien ne se crée, tout se transforme. »
Affirmation 5
Oui.
[C]. Réaction chimique exothermique : même quantité de matière en début et en fin de réaction, mais l’énergie potentielle, l’enthalpie H, a diminué.
Compter les nombres d’atomes pour s’en convaincre.
Affirmation 6
Si.
[D]. Réaction chimique équilibrée, à l’équilibre :
- 2 réactions en activités, une dans le sens direct, une dans le sens inverse, qui s’équilibrent
- les vitesses de réactions, directe et inverse, sont égales ; il y a équilibre dynamique.
- le bilan énergétique est nul (chaleur dégagée = chaleur absorbée)
- une constante d’équilibre K entraîne la loi d’action des masses.
Page 2.
Equilibrer une équation chimique

Sélectionner l’affirmation exacte :
1- [A]. Equilibrage par tâtonnement : 2 molécules d’hydrogène, 3 molécules de NH3
2- [B]. L’équation a été équilibrée par la méthode de tâtonnement
3- [B]. L’équation est équilibrée
4- [B]. Les charges électriques ne sont pas équilibrées
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A]. Le total d’atomes d’hydrogène serait : 4 H en réactif, 9 H en produit !
Étapes d’équilibrage par tâtonnement :
2 atomes d’azote => 2 molécules de d’ammoniac NH3
2 molécules de d’ammoniac NH3 = > 3 H2
Affirmation 2
Non.
[B]. L’équation présentée est une oxydoréduction entre les couples redox :
- Fe3+ / Fe2+
- Cr2O72- / Cr3+
Pour le fer et pour le chrome, il y a changement du nombre d’oxydation.
Fe s’oxyde en passant du n.o=+2 à un n.o=+3 (Fe perd un électrons)
Cr se réduit en passant du n.o=+6 à un n.o=+3 (Cr gagne des électrons)
Oxydation = perte d’électrons
Réduction = gain d’électrons.
Voir « Table des potentiels standards » sur le net.
L’équation [B] a été équilibrée par la méthode du n.o nombre d’oxydation ou par la méthode des ½ équations.
Page 3.
Equilibrage par ajustements successifs

Sélectionner l’affirmation exacte :
1- [A]. Coefficient stœchiométrique = 1, (1 O2) : l’équation est équilibrée
2- Méthode d’équilibrage par tâtonnement : il est conseillé de commencer par équilibrer les atomes apparaissant le plus dans les molécules la réaction
3- [B]. 6, pour équilibrer les atomes d’hydrogène
4- [C]. Équation équilibrée : 12 atomes d’oxygène de chaque côté
L’affirmation 3 est exacte.
Affirmation 1
Non.
Equilibrer de gauche à droite :
1 O2 = 2 atomes d’oxygène
Pour équilibrer les atomes d’oxygène, multiplier par 2 la molécule d’eau (2H2O), mais on obtient 4 atomes d’hydrogène.
Equilibrer de droite à gauche :
Multiplier par 2 la molécule H2S
Rétablir l’équilibre de gauche à droite en multipliant la molécule de soufre.
Equation équilibrée :
2 H2S + O2 => 2H2O +2 S et diviser par 2 toutes les molécules.
Note:
Si on choisit directement ½ O2, on arrive plus vite au résultat :
H2S + ½ O2 => H2O + S
Affirmation 2
Non.
Méthode d’équilibrage par tâtonnement :
- commencer par équilibrer les atomes apparaissant le moins dans les molécules la réaction,
- équilibrer de gauche à droite,
- puis de droite à gauche,
- équilibrer en conséquences les atomes liés suite aux diverses passes d’équilibrage.
Affirmation 4
Non.
[C]. Équation équilibrée : 18 atomes d’oxygène de chaque côté
Page 4.
Équilibrage par la méthode algébrique

Sélectionner l’affirmation exacte :
1- [A]. Les chiffres trouvés pour chaque atome ne dépendent pas des formules moléculaires
2- [B]. H:2b, S:1b, O:4b
3- [C]. 4f pour l’atome d’hydrogène
4- La méthode algébrique donne toujours des coefficients stœchiométriques entiers
L’affirmation 2 est exacte.
Affirmation 3
Non.
[C]. 8f pour l’atome d’hydrogène
f(NH4)2SO4
Affirmation 4
Non.
La méthode algébrique peut donner des coefficients stœchiométriques fractionnaires.
Exemple :
CO + ¼ Fe3O4 => CO2 + ¾ Fe
Multiplier par 4 pour obtenir des coefficients stœchiométriques entiers :
4 CO + Fe3O4 => 4 CO2 + 3 Fe
Page 5.
Méthode algébrique. Exemple

Sélectionner l’affirmation exacte :
1- [A] : 1b
2- [B] : ¼
3- [B] : ¾
4- [C] : ¼
L’affirmation
2 est exacte.
Méthode algébrique
Méthode d’équilibrage par la méthode algébrique :
0- Écrire l’équation à équilibrer
1- Affecter une variable à chaque réactif et à chaque produit
2- Déterminer les chiffres affectés à chaque atome dans chaque molécule
3- Résoudre les équations
- Prendre une variable = 1, plus petit nombre entier positif
- progressivement exprimer chaque variable en fonction de x=1
4- Inscrire les coefficients stœchiométriques calculés dans l’équation à équilibrer
5- Simplifier pour obtenir des coefficients stoechiométriques entiers.
Figure : en multipliant par 4 les molécules côté réactifs et côté produits.