Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Réactions chimiques
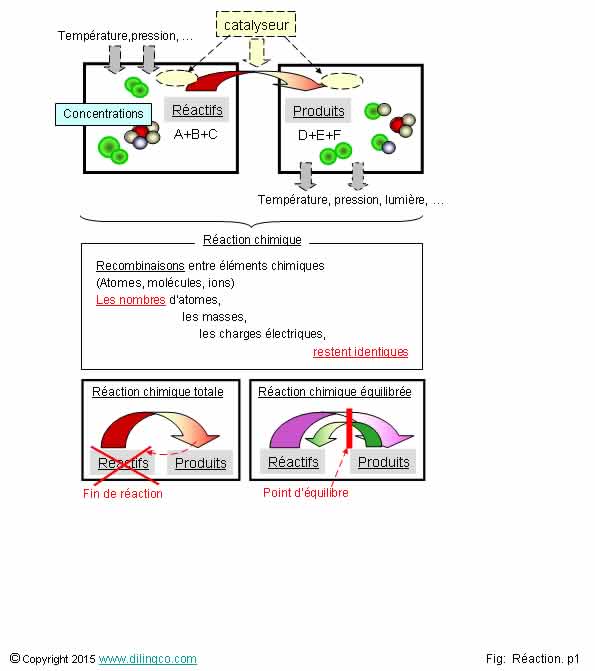
Lors d’une réaction chimique …
Sélectionner
les deux affirmations exactes :
1- Certaines
liaisons covalentes sont modifiées
2-
Certains atomes disparaissent
3- Les
molécules sont toutes conservées à l’identique
4- Si un
catalyseur est nécessaire, la quantité finale de catalyseur est égale à sa
quantité initiale
5- Une réaction
chimique peut nécessiter un apport d’énergie mais jamais dégager de l’énergie
6- Lors
d’une réaction chimique il peut y avoir une variation du total des masses
(Masses réactifs + masses produits)
7- Toutes
les réactions chimiques sont des réactions totales (Plus de réactifs en fin de
réaction)
Les
affirmations 1 et 4 sont exactes.
Affirmation
2
Non.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
« Rien
ne se perd, rien ne se crée » => atomes
« Tout
se transforme » => molécules
Affirmation
3
Non.
Une réaction chimique :
- est une recombinaison qui se traduit par la rupture
de liaisons et l'établissement de liaisons différentes entre les atomes des molécules
impliquées.
- les constituants initiaux, les réactifs, donnent des produits.
Affirmation
5
Non.
Une
réaction chimique qui dégage de l’énergie est dite « exothermique ».
Une combustion est une réaction chimique exothermique d’oxydoréduction.
Une
réaction chimique qui nécessite un apport d’énergie
est dite
« endothermique ».
L’énergie
peut être de la chaleur et/ou de la lumière.
La thermochimie est l’étude énergétique
des systèmes chimiques.
Affirmation
6
Non.
Lors
d’une réaction chimique, le total des masses se conserve.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
Conservation
de la matière
Lors d’une réaction chimique, il y a conservation de la matière.
- Conservation de la masse
Pour une
réaction complète, la masse des produits obtenus =
masse des réactifs initiaux.
- Conservation du nombre d’atome de chaque élément
chimique,
(Les
composés chimiques s’échangent leurs atomes)
- Conservation de la charge électrique globale.
Page 2.
Réactions chimiques.
Grands types
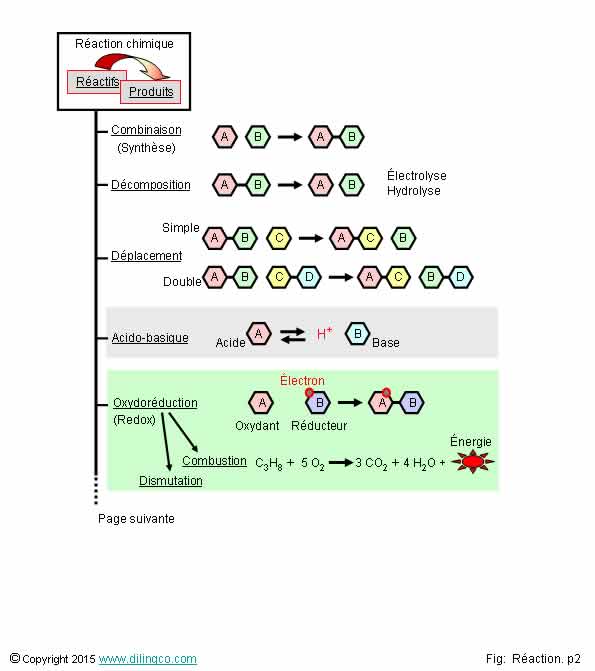
Sélectionner
l’affirmation exacte :
1- Réaction
d’oxydoréduction : transfert de protons
2- Réaction
acide-base : transfert d’électrons
3- L’ion
hydroxyde (HO-) est une base, l’eau est alors un acide. L’ion hydronium (H3O+)
est un acide, l’eau est alors une base
4- Les
électrolyses, thermolyses, pyrolyses, radiolyses, provoquent des synthèses de
composés chimiques à partir de corps simples
L’affirmation
3 est exacte.
Affirmation
1
Non.
Réaction
d’oxydoréduction :
- transfert d’électrons,
-
changement du nombre d’oxydation.
Affirmation
2
Non.
Réaction acide-base :
- transfert de protons H+
Un acide
cède un proton H+
Une base
capte un proton H+
Affirmation
3
Oui.
L’eau est
un ampholyte et peut s’autoprotolyser.
Ampholyte : Substance pouvant se comporter à la fois comme un acide et une
base.
Affirmation
4
Non.
Les électrolyses,
pyrolyses, radiolyses, provoquent des décompositions
chimiques de composés chimiques.
Pyrolyse
(ou thermolyse) : décomposition sans flamme d’un composé organique sous
l’effet de la chaleur (qui casse les chaînes organiques et donne des molécules
organiques plus petites).
Combustion
Combustion :
-
réaction exothermique (Qui produit de la chaleur),
-
réaction d’oxydoréduction entre 2 réactifs (un
combustible et un comburant),
-
déclenchée par une énergie d’activation (Exemples : de la chaleur, flamme,
pression, …),
- une
réaction en chaîne de rupture de liaisons chimiques produit des radicaux
libres.
Combustibles :
-
substance qui subit une oxydation rapide,
-
solides, liquides, gaz, métaux (exemple : magnésium),
…
-
exemples : bois, PVC, essence, butane, fer, magnésium, …
- les carburants sont des combustibles particuliers
qui contiennent du carbone
Comburant : par exemple le dioxygène de l’air.
Dismutation
Une dismutation :
- est une
réaction d’oxydoréduction,
-
l’espèce chimique de départ donne 2 produits, l’un
oxydé, l’autre réduit,
- 2
degrés d’oxydation n.o.
Exemple :
3 Cl2
+ 6 HO- -> 5 Cl- + ClO3-
+ 3 H2O
Un atome
de chlore est réduit en ion chlorure, Cl-,
n.o = -1
Un atome
de chlore est oxydé en ion chlorate, ClO3-,
n.o = +5
Page 3.
Réactions chimiques. Complexation.
Précipitation
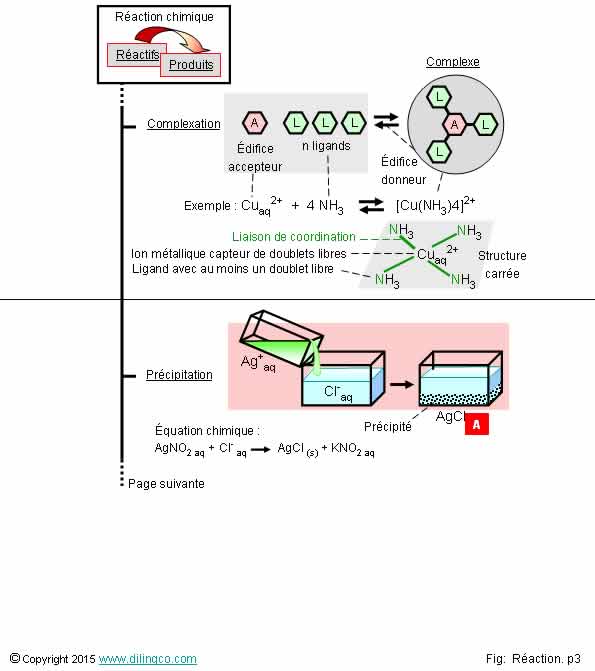
Sélectionner
l’affirmation exacte :
1-
Complexe : pas d’ion métallique dans un complexe chimique
2- [A]. Réaction
de précipitation : deux espèces ionisées, en solution aqueuse, forment un produit
liquide
3- Un
ligand est dit bidenté s’il possède un seul doublet libre
4-
Liaison de coordination : liaison covalente dans laquelle les 2 électrons
de la liaison proviennent du même atome
L’affirmation
4 est exacte.
Affirmation
1
Si.
L’atome
central est un ion métallique capable de capter des doublets d’électrons
libres.
L’atome
central est souvent un métal de transition du
bloc D :
Cu, Ag, Fe, …
Ou des
éléments situés juste après dans le tableau périodique :
Al, Sn,
Pb …
Le hème
de l’hémoglobine : ion fer complexé
par une porhyrine.
Affirmation
2
Non.
[A]. Réaction de précipitation : deux espèces
ionisées, en solution aqueuse, forment produit
solide, appelé « précipité », marqué (s).
aq :
état aqueux ; ion.
Affirmation
3
Non.
Un ligand
est dit monodenté (monodentate en anglais) s’il possède un seul doublet libre.
Les liaisons des ligands polydentés sont entropiquement favorisées par rapport
à celles des ligands monodentés.
Les
ligands peuvent être des molécules ou des ions.
Exemples :
Ligands
molécules monodentées : H2O, NH3, CO, NO
Ligands
ions monodentés : F-, CN-, Cl-, NO2-,
OH-
La structure géométrique des complexes dépend du nombre de
ligands : linéaire (2 ligands), triangulaire, tétraédrique, …
Affirmation
4
Oui.
Liaison de coordination : liaison covalente dans laquelle les 2 électrons de la liaison proviennent du même atome.
Dans
l’exemple de la figure NH3, l’atome d’azote apporte le doublet
d’électrons à la liaison covalente de coordination.
Page 4.
Réactions chimiques.
Hydratation. Hydrolyse
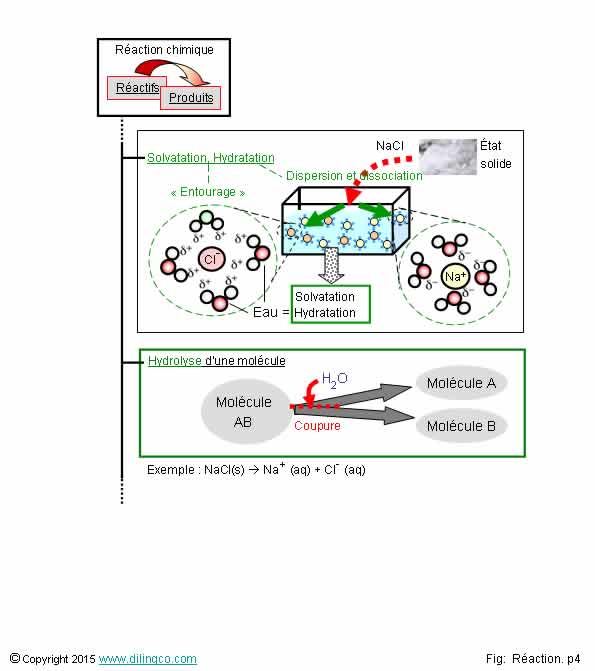
Sélectionner
l’affirmation exacte :
1- Un
minéral ne peut pas être «hydraté ». Hydraté pris dans son sens
physiologique : absorption d’eau
2-
Réaction d’hydratation (de solvatation) : le solide se dissous et ses ions
s’entourent de molécules d’eau
3-
Hydratation = hydrolyse
4-
Hydrogénation = Hydratation
L’affirmation
2 est exacte.
Affirmation
1
Si.
Exemple :
CaSO4.2H2O
Le gypse,
sulfate dihydraté de calcium, est
utilisé, par exemple, pour la fabrication du plâtre.
Contraire
de hydraté : déshydratation, assèchement, lyophilisation.
En physiologie, l’hydratation est l’absorption d’eau.
Affirmation 2
Oui.
Réaction
d’hydratation (de solvatation d’une manière plus générale) : les ions du
solide dissous s’entourent de molécules d’eau
Note :
Le terme hydratation a un sens spécifique en chimie organique.
Hydratation d’une molécule organique = apport d’un
groupement hydroxyle sous l’effet de l’eau.
Voir page suivante.
Affirmation
3
Non.
Hydratation : les ions d’un solide dissous
s’entourent de molécules d’eau.
Hydrolyse d’une molécule : rupture
d’une liaison moléculaire et création de nouvelles
molécules sous l’effet de l’eau.
Affirmation
4
Non.
Hydrogénation
= apport d’un atome d’hydrogène.
Voir page suivante « Réactions organiques ».
Page 5.
Réactions chimiques
organiques
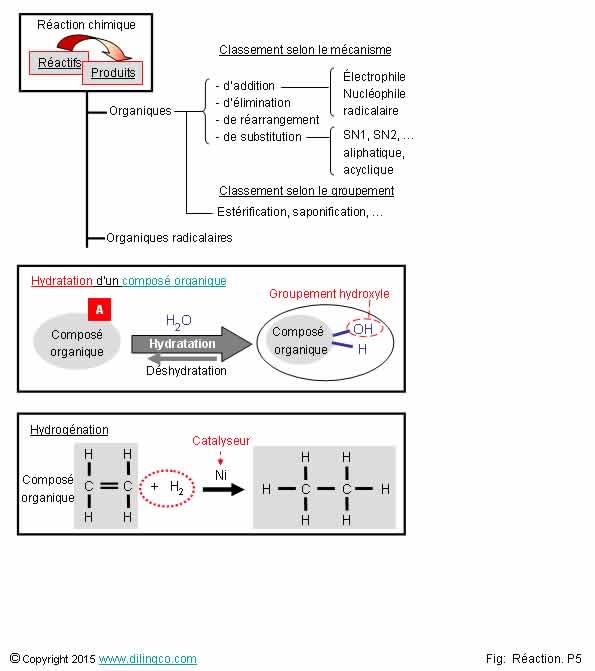
Sélectionner
l’affirmation exacte :
1- En
chimie organique Hydratation = absorption d’eau
2- [A].
Un composé organique se caractérise par la présence d’atome d’hydrogène
3- Radicaux libres :
très instables et très réactifs avec de nombreux composés, organiques ou non
4- Un
nucléophile est attiré par les charges négatives
L’affirmation
3 est exacte.
Affirmation
1
Non.
Chimie organique :
Hydratation d’une molécule organique = apport d’un
groupement hydroxyle sous l’effet de l’eau.
Chimie :
Réaction
d’hydratation : le solide se dissous et ses
ions s’entourent de molécules d’eau.
Physiologie :
Hydratation =
absorption d’eau.
Affirmation
2
Non.
[A]. Un composé organique a au moins un atome de carbone :
- H2O, H2SO4 ne sont pas des molécules
organiques,
- les
autres atomes peuvent êtres des atomes d’hydrogène,
Exemples :
CH4, Heptane C7H16, …
- ou sans
atomes d’hydrogène : Tétrachloroéthylène (2 carbones & 4 chlores),
- C &
H uniquement = hydrocarbures
Note :
Les molécules carbonées ne possèdent pas toutes des liaisons C-H.
Ces
molécules sont dites « inorganiques ».
Exemples :
- CaCO3 : molécule minérale
- oxydes
de carbone simples
(Carbone
et oxygène uniquement : CO, CO2, …),
-
carbonates (ions),
-
cyanure, diamant, graphite.
A l’inverse certains composés organiques ne
contiennent pas de liaison C-H.
Exemples :
urée, acide oxalique, …
Affirmation
3
Oui.
Les radicaux libres (au moins un électron célibataire sur
la couche externe) sont très instables, sont très réactifs avec de
nombreux composés, organiques ou non
Voir
chapitre Radicaux libres
Affirmation
4
Non.
Nucléophile :
- qui aime les noyaux,
- composé
chimique attiré par les charges positives
(des noyaux),
- donne
des électrons à des composés électrophiles pour former des liaisons covalents.
Electrophile :
attiré par les charge négatives.
Page 6
Réactions de
polymérisation
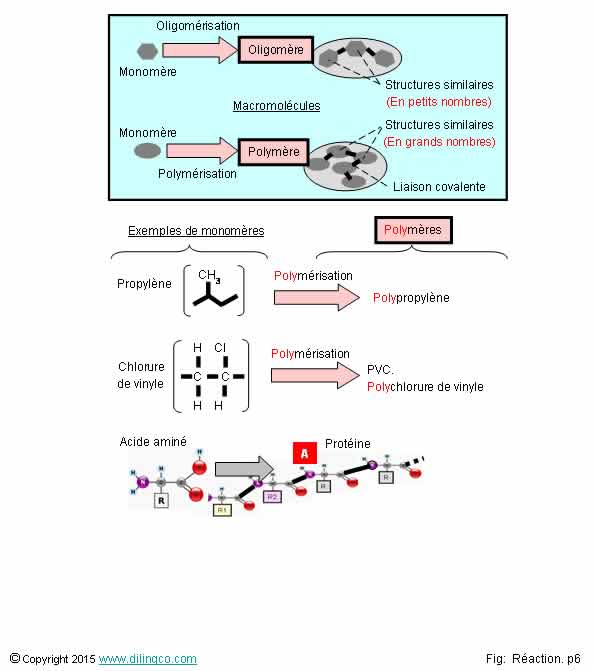
Sélectionner
les deux affirmations exactes :
1-
Monomère : même signification en chimie et en biologie
2- Toutes
les macromolécules sont d’origines synthétiques
3- La
chaîne principale d’un polymère a toujours des atomes de carbone
4-
[A] : Les
protéines sont des polymères d’acides aminés
5- Un
polymère est formé d’une répétition de monomères différents
6- Un
polymère est un isotope d’un monomère
7-
Réaction d’isomérisation : transfert de groupements dans une molécule
donnant une forme isomère
Les
affirmations 4 et 7 sont exactes.
Affirmation
1
Non.
Chimie :
Un monomère : substance, le plus souvent
organique, utilisée pour synthétiser un polymère
ou un oligomère.
Biologie :
Un monomère : élément constitutif d’une protéine
multimérique.
Exemple :
hémoglobine.
Chimie :
Oligomère : molécule constituée d’un petit nombre d’unités
monomères.
Biologie :
Oligomère :
fragment court d’ADN, chaîne courte
polypeptidique.
Affirmation
2
Non.
Les
macromolécules ne sont pas toutes d’origines synthétiques.
De nombreuses macromolécules sont d’origines
naturelles.
Exemples :
- Les polysaccharides
(Amidon, cellulose, …),
- Les
protéines,
- Les acides
nucléiques, l’ADN,
- La
soie, le caoutchouc naturel, …
Affirmation
3
Non.
La chaîne
principale d’un polymère n’a pas toujours des atomes de carbone.
Exemple : Les silicones sont des enchaînements d’atomes de silicium et
d’oxygène.
Affirmation
4
Oui.
Les
protéines :
- sont des
polymères d’acides aminés.
- sont
construites à partir de 20 acides aminés de base.
- nombre
et chronologie des acides aminés sont spécifiques à une protéine,
- les
acides aminés sont reliés entre eux par des liaisons
peptidiques pour former une
chaîne polypeptidique plus ou moins
longue.
Note :
Un enzyme est une protéine avec un pouvoir catalytique.
Affirmation
5
Non.
Un
polymère est formé d’une répétition de monomères
Un polymère est une molécule :
-
composées d’une répétition d’éléments
(atomes, groupes d’atomes, macromolécules),
- dont
les propriétés globales ne varient pas
si l’on rajoute, ou supprime, un élément de
la répétition.
Exemples
de polymères :
- la cellulose,
l’amidon, …
- la
kératine (Ongles, cheveux),
- de
nombreux polymères industriels.
Affirmation
6
Non.
Isotopes : atomes d’un même élément chimique X, de même numéro atomique
Z (même nombre de protons), mais de nombres
de neutrons différents
Voir Numéro atomique. Isotopes
Affirmation
7
Oui.
Réaction
d’isomérisation : transfert de groupements dans une molécule donnant une
forme isomère.
Exemples
dans la glycolyse, le métabolisme des pentoses phosphates.
Notes :
- Mésomères : mêmes formules brutes, mêmes
formules développées, localisations différentes
d’électrons.
- Isomères de constitution : mêmes formules
brutes, formules développées différentes (localisations
différentes d’atomes).
- Stéréoisomérie : mêmes formules brutes,
mêmes formules développées, organisation spatiale
différentes.
Voir isomère
Page 7
Exemples de réactions
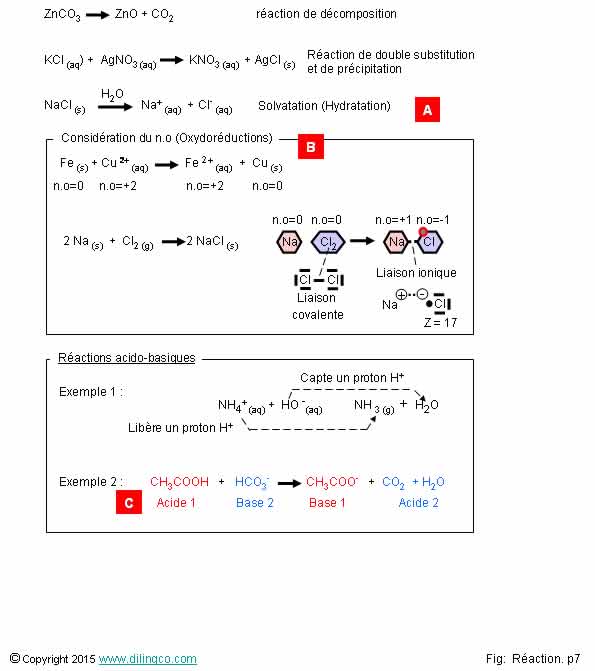
Sélectionner
l’affirmation exacte :
1- [A].
Hydrolyse : Les atomes Na et Cl se séparent et s’entourent de molécules
d’eau
2- [B].
Si les n.o, nombre d’oxydation, changent = oxydoréduction
3-
Réaction acido-basique en solution aqueuse : transfert d’électrons de
l’acide vers la base
4- [C].
CH3COOH est une base
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A]. Il
s’agit d’une solvatation (d’une
hydratation si le solvant est l’eau)
Les atomes se séparent et s’entourent de molécules
d’eau.
Voir
pages précédentes.
Affirmation
2
Oui.
[B]. Si les
n.o, nombre d’oxydation, changent = oxydoréduction.
= transfert de charges ; d’électrons
Le n.o,
est égal à la charge réelle ou fictive de l’élément considéré.
Corps simple : n.o=0
Ion :
no = charge de l’ion
Molécule no=0
Cas
particulier de l’atome oxygène et de l’atome d’hydrogène : Voir le
chapitre Nombre d’oxydation
Affirmation
3
Non.
Réaction acido-basique en solution aqueuse : transfert
d’ions H+ de l’acide vers la base
Affirmation
4
Non.
[C]. CH3COOH
est un acide : il cède un proton H+ à la base HCO3-
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Réactions chimiques

Lors d’une réaction chimique …
Sélectionner les deux affirmations exactes :
1- Certaines liaisons covalentes sont modifiées
2- Certains atomes disparaissent
3- Les molécules sont toutes conservées à l’identique
4- Si un catalyseur est nécessaire, la quantité finale de catalyseur est égale à sa quantité initiale
5- Une réaction chimique peut nécessiter un apport d’énergie mais jamais dégager de l’énergie
6- Lors d’une réaction chimique il peut y avoir une variation du total des masses (Masses réactifs + masses produits)
7- Toutes les réactions chimiques sont des réactions totales (Plus de réactifs en fin de réaction)
Les affirmations 1 et 4 sont exactes.
Affirmation 2
Non.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
« Rien ne se perd, rien ne se crée » => atomes
« Tout se transforme » => molécules
Affirmation 3
Non.
Une réaction chimique :
- est une recombinaison qui se traduit par la rupture de liaisons et l'établissement de liaisons différentes entre les atomes des molécules impliquées.
- les constituants initiaux, les réactifs, donnent des produits.
Affirmation 5
Non.
Une
réaction chimique qui dégage de l’énergie est dite « exothermique ».
Une combustion est une réaction chimique exothermique d’oxydoréduction.
Une réaction chimique qui nécessite un apport d’énergie est dite « endothermique ».
L’énergie
peut être de la chaleur et/ou de la lumière.
La thermochimie est l’étude énergétique
des systèmes chimiques.
Affirmation 6
Non.
Lors d’une réaction chimique, le total des masses se conserve.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
Conservation de la matière
Lors d’une réaction chimique, il y a conservation de la matière.
- Conservation de la masse
Pour une réaction complète, la masse des produits obtenus = masse des réactifs initiaux.
- Conservation du nombre d’atome de chaque élément chimique,
(Les composés chimiques s’échangent leurs atomes)
- Conservation de la charge électrique globale.
Page 2.
Réactions chimiques. Grands types

Sélectionner l’affirmation exacte :
1- Réaction d’oxydoréduction : transfert de protons
2- Réaction acide-base : transfert d’électrons
3- L’ion hydroxyde (HO-) est une base, l’eau est alors un acide. L’ion hydronium (H3O+) est un acide, l’eau est alors une base
4- Les électrolyses, thermolyses, pyrolyses, radiolyses, provoquent des synthèses de composés chimiques à partir de corps simples
L’affirmation 3 est exacte.
Affirmation 1
Non.
Réaction d’oxydoréduction :
- transfert d’électrons,
- changement du nombre d’oxydation.
Affirmation 2
Non.
Réaction acide-base :
- transfert de protons H+
Un acide cède un proton H+
Une base capte un proton H+
Affirmation 3
Oui.
L’eau est un ampholyte et peut s’autoprotolyser.
Ampholyte : Substance pouvant se comporter à la fois comme un acide et une base.
Affirmation 4
Non.
Les électrolyses, pyrolyses, radiolyses, provoquent des décompositions chimiques de composés chimiques.
Pyrolyse (ou thermolyse) : décomposition sans flamme d’un composé organique sous l’effet de la chaleur (qui casse les chaînes organiques et donne des molécules organiques plus petites).
Combustion
Combustion :
- réaction exothermique (Qui produit de la chaleur),
- réaction d’oxydoréduction entre 2 réactifs (un combustible et un comburant),
- déclenchée par une énergie d’activation (Exemples : de la chaleur, flamme, pression, …),
- une réaction en chaîne de rupture de liaisons chimiques produit des radicaux libres.
Combustibles :
- substance qui subit une oxydation rapide,
- solides, liquides, gaz, métaux (exemple : magnésium), …
- exemples : bois, PVC, essence, butane, fer, magnésium, …
- les carburants sont des combustibles particuliers qui contiennent du carbone
Comburant : par exemple le dioxygène de l’air.
Dismutation
Une dismutation :
- est une réaction d’oxydoréduction,
- l’espèce chimique de départ donne 2 produits, l’un oxydé, l’autre réduit,
- 2 degrés d’oxydation n.o.
Exemple :
3 Cl2 + 6 HO- -> 5 Cl- + ClO3- + 3 H2O
Un atome de chlore est réduit en ion chlorure, Cl-, n.o = -1
Un atome de chlore est oxydé en ion chlorate, ClO3-, n.o = +5
Page 3.
Réactions chimiques. Complexation. Précipitation

Sélectionner l’affirmation exacte :
1- Complexe : pas d’ion métallique dans un complexe chimique
2- [A]. Réaction de précipitation : deux espèces ionisées, en solution aqueuse, forment un produit liquide
3- Un ligand est dit bidenté s’il possède un seul doublet libre
4- Liaison de coordination : liaison covalente dans laquelle les 2 électrons de la liaison proviennent du même atome
L’affirmation 4 est exacte.
Affirmation 1
Si.
L’atome central est un ion métallique capable de capter des doublets d’électrons libres.
L’atome central est souvent un métal de transition du bloc D :
Cu, Ag, Fe, …
Ou des éléments situés juste après dans le tableau périodique :
Al, Sn, Pb …
Le hème de l’hémoglobine : ion fer complexé par une porhyrine.
Affirmation 2
Non.
[A]. Réaction de précipitation : deux espèces ionisées, en solution aqueuse, forment produit solide, appelé « précipité », marqué (s).
aq : état aqueux ; ion.
Affirmation 3
Non.
Un ligand
est dit monodenté (monodentate en anglais) s’il possède un seul doublet libre.
Les liaisons des ligands polydentés sont entropiquement favorisées par rapport
à celles des ligands monodentés.
Les ligands peuvent être des molécules ou des ions.
Exemples :
Ligands molécules monodentées : H2O, NH3, CO, NO
Ligands ions monodentés : F-, CN-, Cl-, NO2-, OH-
La structure géométrique des complexes dépend du nombre de ligands : linéaire (2 ligands), triangulaire, tétraédrique, …
Affirmation 4
Oui.
Liaison de coordination : liaison covalente dans laquelle les 2 électrons de la liaison proviennent du même atome.
Dans l’exemple de la figure NH3, l’atome d’azote apporte le doublet d’électrons à la liaison covalente de coordination.
Page 4.
Réactions chimiques. Hydratation. Hydrolyse

Sélectionner l’affirmation exacte :
1- Un minéral ne peut pas être «hydraté ». Hydraté pris dans son sens physiologique : absorption d’eau
2- Réaction d’hydratation (de solvatation) : le solide se dissous et ses ions s’entourent de molécules d’eau
3- Hydratation = hydrolyse
4- Hydrogénation = Hydratation
L’affirmation 2 est exacte.
Affirmation 1
Si.
Exemple : CaSO4.2H2O
Le gypse, sulfate dihydraté de calcium, est utilisé, par exemple, pour la fabrication du plâtre.
Contraire de hydraté : déshydratation, assèchement, lyophilisation.
En physiologie, l’hydratation est l’absorption d’eau.
Affirmation 2
Oui.
Réaction d’hydratation (de solvatation d’une manière plus générale) : les ions du solide dissous s’entourent de molécules d’eau
Note :
Le terme hydratation a un sens spécifique en chimie organique.
Hydratation d’une molécule organique = apport d’un groupement hydroxyle sous l’effet de l’eau. Voir page suivante.
Affirmation 3
Non.
Hydratation : les ions d’un solide dissous s’entourent de molécules d’eau.
Hydrolyse d’une molécule : rupture d’une liaison moléculaire et création de nouvelles molécules sous l’effet de l’eau.
Affirmation 4
Non.
Hydrogénation
= apport d’un atome d’hydrogène.
Voir page suivante « Réactions organiques ».
Page 5.
Réactions chimiques organiques

Sélectionner l’affirmation exacte :
1- En chimie organique Hydratation = absorption d’eau
2- [A]. Un composé organique se caractérise par la présence d’atome d’hydrogène
3- Radicaux libres : très instables et très réactifs avec de nombreux composés, organiques ou non
4- Un nucléophile est attiré par les charges négatives
L’affirmation 3 est exacte.
Affirmation 1
Non.
Chimie organique :
Hydratation d’une molécule organique = apport d’un groupement hydroxyle sous l’effet de l’eau.
Chimie :
Réaction d’hydratation : le solide se dissous et ses ions s’entourent de molécules d’eau.
Physiologie :
Hydratation = absorption d’eau.
Affirmation 2
Non.
[A]. Un composé organique a au moins un atome de carbone :
- H2O, H2SO4 ne sont pas des molécules
organiques,
- les autres atomes peuvent êtres des atomes d’hydrogène,
Exemples : CH4, Heptane C7H16, …
- ou sans atomes d’hydrogène : Tétrachloroéthylène (2 carbones & 4 chlores),
- C & H uniquement = hydrocarbures
Note :
Les molécules carbonées ne possèdent pas toutes des liaisons C-H.
Ces molécules sont dites « inorganiques ».
Exemples :
- CaCO3 : molécule minérale
- oxydes de carbone simples
(Carbone et oxygène uniquement : CO, CO2, …),
- carbonates (ions),
- cyanure, diamant, graphite.
A l’inverse certains composés organiques ne contiennent pas de liaison C-H.
Exemples : urée, acide oxalique, …
Affirmation 3
Oui.
Les radicaux libres (au moins un électron célibataire sur la couche externe) sont très instables, sont très réactifs avec de nombreux composés, organiques ou non
Voir chapitre Radicaux libres
Affirmation 4
Non.
Nucléophile :
- qui aime les noyaux,
- composé chimique attiré par les charges positives (des noyaux),
- donne des électrons à des composés électrophiles pour former des liaisons covalents.
Electrophile : attiré par les charge négatives.
Page 6
Réactions de polymérisation

Sélectionner les deux affirmations exactes :
1- Monomère : même signification en chimie et en biologie
2- Toutes les macromolécules sont d’origines synthétiques
3- La chaîne principale d’un polymère a toujours des atomes de carbone
4- [A] : Les protéines sont des polymères d’acides aminés
5- Un polymère est formé d’une répétition de monomères différents
6- Un polymère est un isotope d’un monomère
7- Réaction d’isomérisation : transfert de groupements dans une molécule donnant une forme isomère
Les affirmations 4 et 7 sont exactes.
Affirmation 1
Non.
Chimie :
Un monomère : substance, le plus souvent organique, utilisée pour synthétiser un polymère ou un oligomère.
Biologie :
Un monomère : élément constitutif d’une protéine multimérique.
Exemple : hémoglobine.
Chimie :
Oligomère : molécule constituée d’un petit nombre d’unités monomères.
Biologie :
Oligomère : fragment court d’ADN, chaîne courte polypeptidique.
Affirmation 2
Non.
Les
macromolécules ne sont pas toutes d’origines synthétiques.
De nombreuses macromolécules sont d’origines
naturelles.
Exemples :
- Les polysaccharides (Amidon, cellulose, …),
- Les protéines,
- Les acides nucléiques, l’ADN,
- La soie, le caoutchouc naturel, …
Affirmation 3
Non.
La chaîne
principale d’un polymère n’a pas toujours des atomes de carbone.
Exemple : Les silicones sont des enchaînements d’atomes de silicium et
d’oxygène.
Affirmation 4
Oui.
Les protéines :
- sont des polymères d’acides aminés.
- sont construites à partir de 20 acides aminés de base.
- nombre et chronologie des acides aminés sont spécifiques à une protéine,
- les acides aminés sont reliés entre eux par des liaisons peptidiques pour former une chaîne polypeptidique plus ou moins longue.
Note :
Un enzyme est une protéine avec un pouvoir catalytique.
Affirmation 5
Non.
Un polymère est formé d’une répétition de monomères
Un polymère est une molécule :
- composées d’une répétition d’éléments (atomes, groupes d’atomes, macromolécules),
- dont les propriétés globales ne varient pas si l’on rajoute, ou supprime, un élément de la répétition.
Exemples de polymères :
- la cellulose, l’amidon, …
- la kératine (Ongles, cheveux),
- de nombreux polymères industriels.
Affirmation 6
Non.
Isotopes : atomes d’un même élément chimique X, de même numéro atomique Z (même nombre de protons), mais de nombres de neutrons différents
Voir Numéro atomique. Isotopes
Affirmation 7
Oui.
Réaction d’isomérisation : transfert de groupements dans une molécule donnant une forme isomère.
Exemples dans la glycolyse, le métabolisme des pentoses phosphates.
Notes :
- Mésomères : mêmes formules brutes, mêmes formules développées, localisations différentes d’électrons.
- Isomères de constitution : mêmes formules brutes, formules développées différentes (localisations différentes d’atomes).
- Stéréoisomérie : mêmes formules brutes, mêmes formules développées, organisation spatiale différentes.
Voir isomère
Page 7
Exemples de réactions

Sélectionner l’affirmation exacte :
1- [A]. Hydrolyse : Les atomes Na et Cl se séparent et s’entourent de molécules d’eau
2- [B]. Si les n.o, nombre d’oxydation, changent = oxydoréduction
3- Réaction acido-basique en solution aqueuse : transfert d’électrons de l’acide vers la base
4- [C]. CH3COOH est une base
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A]. Il s’agit d’une solvatation (d’une hydratation si le solvant est l’eau)
Les atomes se séparent et s’entourent de molécules d’eau.
Voir pages précédentes.
Affirmation 2
Oui.
[B]. Si les n.o, nombre d’oxydation, changent = oxydoréduction.
= transfert de charges ; d’électrons
Le n.o, est égal à la charge réelle ou fictive de l’élément considéré.
Corps simple : n.o=0
Ion : no = charge de l’ion
Molécule no=0
Cas particulier de l’atome oxygène et de l’atome d’hydrogène : Voir le chapitre Nombre d’oxydation
Affirmation 3
Non.
Réaction acido-basique en solution aqueuse : transfert d’ions H+ de l’acide vers la base
Affirmation 4
Non.
[C]. CH3COOH est un acide : il cède un proton H+ à la base HCO3-