Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Radicaux
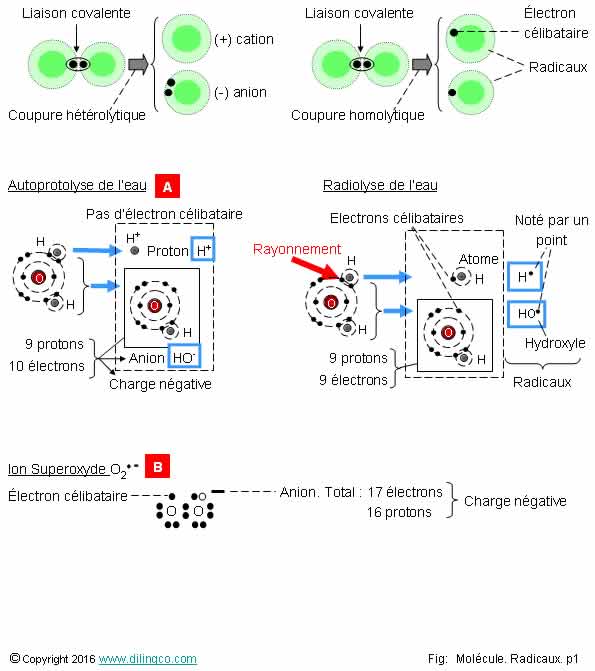
Sélectionner
l’affirmation exacte :
1-
Radical : espèce chimique avec un ou des électrons libres sur la couche
externe
2- Les
radicaux sont très stables
3- Plus
le radical a d’électrons célibataires, plus il est stable
4- Dans
les formules chimiques, pas de notation particulière pour un radical
L’affirmation
1 est exacte.
Affirmation
2
Non.
Les radicaux :
- sont très instables,
- ont une
durée de vie en solution très courte,
- très réactifs avec de nombreux composés.
Affirmation
3
Non.
Plus le
radical à d’électrons célibataires, plus il est instable stable
Un
radical « triradical » est plus réactif
qu’un « monoradical ».
Affirmation
4
Si.
Dans les
formules chimiques, un radical se note par un
point (A.).
Exemples :
Anion radicalaire superoxyde O2. –
Radical hydroxyle HO.
(À ne pas
confondre avec le groupement hydroxyle OH des alcools et des phénols)
Page 2.
Radical. Molécule. Ion. Ion
radical
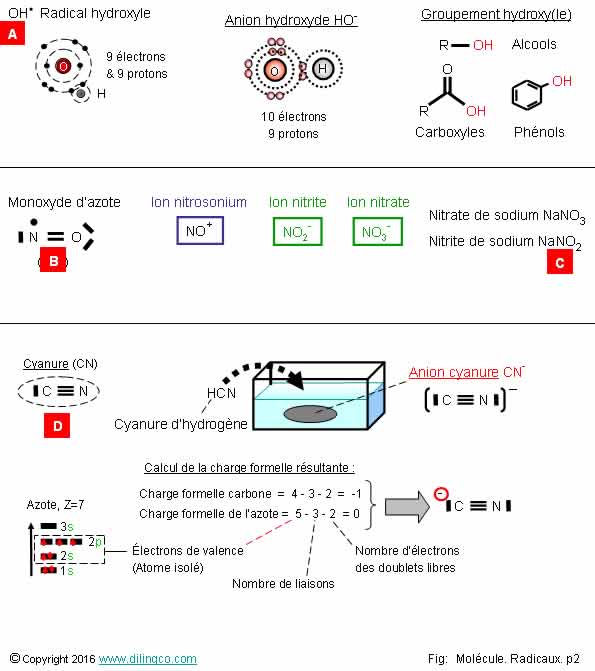
Sélectionner
l’affirmation exacte :
1- Le
radical monoxyde d’azote a une charge électrique
2- Le
monoxyde d’azote et l’anion radicalaire superoxyde interagissent entre eux
3-
[A] : CN = molécule
4- Pas de
radicaux à chaîne carbonée. Pas de radicaux dérivant d’un acide gras insaturé
L’affirmation
2 est exacte.
Affirmation
1
Non.
Le
radical monoxyde d’azote :
- a un
électron célibataire (C’est un radical),
- nombre d’électrons = nombre de protons = Charge électrique
nulle.
Le
monoxyde d’azote est un radical molécule.
Affirmation
2
Oui.
Le
monoxyde d’azote et l’anion superoxyde :
- sont tous deux des radicaux,
- ils sont interactifs,
Voir page suivante Oxydations du NO
- l’anion
peroxynitrique résultant est un puissant agent oxydant et nitrant.
Note :
L’anion superoxyde
provient de l’ajout d’un électron au dioxygène O2.
La figure
souligne les représentations habituelles du dioxygène
Voir
« Dioxygène » sur Wikipédia pour les implications de ces
représentations.
Affirmation
3
Non.
[A] :
Le cyanure est un anion CN-
Figure :
La somme des charges formelles des atomes constitutifs fait ressortir une
charge nette négative sur le carbone.
Affirmation
4
Si.
Exemples
de radicaux à chaîne carbonée : preoxydes ROO..
Page 3.
Arrachements &
coupures
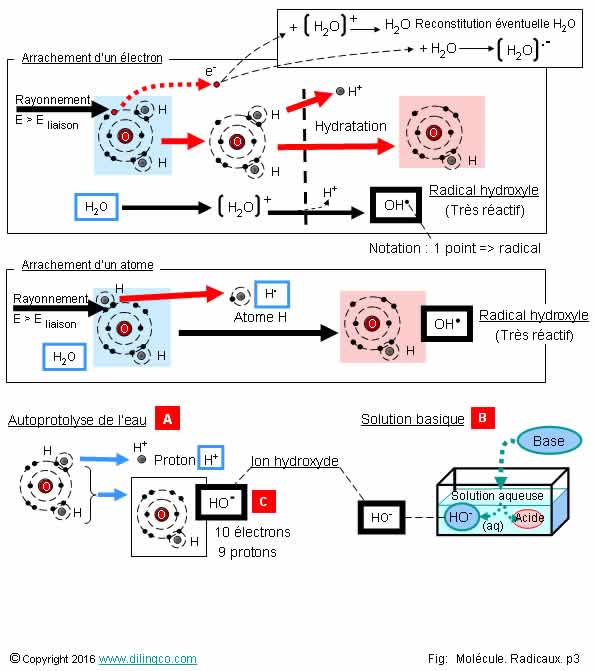
Sélectionner
les deux affirmations exactes :
1-
Radical hydroxyle et ion hydroxyle : même nombre d’électrons
2-
[A] : Autoprotolyse de l’eau : dissociation en ion hydroxyle et
proton H+ puis réassociation
3-
[B] : Solution acide
4-
[C] : Groupement hydroxyle
5- La
radiolyse de l’eau, du sang, sous l’effet de radiations intenses, produit des
radicaux
6- Le
radical hydroxyle est très stable
Les
affirmations 2 et 5 sont exactes.
Voir Ondes
électromagnétiques, Rayonnement ionisant
Affirmation
1
Non.
Radical hydroxyle OH. :
- 9 électrons (et 9 protons),
- molécule.
Anion hydroxyle HO- :
- 10 électrons
(1 de
plus que de protons)
Note :
Radical :
espèce chimique avec un ou des électrons libres
sur la couche externe.
Affirmation
2
Oui.
[A] :
L’autoprotolyse de l’eau provoque la cycle de création d’ions HO- et
de protons H+ ; protons H+ qui forment H3O+, puis la
recompositions de ces ions en H2O.
Affirmation
3
Non.
[B] :
Solution basique.
La
dissolution d’une base dans une solution aqueuse donne :
- une
solution basique,
- des
ions hydroxyles HO-,
- un
acide conjugué.
Affirmation
4
Non.
[C] :
Anion hydroxyle.
Un groupement
hydroxyle se rencontre dans des molécules organiques telles que les alcools et
les phénols.
Affirmation
5
Oui.
Radiolyse de l’eau : Des radiations intenses peuvent casser une liaison
covalente H-O d’une molécule d’eau, et la décomposer
en radical H (atome d’hydrogène) et radical
hydroxyle OH..
Affirmation
6
Si.
Par
nature les radicaux sont instables : ils cherchent à former un doublet sur leur(s)
électron(s) libre(s).
Le
radical hydroxyle OH. est très réactif, et nocif pour
l’organisme.
Note :
Radical :
espèce chimique avec un ou des électrons libres
sur la couche externe.
Page 4.
Radicaux. Superoxyde
& hydroxyle
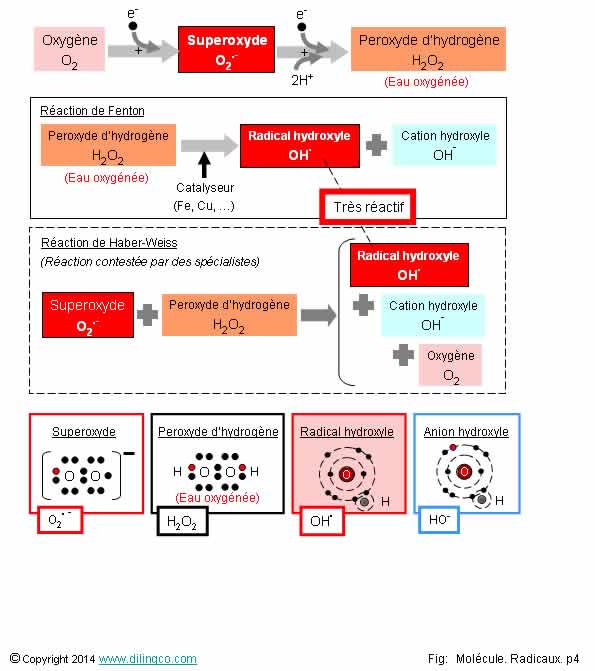
Sélectionner
les deux affirmations exactes :
1- Le
radical hydroxyle est très toxique pour les cellules de l’organisme
2- L’ion
radicalaire superoxyde n’a pas de conséquence indirecte sur les cellules de
l’organisme
3- Le
peroxyde d’hydrogène est un radical
4- La réaction de Fenton consomme des métaux de transition
5- Réaction de Fenton : Dismutation du peroxyde d’hydrogène
6- L’organisme humain ne produit pas de l’eau d’eau oxygénée
Les affirmations
1 et 5 sont exactes.
Affirmation
1
Oui.
Le
radical hydroxyde est très réactif avec les constituants des cellules de
l’organisme.
Le radical hydroxyle est toxique par oxydation (perte d’électron), et
destruction des éléments cellulaires.
Affirmation
2
Si.
L’ion
radicalaire superoxyde, bien qu’ayant une durée de vie courte en solution
aqueuse, est indirectement toxique pour les cellules de l’organisme :
- il réagit avec le
peroxyde d’hydrogène pour donner le radical hydroxyle très toxique.
- il réagit avec le
monoxyde d’azote NO pour donner l’anion peroxynitrite,
anion oxydant et nitrant (Voir page suivante).
Notes :
- Dans
l’organisme, les électrons disponibles pour les oxydations peuvent provenir de
la respiration cellulaire.
La
respiration cellulaire produit des ROS.
ROS :
Reactive Oxygen Species, espèces réactives de l’oxygène
- Réaction de Haber-Weiss :
O2.-
+ H2O2 = OH. + OH- + O2
Affirmation
3
Non.
Pas
d’électron célibataire.
Mais le peroxyde
d’hydrogène H2O2, mieux connu sous l’appellation « eau oxygénée », en
donnant des radicaux hydroxyles très nocifs pour les molécules de notre
organisme, es
Affirmation
4
Non.
La
réaction de Fenton est une réaction catalysée par des métaux de transition.
Dans une réaction catalysée, le catalyseur, bien qu’étant indispensable pour
déclencher la réaction, se retrouve en fin de réaction en quantité identique à
la quantité initiale.
Affirmation
5
Oui.
Dismutation :
décomposition correspondant à une oxydation et à une réduction à partir d’un
même réactif.
Les
produits de la réaction ont des nombres d’oxydation différents.
La dismutation
du peroxyde d’hydrogène est provoqué par beaucoup de métaux de transition
(réaction de Fenton).
Note :
Oxydation : perte d’un électron.
Réduction : gain d’un électron.
Affirmation 6
Si.
L’organisme humain produit du peroxyde d’hydrogène, H2O2, communément appelé « eau oxygénée ».
Page 5
Oxydations du monoxyde
d’azote
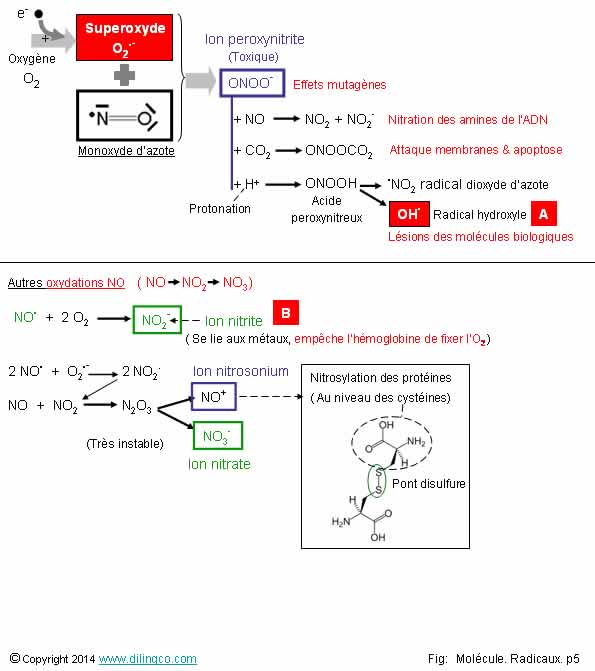
Sélectionner
les deux affirmations exactes :
1- Le
monoxyde d’azote NO, en solution aqueuse et en faibles concentrations, n’a pas
le temps de diffuser
2-
[A] : Radical hydroxyle
3-
[B] : Ion nitrite = ion nitrate
4- Le
monoxyde d’azote n’est pas un radical
5- Fortes
concentrations de NO : productions d’ions peroxynitriques et d’ions nitrosonium
par oxydations du NO
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Si.
Le monoxyde d’azote NO, en solution aqueuse et en faibles concentrations, a largement le temps de diffuser.
Notes :
- NO a un
meilleur coefficient de diffusion que
ceux de O2, CO, CO2.
- diffuse
à travers les membranes cellulaires,
- rapidité de diffusion caractéristique de la fonction de signalisation du NO.
- Le NO
est le seul neurotransmetteur gazeux connu.
Voir Signalisation
par le NO
Affirmation
2
Oui.
[A] :
Radical hydroxyle.
L’ion
radicalaire superoxyde réagit avec le monoxyde
d’azote NO pour donner l’anion peroxynitrite,
anion oxydant et nitrant.
Note :
Ne pas
confondre l’ion peroxynitrite ONOO-
et l’acide
peroxynitreux ONOOH.
« peroxynitreux » est un acide (définition de Bronsted), il a la possibilité de fournir un protons H+.
Protonation : gain d’un proton H+
Affirmation
3
Non.
[B].
Ne pas
confondre :
NO2-, ion nitrite et
NO3-, ion nitrate
NO :
monoxyde d’azote (ou oxyde nitrique, ou oxyde azotique)
NO+ :
Nitrosonium
L’ion nitrosonium
réagit avec les cystéines des protéines et provoquent leur nitrosylation.
N2O :
protoxyde d’azote (ou oxyde nitreux, ou gaz hilarant)
N2O3 :
trioxyde d’azote (Très instable, se décompose en NO+ et NO2-)
NO2 :
Dioxyde d’azote
NO2- :
ion nitrite
NO3- :
ion nitrate, sels d’acide nitrique
Nitrate dans
l’eau : pollution d’origine agricole par les engrais et lisiers. HNO3 :
acide nitrique. HNO3. Un composant des pluies acides.
Affirmation
4
Si.
1
électron célibataire
Voir figure.
Affirmation
5
Oui.
Fortes concentrations de NO (micro molaires) :
- oxydation(s) du NO,
- production d’ions toxiques pour l’organisme
-
ions peroxynitriques ONOO-
-
ions nitrites
-
ions nitrosonium NO+.
Figure :
Cystéine,
amines : Voir Acide aminé
Page 6
Résumé
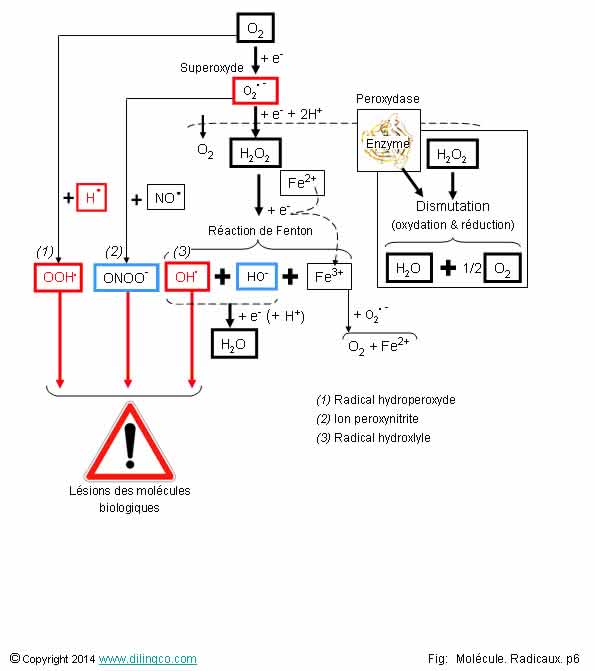
Sélectionner
les deux affirmations exactes :
1- L’eau oxygénée n’existe pas naturellement dans l’organisme
2- Radical hydroxyle : produit uniquement par la réaction de
Fenton
3- Dismutation :
le réactif de départ donne un produit en s’oxydant et un autre produit en se
réduisant
4-
L’anion superoxyde ne se dismute pas
5- Les
espèces réactives de l’oxygène et de l’azote peuvent être toxiques pour les
molécules de l’organisme
6- Stress
oxydant : L’organise détruit toutes les oxydations
7- La
respiration cellulaire ne produit pas de ROS
Les
affirmations 3 et 5 sont exactes.
Affirmation 1
Si.
Le peroxyde d’hydrogène, H2O2, est communément appelé « eau oxygéné ».
Affirmation 2
Non.
Les radicaux hydroxyles OH. peuvent être les
résultats de :
- la réaction de Fenton,
- la radiolise de l’eau,
(Voir page précédente Rayonnements)
- la décomposition du peroxinitrite
(Voir page précédente Oxydations du monoxyde d’azote)
Affirmation
3
Oui.
Dismutation :
décomposition correspondant à une oxydation et à une réduction à partir d’un
même réactif.
Les
produits de la réaction ont des nombres d’oxydation différents.
Exemple :
Le peroxyde d’hydrogène est dismuté par des enzymes (appelées peroxydases), et
par beaucoup de métaux de transition (réaction de Fenton).
Note :
Oxydation : perte d’un électron.
Réduction : gain d’un électron.
Affirmation
4
Si.
L’anion superoxyde
se dismute :
2O.-
+ 2H+ => H2O2 + O2
Affirmation
5
Oui.
Les
espèces réactives de l’oxygène et de l’azote peuvent être toxiques.
Elles peuvent dégrader les membranes phospholypidiques, les protéines, l’ADN, …
Affirmation
6
Non.
Stress oxydant : La production d’espèces
réactives ROS et RNOS dépasse les capacités de défense de
l’organisme.
ROS :
espèces réactives de l’oxygène
Le
peroxyde d’hydrogène, bien que non radical, est classé dans les ROS.
RNOS :
espèces réactives de l’azote.
Affirmation
7
Si.
La respiration
cellulaire produit des ROS.
ROS : Reactive Oxygen Species,
espèces réactives de l’oxygène
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Radicaux

Sélectionner l’affirmation exacte :
1- Radical : espèce chimique avec un ou des électrons libres sur la couche externe
2- Les radicaux sont très stables
3- Plus le radical a d’électrons célibataires, plus il est stable
4- Dans les formules chimiques, pas de notation particulière pour un radical
L’affirmation 1 est exacte.
Affirmation 2
Non.
Les radicaux :
- sont très instables,
- ont une durée de vie en solution très courte,
- très réactifs avec de nombreux composés.
Affirmation 3
Non.
Plus le radical à d’électrons célibataires, plus il est instable stable
Un radical « triradical » est plus réactif qu’un « monoradical ».
Affirmation 4
Si.
Dans les
formules chimiques, un radical se note par un
point (A.).
Exemples :
Anion radicalaire superoxyde O2. –
Radical hydroxyle HO.
(À ne pas confondre avec le groupement hydroxyle OH des alcools et des phénols)
Page 2.
Radical. Molécule. Ion. Ion radical

Sélectionner l’affirmation exacte :
1- Le radical monoxyde d’azote a une charge électrique
2- Le monoxyde d’azote et l’anion radicalaire superoxyde interagissent entre eux
3- [A] : CN = molécule
4- Pas de radicaux à chaîne carbonée. Pas de radicaux dérivant d’un acide gras insaturé
L’affirmation 2 est exacte.
Affirmation 1
Non.
Le radical monoxyde d’azote :
- a un électron célibataire (C’est un radical),
- nombre d’électrons = nombre de protons = Charge électrique nulle.
Le monoxyde d’azote est un radical molécule.
Affirmation 2
Oui.
Le monoxyde d’azote et l’anion superoxyde :
- sont tous deux des radicaux,
- ils sont interactifs,
Voir page suivante Oxydations du NO
- l’anion peroxynitrique résultant est un puissant agent oxydant et nitrant.
Note :
L’anion superoxyde provient de l’ajout d’un électron au dioxygène O2.
La figure souligne les représentations habituelles du dioxygène
Voir « Dioxygène » sur Wikipédia pour les implications de ces représentations.
Affirmation 3
Non.
[A] : Le cyanure est un anion CN-
Figure : La somme des charges formelles des atomes constitutifs fait ressortir une charge nette négative sur le carbone.
Affirmation 4
Si.
Exemples de radicaux à chaîne carbonée : preoxydes ROO..
Page 3.
Arrachements & coupures

Sélectionner les deux affirmations exactes :
1- Radical hydroxyle et ion hydroxyle : même nombre d’électrons
2- [A] : Autoprotolyse de l’eau : dissociation en ion hydroxyle et proton H+ puis réassociation
3- [B] : Solution acide
4- [C] : Groupement hydroxyle
5- La radiolyse de l’eau, du sang, sous l’effet de radiations intenses, produit des radicaux
6- Le radical hydroxyle est très stable
Les affirmations 2 et 5 sont exactes.
Voir Ondes électromagnétiques, Rayonnement ionisant
Affirmation 1
Non.
Radical hydroxyle OH. :
- 9 électrons (et 9 protons),
- molécule.
Anion hydroxyle HO- :
- 10 électrons
(1 de plus que de protons)
Note :
Radical : espèce chimique avec un ou des électrons libres sur la couche externe.
Affirmation 2
Oui.
[A] : L’autoprotolyse de l’eau provoque la cycle de création d’ions HO- et de protons H+ ; protons H+ qui forment H3O+, puis la recompositions de ces ions en H2O.
Affirmation 3
Non.
[B] : Solution basique.
La dissolution d’une base dans une solution aqueuse donne :
- une solution basique,
- des ions hydroxyles HO-,
- un acide conjugué.
Affirmation 4
Non.
[C] : Anion hydroxyle.
Un groupement hydroxyle se rencontre dans des molécules organiques telles que les alcools et les phénols.
Affirmation 5
Oui.
Radiolyse de l’eau : Des radiations intenses peuvent casser une liaison covalente H-O d’une molécule d’eau, et la décomposer en radical H (atome d’hydrogène) et radical hydroxyle OH..
Affirmation 6
Si.
Par nature les radicaux sont instables : ils cherchent à former un doublet sur leur(s) électron(s) libre(s).
Le radical hydroxyle OH. est très réactif, et nocif pour l’organisme.
Note :
Radical : espèce chimique avec un ou des électrons libres sur la couche externe.
Page 4.
Radicaux. Superoxyde & hydroxyle

Sélectionner les deux affirmations exactes :
1- Le radical hydroxyle est très toxique pour les cellules de l’organisme
2- L’ion radicalaire superoxyde n’a pas de conséquence indirecte sur les cellules de l’organisme
3- Le
peroxyde d’hydrogène est un radical
4- La réaction de Fenton consomme des métaux de transition
5- Réaction de Fenton : Dismutation du peroxyde d’hydrogène
6- L’organisme humain ne produit pas de l’eau d’eau oxygénée
Les affirmations 1 et 5 sont exactes.
Affirmation 1
Oui.
Le radical hydroxyde est très réactif avec les constituants des cellules de l’organisme.
Le radical hydroxyle est toxique par oxydation (perte d’électron), et destruction des éléments cellulaires.
Affirmation 2
Si.
L’ion radicalaire superoxyde, bien qu’ayant une durée de vie courte en solution aqueuse, est indirectement toxique pour les cellules de l’organisme :
- il réagit avec le peroxyde d’hydrogène pour donner le radical hydroxyle très toxique.
- il réagit avec le monoxyde d’azote NO pour donner l’anion peroxynitrite, anion oxydant et nitrant (Voir page suivante).
Notes :
- Dans l’organisme, les électrons disponibles pour les oxydations peuvent provenir de la respiration cellulaire.
La respiration cellulaire produit des ROS.
ROS : Reactive Oxygen Species, espèces réactives de l’oxygène
- Réaction de Haber-Weiss :
O2.- + H2O2 = OH. + OH- + O2
Affirmation 3
Non.
Pas d’électron célibataire.
Mais le peroxyde d’hydrogène H2O2, mieux connu sous l’appellation « eau oxygénée », en donnant des radicaux hydroxyles très nocifs pour les molécules de notre organisme, es
Affirmation 4
Non.
La
réaction de Fenton est une réaction catalysée par des métaux de transition.
Dans une réaction catalysée, le catalyseur, bien qu’étant indispensable pour
déclencher la réaction, se retrouve en fin de réaction en quantité identique à
la quantité initiale.
Affirmation 5
Oui.
Dismutation : décomposition correspondant à une oxydation et à une réduction à partir d’un même réactif.
Les produits de la réaction ont des nombres d’oxydation différents.
La dismutation du peroxyde d’hydrogène est provoqué par beaucoup de métaux de transition (réaction de Fenton).
Note :
Oxydation : perte d’un électron.
Réduction : gain d’un électron.
Affirmation 6
Si.
L’organisme humain produit du peroxyde d’hydrogène, H2O2, communément appelé « eau oxygénée ».
Page 5
Oxydations du monoxyde d’azote

Sélectionner les deux affirmations exactes :
1- Le monoxyde d’azote NO, en solution aqueuse et en faibles concentrations, n’a pas le temps de diffuser
2- [A] : Radical hydroxyle
3- [B] : Ion nitrite = ion nitrate
4- Le monoxyde d’azote n’est pas un radical
5- Fortes concentrations de NO : productions d’ions peroxynitriques et d’ions nitrosonium par oxydations du NO
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Si.
Le monoxyde d’azote NO, en solution aqueuse et en faibles concentrations, a largement le temps de diffuser.
Notes :
- NO a un meilleur coefficient de diffusion que ceux de O2, CO, CO2.
- diffuse à travers les membranes cellulaires,
- rapidité de diffusion caractéristique de la fonction de signalisation du NO.
- Le NO est le seul neurotransmetteur gazeux connu.
Voir Signalisation par le NO
Affirmation 2
Oui.
[A] : Radical hydroxyle.
L’ion radicalaire superoxyde réagit avec le monoxyde d’azote NO pour donner l’anion peroxynitrite, anion oxydant et nitrant.
Note :
Ne pas confondre l’ion peroxynitrite ONOO-
et l’acide peroxynitreux ONOOH.
« peroxynitreux » est un acide (définition de Bronsted), il a la possibilité de fournir un protons H+.
Protonation : gain d’un proton H+
Affirmation 3
Non.
[B].
Ne pas confondre :
NO2-, ion nitrite et
NO3-, ion nitrate
NO : monoxyde d’azote (ou oxyde nitrique, ou oxyde azotique)
NO+ : Nitrosonium
L’ion nitrosonium réagit avec les cystéines des protéines et provoquent leur nitrosylation.
N2O : protoxyde d’azote (ou oxyde nitreux, ou gaz hilarant)
N2O3 : trioxyde d’azote (Très instable, se décompose en NO+ et NO2-)
NO2 : Dioxyde d’azote
NO2- : ion nitrite
NO3- : ion nitrate, sels d’acide nitrique
Nitrate dans l’eau : pollution d’origine agricole par les engrais et lisiers. HNO3 : acide nitrique. HNO3. Un composant des pluies acides.
Affirmation 4
Si.
1 électron célibataire
Voir figure.
Affirmation 5
Oui.
Fortes concentrations de NO (micro molaires) :
- oxydation(s) du NO,
- production d’ions toxiques pour l’organisme
- ions peroxynitriques ONOO-
- ions nitrites
- ions nitrosonium NO+.
Figure :
Cystéine, amines : Voir Acide aminé
Page 6
Résumé

Sélectionner les deux affirmations exactes :
1- L’eau oxygénée n’existe pas naturellement dans l’organisme
2- Radical hydroxyle : produit uniquement par la réaction de Fenton
3- Dismutation : le réactif de départ donne un produit en s’oxydant et un autre produit en se réduisant
4- L’anion superoxyde ne se dismute pas
5- Les espèces réactives de l’oxygène et de l’azote peuvent être toxiques pour les molécules de l’organisme
6- Stress oxydant : L’organise détruit toutes les oxydations
7- La respiration cellulaire ne produit pas de ROS
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Si.
Le peroxyde d’hydrogène, H2O2, est communément appelé « eau oxygéné ».
Affirmation 2
Non.
Les radicaux hydroxyles OH. peuvent être les résultats de :
- la réaction de Fenton,
- la radiolise de l’eau,
(Voir page précédente Rayonnements)
- la décomposition du peroxinitrite
(Voir page précédente Oxydations du monoxyde d’azote)
Affirmation 3
Oui.
Dismutation : décomposition correspondant à une oxydation et à une réduction à partir d’un même réactif.
Les produits de la réaction ont des nombres d’oxydation différents.
Exemple : Le peroxyde d’hydrogène est dismuté par des enzymes (appelées peroxydases), et par beaucoup de métaux de transition (réaction de Fenton).
Note :
Oxydation : perte d’un électron.
Réduction : gain d’un électron.
Affirmation 4
Si.
L’anion superoxyde se dismute :
2O.- + 2H+ => H2O2 + O2
Affirmation 5
Oui.
Les
espèces réactives de l’oxygène et de l’azote peuvent être toxiques.
Elles peuvent dégrader les membranes phospholypidiques, les protéines, l’ADN, …
Affirmation 6
Non.
Stress oxydant : La production d’espèces réactives ROS et RNOS dépasse les capacités de défense de l’organisme.
ROS : espèces réactives de l’oxygène
Le peroxyde d’hydrogène, bien que non radical, est classé dans les ROS.
RNOS : espèces réactives de l’azote.
Affirmation 7
Si.
La respiration cellulaire produit des ROS.
ROS : Reactive Oxygen Species, espèces réactives de l’oxygène