Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
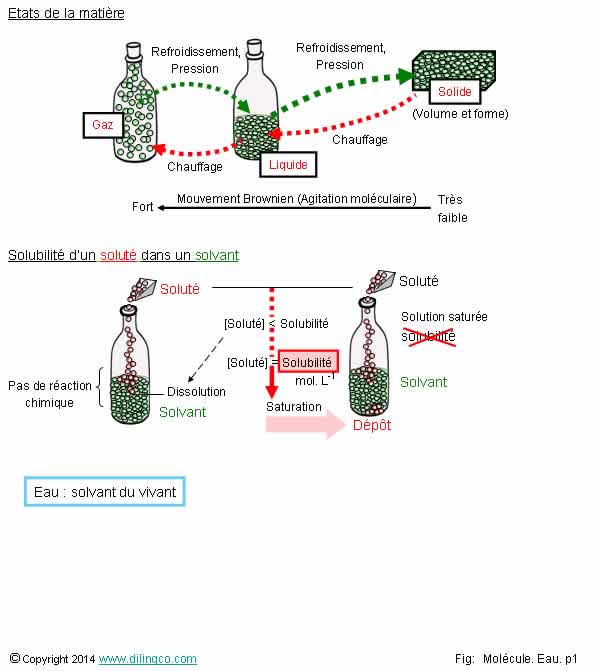
Solubilité
Sélectionner
les deux affirmations exactes :
1- Un gaz
a une forme et un volume propre
2- L’intensité des interactions
faibles conditionne le mouvement brownien et l’état gazeux, liquide, ou solide
d’un composé chimique
3- Les
températures de changement d’états ne sont pas liées aux interactions
moléculaires
4- Un
seul type de solvant : les solvants organiques
5- Le
dipôle des molécule d’eau modifie les interactions faibles des solutés et
permettent l’établissement de liaisons hydrogène à faibles énergies
6- La
solubilité « s » d’un soluté ne dépend pas de la température
Les
affirmations 2 et 5 sont exactes.
Affirmation
1
Non.
Gaz :
pas de forme et pas de volume propre.
Liquide :
volume propre, pas de forme propre.
Solide :
Forme et volumes propres.
Affirmation
2
Oui.
L’intensité
des interactions faibles conditionne l’agitation des molécules entre elles.
Agitation des molécule = mouvement brownien.
Les forces
d’interaction moléculaires vont de très faibles, pour les éléments gazeux, à fortes,
état liquide, et encore plus forte pour les états solides.
La température d’un corps est liée à l’agitation des molécules.
Affirmation
3
Si.
De 2
corps, celui qui a les plus fortes interactions moléculaires a les températures
de changement d’états les plus élevées.
(Température plus élevée pour casser les interactions moléculaires)
Affirmation
4
Non.
L’eau (le
sang) est le solvant du vivant.
Il existe
de très nombreux solvants classés suivant la molécule, la polarité, les
propriétés, le domaine d’utilisation, la toxicité, etc.
Solvants organiques : contient des atomes de carbone.
-
Solvants hydrocarbonés aliphatiques (alcanes, alcènes) & aromatiques
(Benzène, xylène, …)
-
Solvants oxygénés (éthanol, acétone, ..),
-
Solvants halogénés (perchloroéthylène, …
Affirmation
5
Oui.
Le moment
diélectrique d’une molécule d’eau diminue les interactions faibles du soluté permettant la séparation et la
dispersion des atomes du soluté
L’eau est
un solvant d’autant plus efficace que ses molécules peuvent former des liaisons
moléculaires, des liaisons hydrogènes, avec le soluté.
L’eau est le solvant du vivant.
Affirmation
6
Si.
Plus la
température du solvant est élevée, plus il y a de solvant dissous.
Une solution saturée ne peut plus dissoudre de soluté.
La
solubilité, s, s’exprime en moles par litre (mol/L), …
Exemple :
S = 0,014 mol.L-1 pour le sulfate
d’argent.
Solvant :
- élément
chimique très majoritaire d’une solution,
- dissous, dilue, d’autres substances,
- sans modification chimique du soluté, du
solvant.
Soluté : élément chimique minoritaire.
Le soluté
peut être moléculaire ou ionique.
Concentration : Taux de dissolution ou de mélange de l’élément apporté.
Solution
aqueuse :
Solvant = eau.
Page 2.
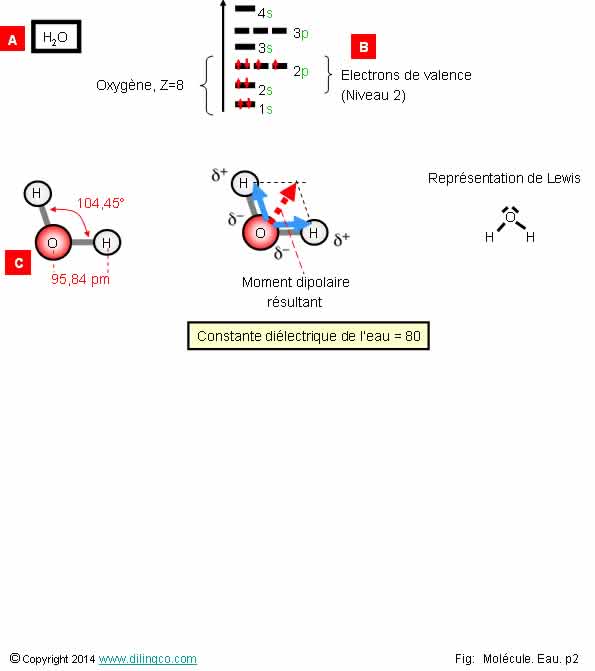
Molécule d’eau
Sélectionner
les deux affirmations exactes :
1-
[A] : 3 atomes, la molécule d’eau a une géométrie linéaire
2- [B] : 4 électrons de valence (un doublet et 2 électrons
célibataires tous sur le niveau 2p)
3- [C] : La molécule d’eau a une géométrie
« coudée » à cause des deux doublets non liants de l’atome d’oxygène
4- La molécule d’eau est de type AX2E1
5- La
molécule d’eau est polarisée et a une permittivité électrique forte
Les affirmations 3 et 5 sont exactes.
Affirmation
1
[A] :
3 atomes, mais la répulsion apportée par les 2 doublets non liants de l’atome
central d’oxygène coude la molécule.
Affirmation 2
Non.
6 électrons de valence : couche 2 = 2s, 2p.
Affirmation 3
Oui.
La répulsion apportée par les 2 doublets non liants modifie la
géométrie de la molécule d’eau.
Molécule d’eau : géométrie
« coudée ».
Affirmation
4
Non.
La géométrie de la molécule d’eau est de type AX2E2
- 1 atome central,
- 2 Atomes périphériques,
- 2 doublets non liants.
Affirmation
5
Oui.
H2O,
3 atomes mais :
- la
présence de 2 doublets non liants coudent la molécule,
- les
différences d’électronégatrivités OH polarisent les liaisons OH. (Convention
des chimistes : vecteur de – à +)
Le
vecteur moment dipolaire de la molécule d’eau, est la somme vectorielle
des moments dipolaires des 2 liaisons.
Le moment dipolaire n’est pas nul : l’eau est
une molécule polarisée.
Constante diélectrique de l’eau : 80. Forte permissivité
électrique, divise les forces électrostatiques par 80.
La polarisation des molécules d’eau explique :
- L’attirance électrique des molécules d’eau entre elles,
- La capacité à dissoudre les corps ioniques,
- Le point d’ébullition élevé,
- La plus grande densité de l’eau liquide par rapport à la densité
de la glace.
L’eau est le constituant principal des êtres vivants.
L’eau est le solvant du vivant : Tous les organismes vivants sont des
systèmes chimiques en phase aqueuse.
Caractéristiques
importantes
Les
propriétés de l’eau découlent de deux caractéristiques :
- La
structure de molécule d’eau conduit à une molécule
polarisée,
- La
molécule d’eau peut établir des liaisons hydrogène
de nature électrostatique
Propriétés
principales de l’eau
- Force de cohésion élevée,
- établie
des liaisons hydrogène avec des atomes des biomolécules,
- grand pouvoir de solvatation sur les solutés polaires
ou ioniques,
- se dissocie en ion oxonium/hydronium H3O+
et en ion hydroxyde OH-
Le pH, fonction du rapport de ces ions, agit sur l’action des
enzymes dans l’estomac et l’intestin.
- l’état liquide à une densité supérieure à l’état
solide : la glace flotte sur l’eau,
- tension superficielle élevée. Ceci explique la
capillarité (la sève monte dans les plantes), ou que des insectes puissent
marcher sur l’eau.
Page 3.
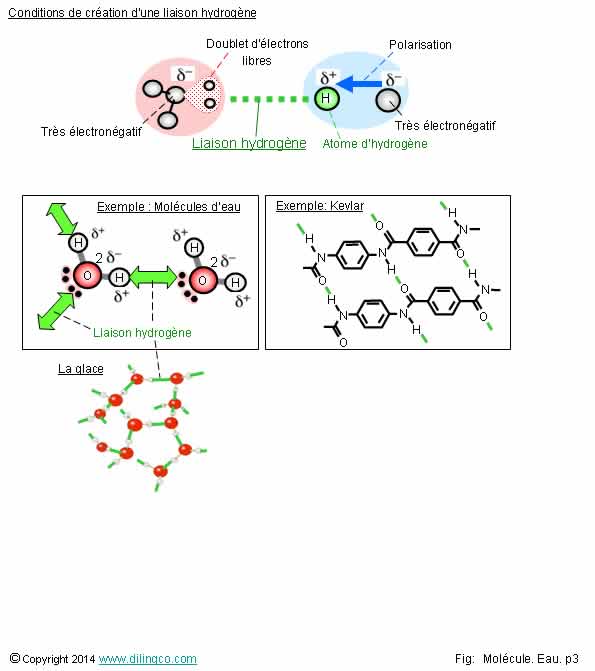
Liaison hydrogène
Sélectionner
les deux affirmations exactes :
1-
Liaison hydrogène : Entre molécules d’eau uniquement
2-
L’électronégativité n’entre pas en ligne de compte pour les liaisons hydrogènes
3- La
création d’une liaison hydrogène ne nécessite pas la présence d’un doublet
d’électrons libres
4- Les
molécules d'eau, d'ammoniaque (NH3), ou de fluorure d'hydrogène
(HF), peuvent être la source de liaisons hydrogène
5- La fonte
de la glace n’est pas d’une réaction chimique
Les affirmations
4 et 5 sont exactes.
Affirmation
1
Non.
Exemple de
la figure : Kevlar
Affirmation
4
Oui.
Les atomes d’oxygène, d’azote sont, après
l’atome de fluor, les atomes les plus électronégatifs du tableau périodique.
Les liaisons de ces atomes avec les atomes d’hydrogènes sont fortement polarisées.
Les molécules d’eau entre elles, d’ammoniaques entre elles, ou de fluorure
d’hydrogène peuvent former des liaisons hydrogènes.
Affirmation 5
Exact.
La fonte de la glace provient de la rupture des liaisons
hydrogènes. Les liaisons hydrogènes ne sont pas des liaisons covalentes, ne
sont pas des liaisons chimiques entre molécules d’eau .
Liaison hydrogène :
type interaction dipôle-dipôle.
Conditions
de réalisation d’une liaison hydrogène :
- Un atome d’hydrogène lié
à un élément très électronégatif dans une des 2 molécules,
- Un élément très électronégatif disposant d’au
moins un doublet d’électrons libres dans
l’autre molécule.
Page 4.
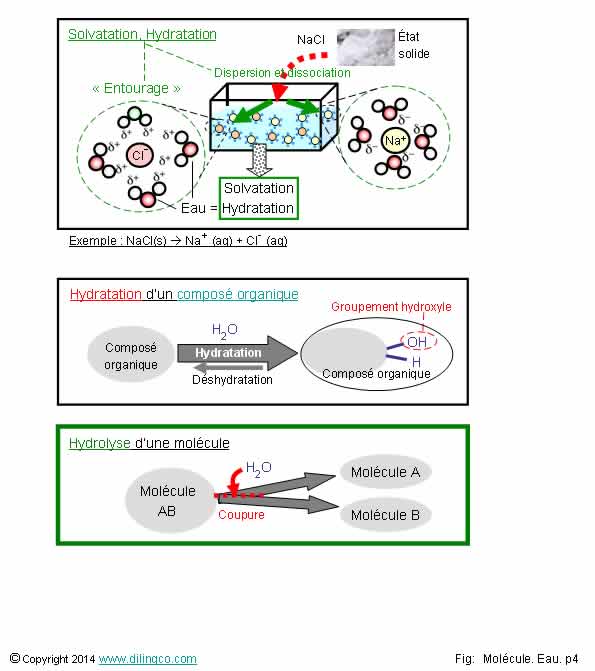
Hydratation. Hydrolyse
Sélectionner
l’affirmation exacte :
1-
Solvatation : dissolution d’un soluté dans un solvant. Hydratation : solvatation
en solution aqueuse
2- Un minéral
ne peut pas être hydraté (Hydraté : absorption d’eau)
3- Tous
les alcools organiques (1 carbone lié à un groupement hydroxyle –OH) sont
propres à la consommation
4-
Hydrolyse d’une molécule = Hydratation d’une molécule organique
L’affirmation
1 est exacte.
Affirmation
1
Oui.
Solvatation : Terme général, dissolution d’un soluté dans un solvant, le solvant peut
être autre chose que l’eau.
Hydratation : solvatation aqueuse.
Les
molécules d’eau entourent, isolent les atomes
du soluté et permettent leurs dispersions.
Solution
aqueuse : à base d’eau.
Affirmation
2
Si.
Exemple :
CaSO4.2H2O
Le gypse,
sulfate dihydraté de calcium, est
utilisé, par exemple, pour la fabrication du plâtre.
Contraire
de hydraté : déshydratation, assèchement, lyophilisation.
En physiologie, l’hydratation est l’absorption d’eau.
Affirmation
3
Non.
Certains alcools
organiques (1 carbone lié à un groupement
hydroxyle –OH) sont toxiques.
Affirmation
4
Non.
Le terme hydratation a un sens spécifique en chimie organique.
Hydratation d’une molécule organique = apport d’un
groupement hydroxyle sous l’effet de l’eau.
Hydrolyse d’une molécule : rupture d’une
liaison moléculaire et création de nouvelles
molécules sous l’effet de l’eau.
Hydratation
Addition d’eau.
Déshydratation
(ou condensation)
Perte d’une molécule d’eau.
Hydratation
d’un composé organique
Ajout
d’un hydroxyle et d’un hydrogène sous l’effet de l’eau
Composé
organique
Un composé organique a au moins un atome de carbone :
- H2O, H2SO4 ne sont pas des molécules
organiques,
- les
autres atomes peuvent êtres des atomes d’hydrogène,
Exemples :
CH4, Heptane C7H16, …
- ou sans
atomes d’hydrogène : Tétrachloroéthylène (2 carbones & 4 chlores)
Hydrolyse
Coupure d’une molécule sous l’action de l’eau.
Note :
Il existe aussi des hydrolyses chimiques (en milieu acide), et enzymatiques.
Solvatation,
hydratation
(dispersion)
La
solvatation résulte de :
-
l’interaction électrostatique de l’eau avec des solutés
ionisables,
-
l’interaction dipôle-dipôle ou liaisons hydrogènes
dans le cas de solutés non ionisables mais
polarisés.
Page 5.
Hydrophile. Hydrophobe
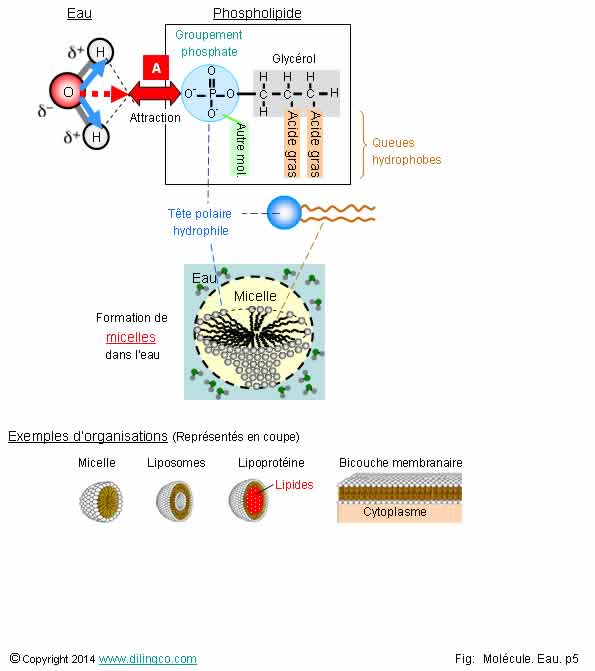
Sélectionner
l’affirmation exacte :
1-
[A] : Le dipôle positif de la molécule d’eau repousse le dipôle négatif du
groupements phosphate
2- Les
lipoprotéines sont des micelles contenant des lipides
3- Les
vitamines sont hydrosolubles. Pas de vitamines liposolubles
4- Les
bicouches lipidiques des membranes cellulaires sont rigides, imperméables,
n’incluent pas de protéines ou de cholestérol
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A] :
Le dipôle positif de la molécule d’eau attire le dipôle négatif du groupements
phosphate des phospholipides.
Affirmation
3
Non.
Les
vitamines des groupes B et C sont hydrosolubles.
Les
vitamines des groupes A, D, E et K, sont
liposolubles.
Affirmation
4
Non.
Les
bicouches lipidiques des membranes cellulaires :
- ne sont
pas rigides,
-
permettent la diffusion et le transport passif ou actif d’éléments,
- incluent
diverses protéines et cholestérols.
.
Micelle
(Figure : Représentation en coupe)
Une
micelle est un agrégat sphérique de molécules amphiphiles.
Les têtes
hydrophiles sont dirigées vers l’extérieur, vers le solvant ; les chaînes
hydrophobes sont dirigées vers l’intérieur de la micelle.
La taille
des vésicules micelles est de l’ordre de 0,001 à 0,3 micron.
Amphiphile : hydrophile ou hydrophobe à la fois (suivant le cas).
Liposome
Même
principe de création que les micelles mais l’agrégat
est formé de bicouches graisseuses concentriques.
Lipoprotéine :
- noyau hydrophobe (lipides insolubles dans le sang),
- noyau
enrobé dans une coque recouverte de groupement
polaires hydrophiles,
- permet l’acheminement par le système sanguin d’éléments insolubles,
- voir
Lipoprotéines, Circulation
des lipoprotéines
Page 6.
Electrolyte. Electrolyse
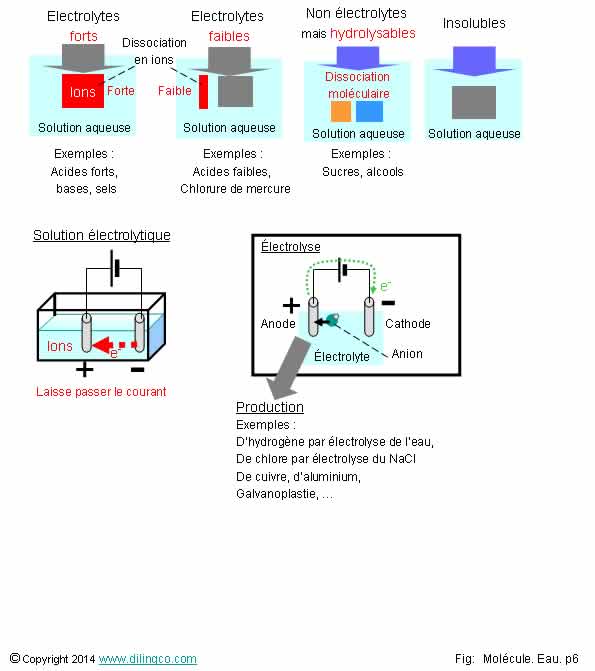
Sélectionner
l’affirmation exacte :
1- Une
solution électrolytique ne laisse pas passer le courant électrique
2- Tous
les électrolytes sont liquides
3- Les
électrolytes s’hydrolysent par dissociation moléculaire dans l’eau
4- Une
solution électrolytique peut être électrolysée pour séparer des éléments
chimiques
L’affirmation
4 est exacte.
Affirmation
1
Si.
Solution électrolytique :
(« Électrolytique »
fait référence à l’électricité)
- contient des ions,
- laisse passer le courant électrique.
Affirmation
2
Non.
Exemples :
certains cristaux et polymères
(Polymères
des membranes de filtration ionique)
Affirmation
3
Non.
Les
électrolytes se dissocient par dissolution ionique.
Note :
Hydrolyse : dissociation moléculaire dans l’eau par coupure de liaisons
peptidiques.
Hydrolyse du saccharose = glucose et fructose.
Hydrolyse
d’un ester = alcool et acide
(Réaction inverse : esthérification)
Page 7.
Autoprotolyse
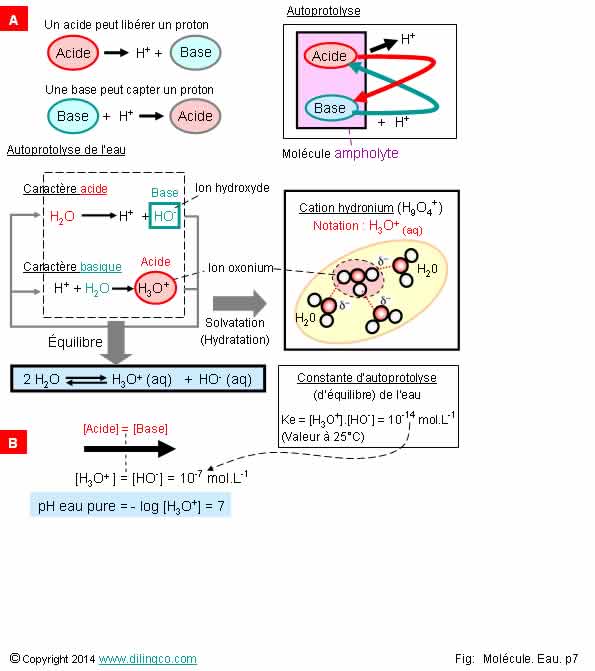
Sélectionner
les deux affirmations exactes :
1- Autoprotolyse :
Transfert de proton H+ entre molécules différentes
2- Ion
hydronium = ion oxonium solvaté par 3 molécule d’eau
3- [A] :
Un acide est une espèce capable de capter un proton H+
4- [B] :
Pas d’ion hydroxyde ni d’ion hydronium dans une solution aqueuse neutre (pH de
7)
5- En solution
aqueuse, protons H+, ions hydroxyde, ions oxonium ont une durée très courte.
Les quantités sont négligeables par rapport aux molécules d’eau
6- L’eau
n’est pas une molécule ampholyte
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Non.
Autoprotolyse :
Transfert de proton H+ entre 2 molécules identiques (ampholytes).
Ampholyte : Substance pouvant se comporter à la fois comme un acide et une
base.
Affirmation
3
Non.
Un acide (définition de Bronsted) est une espèce
capable de céder au moins un proton H+.
La molécule formée par libération de proton(s) est une base
Une base est une espèce capable de capter au moins un proton H+.
La molécule formée par capture de proton(s) est un acide.
Voir Définitions Acides & bases
Affirmation
4
Si.
Mais en
quantité très faibles et constant renouvellement.
Solution aqueuse neutre : Autant d’ion OH-,
hydroxyle, que d’ion H3O+, oxonium.
Ions dues à l’autoprotolyse de l’eau et en
quantités très faibles : 1,0 x 10-7 mol.L-1.
Note :
L’ion oxonium, est couramment désigné sous le nom d’ion hydronium.
Page 8.
Pureté de l’eau
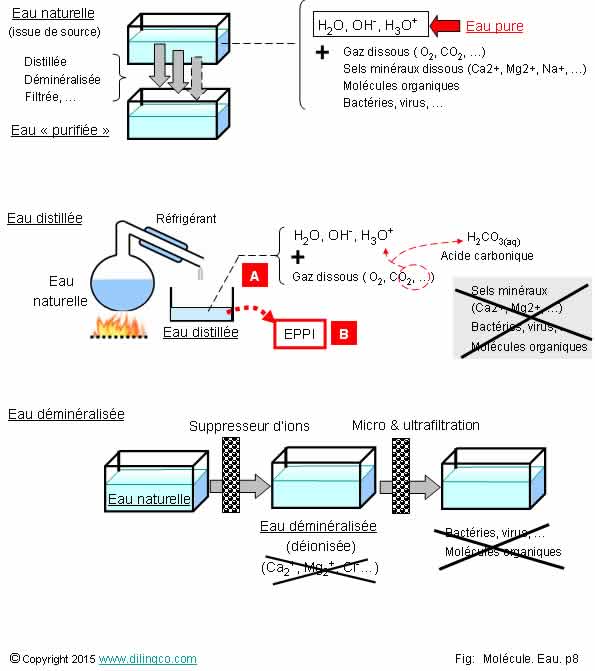
Sélectionner
l’affirmation exacte :
1- L’eau
pure est basique
2- L’eau
pure et l’eau distillée contiennent beaucoup d’ions : forte conductivité
électrique
3- L’osmose,
ou l’échange d’ions, permettent d’obtenir de l’eau distillée
4- L’eau ppi
(pour préparation injectable) est une eau distillée, stérile et à pH neutre
L’affirmation
4 est exacte.
Affirmation
1
Non.
L’eau pure est neutre ou légèrement acide (ph moyen=5,4).
Les
boissons gazeuses sont plus acides.
L’acide
carbonique (bicarbonate acide faible HCO3-), de l’eau provient de la
dissolution du CO2.
Affirmation
2
Non.
La conductivité de l’eau pure, comme celle de l’eau distillée,
sont pratiquement nulles ; très peu d’ions.
Affirmation
3
Non.
L’osmose,
ou l’échange d’ions, permettent de remplacer les ions bivalents par des ions
monovalents de sodium ou de potassium.
L’eau obtenue contient des ions et n’est pas de l’eau distillée, comme le
langage courant le laisserait croire.
Ions
bivalents : 2 charges positives.
Affirmation
4
Oui.
Eau ppi
(pour préparation injectable) : eau distillée, stérile et à pH neutre.
Page 9.
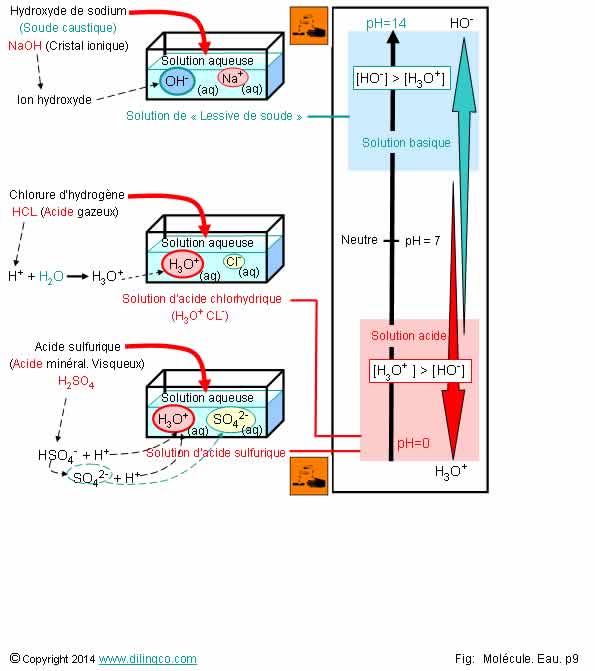
Solutions acides &
basiques
Sélectionner
l’affirmation exacte :
1-
L’acide sulfurique est un électrolyte faible
2- Plus
d’ions oxonium que d’ions hydroxyde = solution basique
3-
L’ajout d’un proton H+ à une molécule d’eau (protonation) peut résulter d’un
acide ou de l’autoprotolyse de l’eau
4-
L’hydroxyde sodium, la soude ou la lessive de soude, ne sont pas corrosifs (Seuls
les acides sont corrosifs ?)
L’affirmation
3 est exacte.
Affirmation
1
Non.
L’acide
sulfurique (vitriol) est un électrolyte
fort : mis en solution aqueuse, il se dissocie totalement
cation H3O+ hydraté et en anion sulfate SO42-
hydraté.
Affirmation
2
Non.
Plus d’ions oxonium H3O+ que d’ions hydroxyde = solution acide.
Ion
oxonium = possibilité de libérer des protons H+.
Affirmation
3
Oui.
Ajout d’un proton H : Protonation.
Dans le
cas présenté, la protonation, est due à un acide.
Molécule
d’eau protonée (ajout H+ ) = Ion oxonium.
Acide : Fournisseur de protons H+.
Affirmation
4
Non.
Attention : Il n’y a pas que les acides qui peuvent être
corrosifs !
Mettre des protections, gants de protection chimique, lunettes, … lorsqu’on
manipule de la soude ou de la lessive de soude.
Page 10.
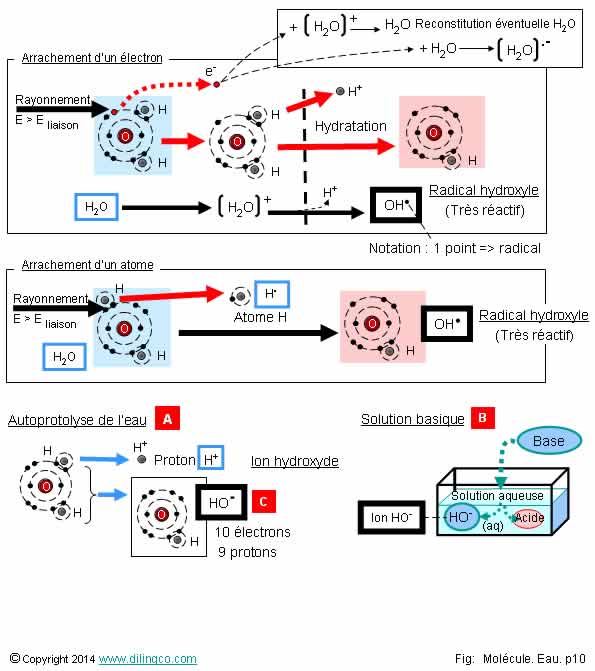
Radical hydroxyle
Sélectionner
les deux affirmations exactes :
1-
Radical hydroxyle et ion hydroxyle : même nombre d’électrons
2-
[A] : Autoprotolyse de l’eau : ion hydroxyle et proton H+
3-
[B] : Solution acide
4-
[C] : Groupement hydroxyle
5- La
radiolyse de l’eau, du sang, sous l’effet de radiations intenses, produit des
radicaux
6- Le
radical hydroxyle est très stable
Les
affirmations 2 et 5 sont exactes.
Voir Ondes
électromagnétiques, Rayonnement ionisant
Affirmation
1
Non.
Radical hydroxyle OH. :
- 9 électrons (et 9 protons),
-
molécule.
Anion hydroxyle HO- :
- 10 électrons
(1 de
plus que de protons)
Note :
Radical :
espèce chimique avec un ou des électrons libres
sur la couche externe.
Affirmation
2
Oui.
[A] :
L’autoprotolyse de l’eau provoque la cycle de création d’ions HO- et
de protons H+ ; protons H+ qui forment H3O+, puis la
recompositions de ces ions en H2O.
Affirmation
3
Non.
[B] :
Solution basique.
La
dissolution d’une base dans une solution aqueuse donne :
- une
solution basique,
- des
ions hydroxyles HO-,
- un
acide conjugué.
Affirmation
4
Non.
[C] :
Anion hydroxyle.
Un groupement
hydroxyle se rencontre dans des molécules organiques telles que les alcools et
les phénols.
Affirmation
5
Oui.
Radiolyse de l’eau : Des radiations intenses peuvent casser une liaison
covalente H-O d’une molécule d’eau, et la décomposer
en radical libre H (atome d’hydrogène) et radical hydroxyle.
Affirmation
6
Si.
Par
nature (ils cherchent à former un doublet sur leur(s) électron(s) libre(s)), les radicaux sont instables.
Le
radical hydroxyle OH. est très réactif, et nocif pour
l’organisme.
Note :
Radical :
espèce chimique avec un ou des électrons libres
sur la couche externe.
Page 11.
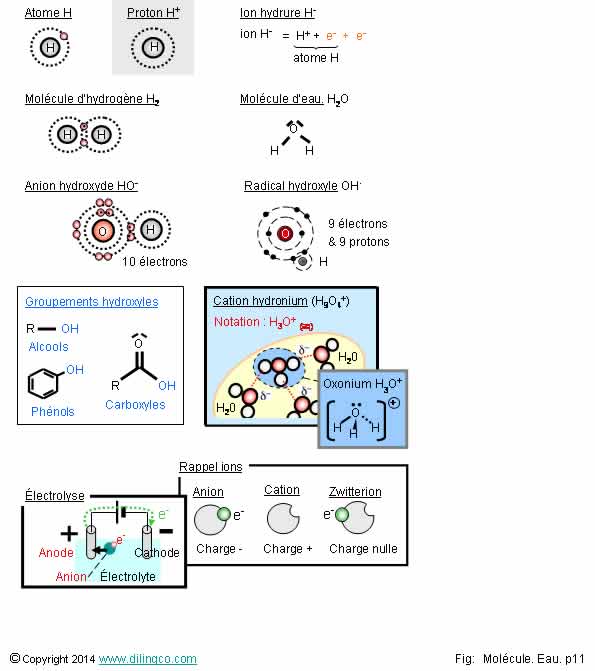
H, OH, H2, H3O
Sélectionner
les deux affirmations exactes :
1- Anion hydroxyde
OH = Groupement hydroxyde OH
2-
L’anion OH- est différent de l’anion HO-
3- Cation
hydronium : Cation oxonium hydraté
4- Proton
hydrogène : Charge négative. Facilement disponible dans les bases et
solutions basiques
5- On
obtient de l’eau (et de l’énergie) par combustion de l’hydrogène
6- Anion
hydroxyle, radical hydroxyle, groupement hydroxyle = même chose
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
Anion OH :
ion hydroxyde d’autoprotolyse de l’eau
ou de solution basique.
Groupement
OH :
- Groupement
hydroxyle,
-
fonction organique oxygénée des alcools, phénols, carboxyles.
Affirmation
2
Non.
Même
chose.
La
notation actuelle HO-, meilleure que la notation précédente OH-,
fait ressortir la charge formelle négative portée par l’oxygène.
Affirmation
4
Non.
Le proton
hydrogène H+ :
- Charge
positive par manque d’un électron,
-
Facilement disponible dans les acides (définition de Bronsted) et dans les
solutions acides.
Affirmation
5
Oui.
On
obtient de l’eau (et de l’énergie) par combustion de l’hydrogène :
2 H2
+ O2 --> 2 H2O + énergie
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Solubilité

Sélectionner les deux affirmations exactes :
1- Un gaz a une forme et un volume propre
2- L’intensité des interactions faibles conditionne le mouvement brownien et l’état gazeux, liquide, ou solide d’un composé chimique
3- Les températures de changement d’états ne sont pas liées aux interactions moléculaires
4- Un seul type de solvant : les solvants organiques
5- Le dipôle des molécule d’eau modifie les interactions faibles des solutés et permettent l’établissement de liaisons hydrogène à faibles énergies
6- La solubilité « s » d’un soluté ne dépend pas de la température
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
Gaz : pas de forme et pas de volume propre.
Liquide : volume propre, pas de forme propre.
Solide : Forme et volumes propres.
Affirmation 2
Oui.
L’intensité des interactions faibles conditionne l’agitation des molécules entre elles.
Agitation des molécule = mouvement brownien.
Les forces d’interaction moléculaires vont de très faibles, pour les éléments gazeux, à fortes, état liquide, et encore plus forte pour les états solides.
La température d’un corps est liée à l’agitation des molécules.
Affirmation 3
Si.
De 2
corps, celui qui a les plus fortes interactions moléculaires a les températures
de changement d’états les plus élevées.
(Température plus élevée pour casser les interactions moléculaires)
Affirmation 4
Non.
L’eau (le sang) est le solvant du vivant.
Il existe de très nombreux solvants classés suivant la molécule, la polarité, les propriétés, le domaine d’utilisation, la toxicité, etc.
Solvants organiques : contient des atomes de carbone.
- Solvants hydrocarbonés aliphatiques (alcanes, alcènes) & aromatiques (Benzène, xylène, …)
- Solvants oxygénés (éthanol, acétone, ..),
- Solvants halogénés (perchloroéthylène, …
Affirmation 5
Oui.
Le moment diélectrique d’une molécule d’eau diminue les interactions faibles du soluté permettant la séparation et la dispersion des atomes du soluté
L’eau est un solvant d’autant plus efficace que ses molécules peuvent former des liaisons moléculaires, des liaisons hydrogènes, avec le soluté.
L’eau est le solvant du vivant.
Affirmation 6
Si.
Plus la température du solvant est élevée, plus il y a de solvant dissous.
Une solution saturée ne peut plus dissoudre de soluté.
La solubilité, s, s’exprime en moles par litre (mol/L), …
Exemple :
S = 0,014 mol.L-1 pour le sulfate d’argent.
Solvant :
- élément chimique très majoritaire d’une solution,
- dissous, dilue, d’autres substances,
- sans modification chimique du soluté, du solvant.
Soluté : élément chimique minoritaire.
Le soluté peut être moléculaire ou ionique.
Concentration : Taux de dissolution ou de mélange de l’élément apporté.
Solution aqueuse : Solvant = eau.
Page 2.
Molécule d’eau

Sélectionner les deux affirmations exactes :
1- [A] : 3 atomes, la molécule d’eau a une géométrie linéaire
2- [B] : 4 électrons de valence (un doublet et 2 électrons célibataires tous sur le niveau 2p)
3- [C] : La molécule d’eau a une géométrie « coudée » à cause des deux doublets non liants de l’atome d’oxygène
4- La molécule d’eau est de type AX2E1
5- La molécule d’eau est polarisée et a une permittivité électrique forte
Les affirmations 3 et 5 sont exactes.
Affirmation 1
[A] : 3 atomes, mais la répulsion apportée par les 2 doublets non liants de l’atome central d’oxygène coude la molécule.
Affirmation 2
Non.
6 électrons de valence : couche 2 = 2s, 2p.
Affirmation 3
Oui.
La répulsion apportée par les 2 doublets non liants modifie la
géométrie de la molécule d’eau.
Molécule d’eau : géométrie
« coudée ».
Affirmation 4
Non.
La géométrie de la molécule d’eau est de type AX2E2
- 1 atome central,
- 2 Atomes périphériques,
- 2 doublets non liants.
Affirmation 5
Oui.
H2O, 3 atomes mais :
- la présence de 2 doublets non liants coudent la molécule,
- les différences d’électronégatrivités OH polarisent les liaisons OH. (Convention des chimistes : vecteur de – à +)
Le
vecteur moment dipolaire de la molécule d’eau, est la somme vectorielle
des moments dipolaires des 2 liaisons.
Le moment dipolaire n’est pas nul : l’eau est
une molécule polarisée.
Constante diélectrique de l’eau : 80. Forte permissivité électrique, divise les forces électrostatiques par 80.
La polarisation des molécules d’eau explique :
- L’attirance électrique des molécules d’eau entre elles,
- La capacité à dissoudre les corps ioniques,
- Le point d’ébullition élevé,
- La plus grande densité de l’eau liquide par rapport à la densité de la glace.
L’eau est le constituant principal des êtres vivants.
L’eau est le solvant du vivant : Tous les organismes vivants sont des systèmes chimiques en phase aqueuse.
Caractéristiques importantes
Les propriétés de l’eau découlent de deux caractéristiques :
- La structure de molécule d’eau conduit à une molécule polarisée,
- La molécule d’eau peut établir des liaisons hydrogène de nature électrostatique
Propriétés principales de l’eau
- Force de cohésion élevée,
- établie des liaisons hydrogène avec des atomes des biomolécules,
- grand pouvoir de solvatation sur les solutés polaires ou ioniques,
- se dissocie en ion oxonium/hydronium H3O+ et en ion hydroxyde OH-
Le pH, fonction du rapport de ces ions, agit sur l’action des enzymes dans l’estomac et l’intestin.
- l’état liquide à une densité supérieure à l’état solide : la glace flotte sur l’eau,
- tension superficielle élevée. Ceci explique la capillarité (la sève monte dans les plantes), ou que des insectes puissent marcher sur l’eau.
Page 3.
Liaison hydrogène

Sélectionner les deux affirmations exactes :
1- Liaison hydrogène : Entre molécules d’eau uniquement
2- L’électronégativité n’entre pas en ligne de compte pour les liaisons hydrogènes
3- La création d’une liaison hydrogène ne nécessite pas la présence d’un doublet d’électrons libres
4- Les molécules d'eau, d'ammoniaque (NH3), ou de fluorure d'hydrogène (HF), peuvent être la source de liaisons hydrogène
5- La fonte de la glace n’est pas d’une réaction chimique
Les affirmations 4 et 5 sont exactes.
Affirmation 1
Non.
Exemple de la figure : Kevlar
Affirmation 4
Oui.
Les atomes d’oxygène, d’azote sont, après
l’atome de fluor, les atomes les plus électronégatifs du tableau périodique.
Les liaisons de ces atomes avec les atomes d’hydrogènes sont fortement polarisées.
Les molécules d’eau entre elles, d’ammoniaques entre elles, ou de fluorure
d’hydrogène peuvent former des liaisons hydrogènes.
Affirmation 5
Exact.
La fonte de la glace provient de la rupture des liaisons hydrogènes. Les liaisons hydrogènes ne sont pas des liaisons covalentes, ne sont pas des liaisons chimiques entre molécules d’eau .
Liaison hydrogène : type interaction dipôle-dipôle.
Conditions de réalisation d’une liaison hydrogène :
- Un atome d’hydrogène lié à un élément très électronégatif dans une des 2 molécules,
- Un élément très électronégatif disposant d’au moins un doublet d’électrons libres dans l’autre molécule.
Page 4.
Hydratation. Hydrolyse

Sélectionner l’affirmation exacte :
1- Solvatation : dissolution d’un soluté dans un solvant. Hydratation : solvatation en solution aqueuse
2- Un minéral ne peut pas être hydraté (Hydraté : absorption d’eau)
3- Tous les alcools organiques (1 carbone lié à un groupement hydroxyle –OH) sont propres à la consommation
4- Hydrolyse d’une molécule = Hydratation d’une molécule organique
L’affirmation 1 est exacte.
Affirmation 1
Oui.
Solvatation : Terme général, dissolution d’un soluté dans un solvant, le solvant peut être autre chose que l’eau.
Hydratation : solvatation aqueuse.
Les molécules d’eau entourent, isolent les atomes du soluté et permettent leurs dispersions.
Solution aqueuse : à base d’eau.
Affirmation 2
Si.
Exemple : CaSO4.2H2O
Le gypse, sulfate dihydraté de calcium, est utilisé, par exemple, pour la fabrication du plâtre.
Contraire de hydraté : déshydratation, assèchement, lyophilisation.
En physiologie, l’hydratation est l’absorption d’eau.
Affirmation 3
Non.
Certains alcools organiques (1 carbone lié à un groupement hydroxyle –OH) sont toxiques.
Affirmation 4
Non.
Le terme hydratation a un sens spécifique en chimie organique.
Hydratation d’une molécule organique = apport d’un groupement hydroxyle sous l’effet de l’eau.
Hydrolyse d’une molécule : rupture d’une liaison moléculaire et création de nouvelles molécules sous l’effet de l’eau.
Hydratation
Addition d’eau.
Déshydratation (ou condensation)
Perte d’une molécule d’eau.
Hydratation d’un composé organique
Ajout d’un hydroxyle et d’un hydrogène sous l’effet de l’eau
Composé organique
Un composé organique a au moins un atome de carbone :
- H2O, H2SO4 ne sont pas des molécules
organiques,
- les autres atomes peuvent êtres des atomes d’hydrogène,
Exemples : CH4, Heptane C7H16, …
- ou sans atomes d’hydrogène : Tétrachloroéthylène (2 carbones & 4 chlores)
Hydrolyse
Coupure d’une molécule sous l’action de l’eau.
Note :
Il existe aussi des hydrolyses chimiques (en milieu acide), et enzymatiques.
Solvatation, hydratation (dispersion)
La solvatation résulte de :
- l’interaction électrostatique de l’eau avec des solutés ionisables,
- l’interaction dipôle-dipôle ou liaisons hydrogènes dans le cas de solutés non ionisables mais polarisés.
Page 5.
Hydrophile. Hydrophobe

Sélectionner l’affirmation exacte :
1- [A] : Le dipôle positif de la molécule d’eau repousse le dipôle négatif du groupements phosphate
2- Les lipoprotéines sont des micelles contenant des lipides
3- Les vitamines sont hydrosolubles. Pas de vitamines liposolubles
4- Les
bicouches lipidiques des membranes cellulaires sont rigides, imperméables,
n’incluent pas de protéines ou de cholestérol
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A] : Le dipôle positif de la molécule d’eau attire le dipôle négatif du groupements phosphate des phospholipides.
Affirmation 3
Non.
Les vitamines des groupes B et C sont hydrosolubles.
Les vitamines des groupes A, D, E et K, sont liposolubles.
Affirmation 4
Non.
Les bicouches lipidiques des membranes cellulaires :
- ne sont pas rigides,
- permettent la diffusion et le transport passif ou actif d’éléments,
- incluent
diverses protéines et cholestérols.
.
Micelle
(Figure : Représentation en coupe)
Une micelle est un agrégat sphérique de molécules amphiphiles.
Les têtes hydrophiles sont dirigées vers l’extérieur, vers le solvant ; les chaînes hydrophobes sont dirigées vers l’intérieur de la micelle.
La taille des vésicules micelles est de l’ordre de 0,001 à 0,3 micron.
Amphiphile : hydrophile ou hydrophobe à la fois (suivant le cas).
Liposome
Même principe de création que les micelles mais l’agrégat est formé de bicouches graisseuses concentriques.
Lipoprotéine :
- noyau hydrophobe (lipides insolubles dans le sang),
- noyau enrobé dans une coque recouverte de groupement polaires hydrophiles,
- permet l’acheminement par le système sanguin d’éléments insolubles,
- voir Lipoprotéines, Circulation des lipoprotéines
Page 6.
Electrolyte. Electrolyse

Sélectionner l’affirmation exacte :
1- Une solution électrolytique ne laisse pas passer le courant électrique
2- Tous les électrolytes sont liquides
3- Les électrolytes s’hydrolysent par dissociation moléculaire dans l’eau
4- Une solution électrolytique peut être électrolysée pour séparer des éléments chimiques
L’affirmation 4 est exacte.
Affirmation 1
Si.
Solution électrolytique :
(« Électrolytique » fait référence à l’électricité)
- contient des ions,
- laisse passer le courant électrique.
Affirmation 2
Non.
Exemples : certains cristaux et polymères
(Polymères des membranes de filtration ionique)
Affirmation 3
Non.
Les électrolytes se dissocient par dissolution ionique.
Note :
Hydrolyse : dissociation moléculaire dans l’eau par coupure de liaisons
peptidiques.
Hydrolyse du saccharose = glucose et fructose.
Hydrolyse
d’un ester = alcool et acide
(Réaction inverse : esthérification)
Page 7.
Autoprotolyse

Sélectionner les deux affirmations exactes :
1- Autoprotolyse : Transfert de proton H+ entre molécules différentes
2- Ion hydronium = ion oxonium solvaté par 3 molécule d’eau
3- [A] : Un acide est une espèce capable de capter un proton H+
4- [B] : Pas d’ion hydroxyde ni d’ion hydronium dans une solution aqueuse neutre (pH de 7)
5- En solution aqueuse, protons H+, ions hydroxyde, ions oxonium ont une durée très courte. Les quantités sont négligeables par rapport aux molécules d’eau
6- L’eau n’est pas une molécule ampholyte
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
Autoprotolyse : Transfert de proton H+ entre 2 molécules identiques (ampholytes).
Ampholyte : Substance pouvant se comporter à la fois comme un acide et une base.
Affirmation 3
Non.
Un acide (définition de Bronsted) est une espèce capable de céder au moins un proton H+.
La molécule formée par libération de proton(s) est une base
Une base est une espèce capable de capter au moins un proton H+.
La molécule formée par capture de proton(s) est un acide.
Voir Définitions Acides & bases
Affirmation 4
Si.
Mais en quantité très faibles et constant renouvellement.
Solution aqueuse neutre : Autant d’ion OH-, hydroxyle, que d’ion H3O+, oxonium.
Ions dues à l’autoprotolyse de l’eau et en quantités très faibles : 1,0 x 10-7 mol.L-1.
Note :
L’ion oxonium, est couramment désigné sous le nom d’ion hydronium.
Page 8.
Pureté de l’eau

Sélectionner l’affirmation exacte :
1- L’eau pure est basique
2- L’eau pure et l’eau distillée contiennent beaucoup d’ions : forte conductivité électrique
3- L’osmose, ou l’échange d’ions, permettent d’obtenir de l’eau distillée
4- L’eau ppi (pour préparation injectable) est une eau distillée, stérile et à pH neutre
L’affirmation 4 est exacte.
Affirmation 1
Non.
L’eau pure est neutre ou légèrement acide (ph moyen=5,4).
Les boissons gazeuses sont plus acides.
L’acide carbonique (bicarbonate acide faible HCO3-), de l’eau provient de la dissolution du CO2.
Affirmation 2
Non.
La conductivité de l’eau pure, comme celle de l’eau distillée, sont pratiquement nulles ; très peu d’ions.
Affirmation 3
Non.
L’osmose,
ou l’échange d’ions, permettent de remplacer les ions bivalents par des ions
monovalents de sodium ou de potassium.
L’eau obtenue contient des ions et n’est pas de l’eau distillée, comme le
langage courant le laisserait croire.
Ions bivalents : 2 charges positives.
Affirmation 4
Oui.
Eau ppi
(pour préparation injectable) : eau distillée, stérile et à pH neutre.
Page 9.
Solutions acides & basiques

Sélectionner l’affirmation exacte :
1- L’acide sulfurique est un électrolyte faible
2- Plus d’ions oxonium que d’ions hydroxyde = solution basique
3- L’ajout d’un proton H+ à une molécule d’eau (protonation) peut résulter d’un acide ou de l’autoprotolyse de l’eau
4- L’hydroxyde sodium, la soude ou la lessive de soude, ne sont pas corrosifs (Seuls les acides sont corrosifs ?)
L’affirmation 3 est exacte.
Affirmation 1
Non.
L’acide sulfurique (vitriol) est un électrolyte fort : mis en solution aqueuse, il se dissocie totalement cation H3O+ hydraté et en anion sulfate SO42- hydraté.
Affirmation 2
Non.
Plus d’ions oxonium H3O+ que d’ions hydroxyde = solution acide.
Ion oxonium = possibilité de libérer des protons H+.
Affirmation 3
Oui.
Ajout d’un proton H : Protonation.
Dans le cas présenté, la protonation, est due à un acide.
Molécule d’eau protonée (ajout H+ ) = Ion oxonium.
Acide : Fournisseur de protons H+.
Affirmation 4
Non.
Attention : Il n’y a pas que les acides qui peuvent être corrosifs !
Mettre des protections, gants de protection chimique, lunettes, … lorsqu’on manipule de la soude ou de la lessive de soude.
Page 10.
Radical hydroxyle

Sélectionner les deux affirmations exactes :
1- Radical hydroxyle et ion hydroxyle : même nombre d’électrons
2- [A] : Autoprotolyse de l’eau : ion hydroxyle et proton H+
3- [B] : Solution acide
4- [C] : Groupement hydroxyle
5- La radiolyse de l’eau, du sang, sous l’effet de radiations intenses, produit des radicaux
6- Le radical hydroxyle est très stable
Les affirmations 2 et 5 sont exactes.
Voir Ondes électromagnétiques, Rayonnement ionisant
Affirmation 1
Non.
Radical hydroxyle OH. :
- 9 électrons (et 9 protons),
- molécule.
Anion hydroxyle HO- :
- 10 électrons
(1 de plus que de protons)
Note :
Radical : espèce chimique avec un ou des électrons libres sur la couche externe.
Affirmation 2
Oui.
[A] : L’autoprotolyse de l’eau provoque la cycle de création d’ions HO- et de protons H+ ; protons H+ qui forment H3O+, puis la recompositions de ces ions en H2O.
Affirmation 3
Non.
[B] : Solution basique.
La dissolution d’une base dans une solution aqueuse donne :
- une solution basique,
- des ions hydroxyles HO-,
- un acide conjugué.
Affirmation 4
Non.
[C] : Anion hydroxyle.
Un groupement hydroxyle se rencontre dans des molécules organiques telles que les alcools et les phénols.
Affirmation 5
Oui.
Radiolyse de l’eau : Des radiations intenses peuvent casser une liaison covalente H-O d’une molécule d’eau, et la décomposer en radical libre H (atome d’hydrogène) et radical hydroxyle.
Affirmation 6
Si.
Par nature (ils cherchent à former un doublet sur leur(s) électron(s) libre(s)), les radicaux sont instables.
Le radical hydroxyle OH. est très réactif, et nocif pour l’organisme.
Note :
Radical : espèce chimique avec un ou des électrons libres sur la couche externe.
Page 11.
H, OH, H2, H3O

Sélectionner les deux affirmations exactes :
1- Anion hydroxyde OH = Groupement hydroxyde OH
2- L’anion OH- est différent de l’anion HO-
3- Cation hydronium : Cation oxonium hydraté
4- Proton hydrogène : Charge négative. Facilement disponible dans les bases et solutions basiques
5- On obtient de l’eau (et de l’énergie) par combustion de l’hydrogène
6- Anion hydroxyle, radical hydroxyle, groupement hydroxyle = même chose
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Anion OH : ion hydroxyde d’autoprotolyse de l’eau ou de solution basique.
Groupement OH :
- Groupement hydroxyle,
- fonction organique oxygénée des alcools, phénols, carboxyles.
Affirmation 2
Non.
Même chose.
La notation actuelle HO-, meilleure que la notation précédente OH-, fait ressortir la charge formelle négative portée par l’oxygène.
Affirmation 4
Non.
Le proton hydrogène H+ :
- Charge positive par manque d’un électron,
- Facilement disponible dans les acides (définition de Bronsted) et dans les solutions acides.
Affirmation 5
Oui.
On obtient de l’eau (et de l’énergie) par combustion de l’hydrogène :
2 H2 + O2 --> 2 H2O + énergie