Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Répulsions
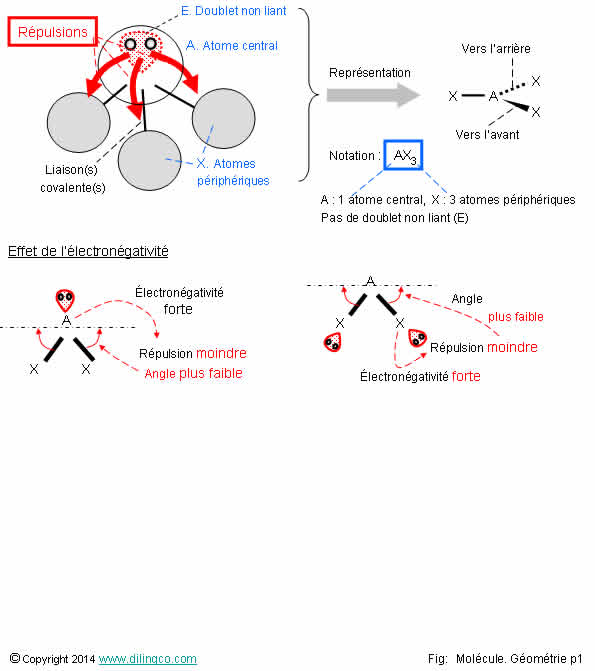
Sélectionner les deux affirmations exactes :
1- VSEPR : Théorie pour prédire la stéréochimie d’une
molécule. Théorie basée sur les répulsions des paires d’électrons de la couche
de valence
2- Les doublets liants et non liants de l’atome central se
positionnent sur les lieux de répulsions les plus fortes
3- Plus l’atome central est électronégatif, plus l’angle atome central/atome
périphérique est faible
4- Les électrons appartenant à des doublets différents s’attirent
5- La stéréochimie d’une molécule n’a pas de conséquence sur ses
propriétés
Les affirmations 1 et 3 sont exactes.
Affirmation 1
Oui.
VSEPR : Valence Shell Electron Pairs Repulsion.
Théorie :
- pour prédire la géométrie d’une molécule,
- basée sur les répulsions des paires d’électrons de la couche de
valence,
- aussi connue sous le nom « théorie de Gillespie ».
Stéréochimie : arrangement dans l’espace des atomes d’une molécule.
Représentation de Cram : Donald James Cram,
chimiste américain.
Représentation dans l’espace des atomes d’une molécule.
Affirmation 2
Non.
Les doublets liants et non liants de l’atome central se
positionnent sur les lieux de répulsions les plus faibles.
Affirmation3
Oui.
Plus l’atome central est électronégatif, plus il retient les
électrons et donc :
- plus les répulsions des doublets non liants sur les liaisons
covalentes sont faibles,
- plus l’angle atome central/atome périphérique est faible.
Note :
Même raisonnement pour l’électronégativité des atomes des atomes
périphériques : Leurs doublets non liants ont moins d’influence relative,
repoussent moins les liaisons covalentes, si l’atome périphérique est très
électronégatif.
Affirmation 4
Non.
Les électrons appartenant à des doublets différents se repoussent.
Affirmation 5
Si.
La stéréochimie d’une molécule influence ses propriétés.
Par exemple, une molécule linéaire, où les atomes sont alignés, et
une molécule coudée avec un moment dipolaire n’ont pas la même solubilité dans
l’eau.
Le moment dipolaire de la molécule coudée et le moment dipolaire
de l’eau s’attirent.
Page 2.
Géométries de base
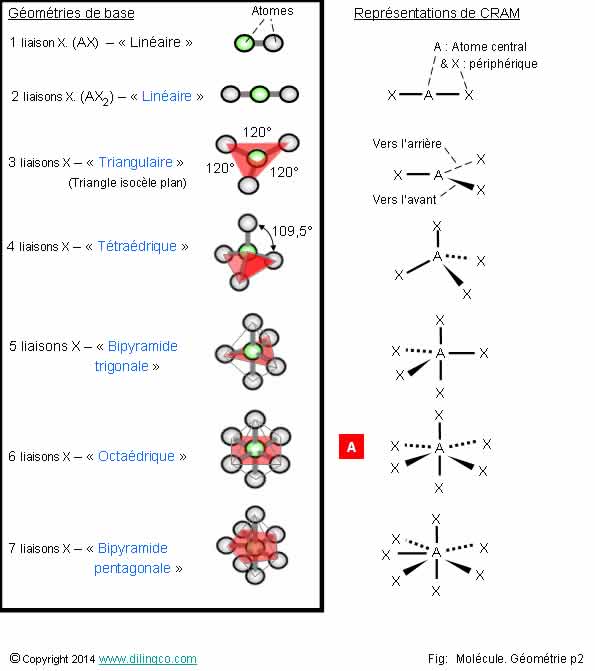
Sélectionner l’affirmation exacte :
1- [A] : Représentation de CRAM d’une molécule
octaédrique : 1 trait en pointillé (vers l’arrière), 2 traits vers l’avant
(traits épaissis)
2- Une molécule AX2 et une molécule AX2E1 sont des molécules linéaires
3- AX7 : Bi pyramide trigonale
4- Géométrie : Trouver la formule de Lewis, trouver l’atome
central, trouver le nombre de liaisons, trouver le nombre de directions, en
déduire la figure de base
L’affirmation 4 est exacte.
Affirmation 1
Non.
[A] :
Molécule octaédrique : 6 atomes périphériques.
4 atomes sur le même plan : 2 atomes vers l’avant (Traits forts),
2 vers l’arrière (traits en pointillés).
Représentation de Cram : Donald James Cram, chimiste
américain.
Représentation dans l’espace d’une molécule.
Affirmation 2
Non.
AX2E1 est une molécule coudée : Les électrons du
doublet non liant repoussent les doublets liants.
AX2 est une molécule linéaire.
Affirmation 3
Non.
AX7 : 7 atomes périphériques dont 5 disposés en pentagone
sur le même plan. « 2 pyramides pentagonales ».
Affirmation 4
Oui.
Savoir trouver une représentation de Lewis
Vérifier la règle de l’octet.
Trouver le nombre de directions.
Connaître les principales figures géométriques :
AX2 : Linéaire.
AX3 : Triangulaire.
AX4 : Tétraédrique.
AX5 : Bi pyramide trigonale.
AX6 : Octaédrique.
AX7 : Bipyramide pentagonale.
Page 3.
Approximations
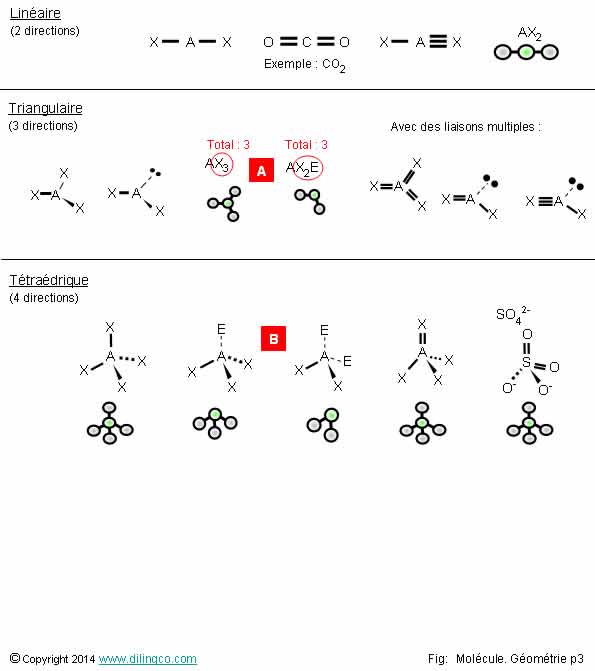
Sélectionner les deux affirmations exactes :
1- En première approximation pour déterminer la géométrie
d’une molécule : une liaison covalente multiple constitue une même direction
2- Trouver la forme de Lewis n’est pas utile pour déterminer la géométrie
d’une molécule
3- [A] : Une molécule A+2 X+E et une molécule A + 3 X ont la
même forme géométrique
4- [B] : En première approximation pour déterminer la
géométrie d’une molécule : un doublet non liant constitue une direction
5- Triangulaire (3 directions) = forcément 3 atomes périphériques
et des liaisons covalentes simples
Les affirmations 1 et 4 sont exactes.
Affirmation 2
Si.
Exemple : CO2
1- Trouver la représentation de Lewis.
La représentation de Lewis donne les électrons de la couche de
valence :
C=6 électrons, 4 électrons de valence,
O=8 électrons, 2 électrons de valence.
Voir Classification périodique
Trouver l’atome central : C
Dessiner la forme de Lewis en plaçant les liaisons covalentes et
les doublets non liants.
2- Compter le nombre de liaisons (simple ou multiple) et de
doublets non liants.
CO2 total : 2 doubles liaisons, pas de doublet non
liant = molécule linéaire
Affirmation 3
Non.
[A] :
Molécule AX2E : 1 atome central + 2 doublets
liants + 1 doublet non liant = Molécule coudée.
Affirmation 4
Oui.
[B] :
En première approximation pour déterminer la géométrie d’une
molécule : un doublet non liant constitue une direction.
Le doublet non liant n’apparaît pas dans la représentation
physique, par atomes, de la molécule.
Des molécules avec :
- 4 liaisons covalentes,
- 3 liaisons covalentes et un doublet non liant,
- 2 liaisons covalentes et 2 doublets non liants,
ont 4 directions en représentations de CRAM mais pas les mêmes formes
physiques, tétraédrique, pyramidale, coudée.
Affirmation 5
Non.
Triangulaire (3 directions) s’applique à la manière de trouver la
représentation de CRAM, pas à la forme géométrique de la molécule.
Le cas « triangulaire » :
- peut inclure des doublets non liants et des liaisons simples ou
multiples.
- peut donner une molécule triangulaire ou une molécule coudée.
Géométrie & directions
La représentation de CRAM d’une molécules est fonction du
« nombre de directions » entre l’atome central et les atomes périphériques.
Une « direction » en représentation de CRAM peut être :
- Un doublet non liant,
- Un ou de plusieurs doublet(s) liant(s).
La
notation est :
AXyEz
A :
Atome central,
X :
Atome périphérique, y=nombre d’atomes,
E : Doublets non liants de l’atome central, z=nombre de doublets non
liants.
Exemples :
BrF5 type AX5E1.
Un atome
central de brome entouré de 5 atomes de fluor ; l’atome de fluor a un
doublet non liant.
XeF4 type AX4E2
Conventions de représentation:
- Liaisons situées dans le plan de la page : traits pleins,
- Liaisons situées en avant du plan de la page : traits épaissis,
- Liaisons situées en arrière du plan de la
page : traits pointillés.
Page 4.
Exemples
F,
Fluor : Z=9
S, Soufre : z=16
I, Iode:
Z=53
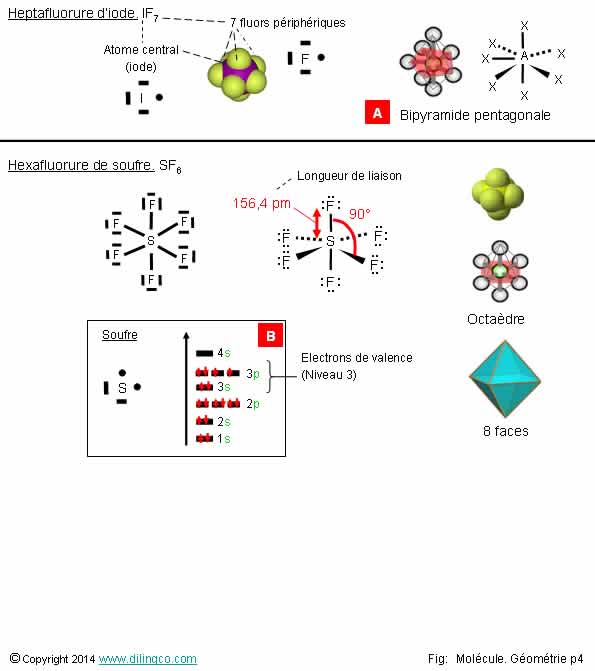
Sélectionner
les deux affirmations exactes :
1-
[A] : Octaèdre
2-
[B] : 4 électrons de valence
3-
Octaèdre : 8 faces
4- Le
fluor, deuxième période du tableau périodique, peut avoir plus de 8 électrons
de valence
5- Fluor : élément chimique le plus électronégatif, le plus
réactif
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
[A] :
Bipyramide pentagonale
Affirmation
2
Non.
[B] :
Niveau d’énergie 3, le plus élevé ; 6 atomes de valence.
Affirmation
3
Oui.
Octaèdre : 8 faces.
2 électrons sommets,
4 électrons sur un même plan.
Affirmation
4
Non.
Les
atomes de la deuxième période du tableau périodique respectent strictement la règle
de l’octet.
Affirmation 5
Oui.
Fluor : élément chimique le plus électronégatif du tableau
périodique, le plus réactif.
Page 5.
Occupation de l’espace
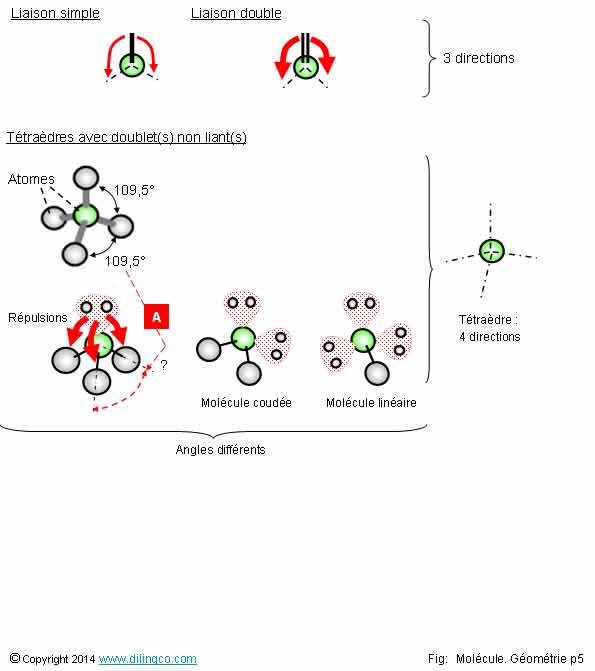
Sélectionner
l’affirmation exacte :
1- Une
liaison multiple occupe moins d’espace qu’une liaison simple
(La
répulsion vers les autres liaisons est moindre)
2- Un
doublet non liant occupe moins d’espace qu’une liaison simple
3- Les angles
entre les directions dépendent du nombre de directions mais aussi de la
présence de doublets non liants et de liaisons multiples
4-
L’angle en [A] est aussi de 109,5 degrés (Le doublet non liant n’a pas plus
d’influence qu’une liaison covalente simple)
L’affirmation
3 est exacte.
Page 6.
Géométrie vectorielle
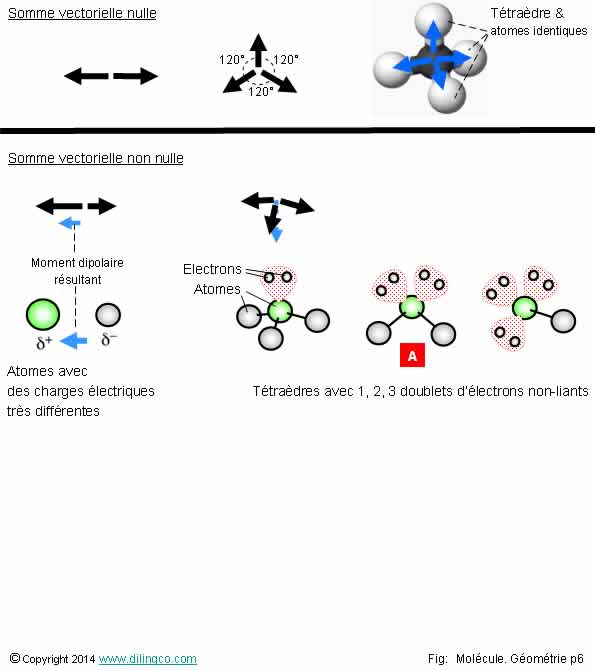
Sélectionner
l’affirmation exacte :
1- La
géométrie d’une molécule n’a pas d’influence sur le moment dipolaire somme des
moments de chaque liaison
2- Molécule
tétraèdre avec des atomes externes identiques : Molécule apolaire (Charge
électrique résultante nulle)
3- Moment
dipolaire d’une liaison : ne dépend pas des charges électriques des atomes
de la liaison
4- [A] :
molécule apolaire (moment dipolaire résultant nul)
L’affirmation
2 est exacte.
Affirmation
2
Oui.
Le moment dipolaire
(électrique) d’une molécule est la somme
vectorielle des moments de chaque liaison atomique.
Une
molécule tétraèdre, avec des atomes externes identiques, est apolaire :
Charge électrique résultante nulle.
Affirmation
3
Si.
Par
convention des chimistes, un moment dipolaire est représenté de la charge – à
la charge +.
Page 7.
Electronégativité & Polarités
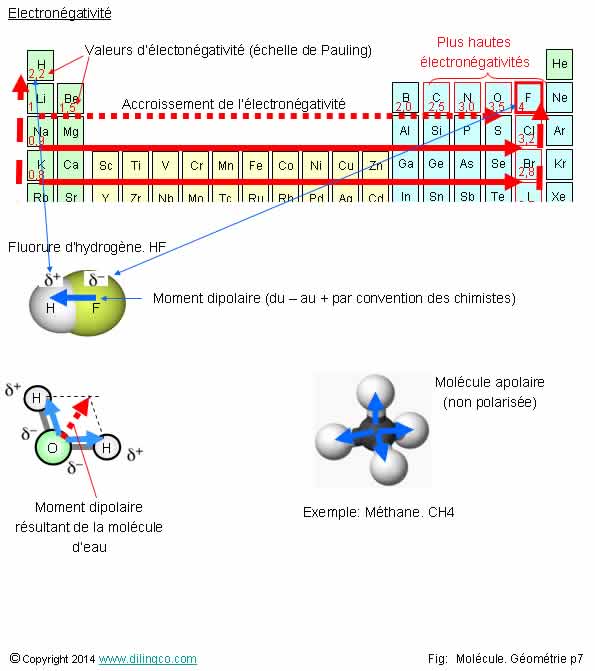
Sélectionner
l’affirmation exacte :
1- Connaître
la géométrie d’une molécule n’est pas utile pour en déterminer sa polarité
2- Une
molécule de géométrie linéaire est forcément apolaire
3- La
molécule d’eau est polarisée
4- Le
fluor n’est pas très réactif
L’affirmation
3 est exacte.
Affirmation
2
Non.
Exemple :
HF, Fluorure d’hydrogène.
La très
grande différence d’électronégativité
entre les deux atomes rend la molécule HF
polarisée et chimiquement très réactive.
Affirmation
3
Oui.
Molécule
d’eau, H2O. 3 atomes mais :
- la
présence de 2 doublets non liants coudent la molécule,
- les
différences d’électronégativités OH polarisent les liaisons OH. (Convention des
chimistes : vecteur de – à +)
Le
vecteur moment dipolaire de la molécule d’eau, est la somme vectorielle
des moments dipolaires des 2 liaisons.
Le moment dipolaire n’est pas nul : l’eau est
une molécule polarisée.
Affirmation
4
Si.
Le fluor :
- élément le plus électronégatif du tableau périodique,
- très réactif.
Le fluor
se rencontre très souvent associé à d’autres atomes.
La
polarité d’une molécule découle de :
- L’électronégativité de ses composants,
- Sa géométrie spatiale.
Page 8.
Géométrie & Hybridation
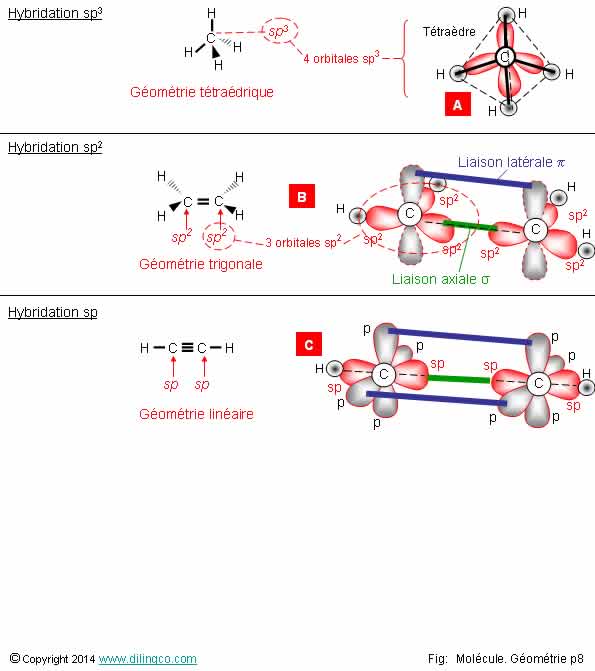
Sélectionner
l’affirmation exacte :
1-
[A] : 4 orbitales Hybridées = hybridation sp4
2-
[B] : 1 double liaison entre les 2 atomes de carbone
3-
[B] : Géométrie linéaire (tous les atomes sont alignés)
4-
[C] : Toutes les orbitales p sont utilisées
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A] :
4 orbitales Hybridées = hybridation sp3
Affirmation
4
Non.
[C] :
3 orbitale p. Une orbitale p n’est pas utilisée
Types d’OA hybridées sp3, sp2, sp
Voir
hybridation
Hybridation
sp3 :
-
Combinaison d’une orbitale s et de 3 orbitales
p (d’où l’exposant 3).
- Résultat : quatre orbitales sp situées sur un même niveau d’énergie.
-
Géométrie : tétraédrique.
- Angles
entre OA sp3 : 109,5°
Hybridation
sp2 :
-
Combinaison d’une orbitale s et de 2 orbitales p.
-
Résultat : trois orbitales sp et une OA p non hybridée,
Les
orbitales sp et p sont situées sur un même niveau d’énergie.
-
Géométrie : trigonale.
- Angles
entre OA sp2 : 120°
Hybridation
sp :
-
Combinaison d’une orbitale s et d’une orbitale p.
-
Résultat : deux orbitales sp et deux OA p
non hybridées situées sur un même niveau d’énergie.
-
Géométrie : linéaire.
- Angles
entre OA sp : 180°
Page 9.
Carbanions &
Carbocations
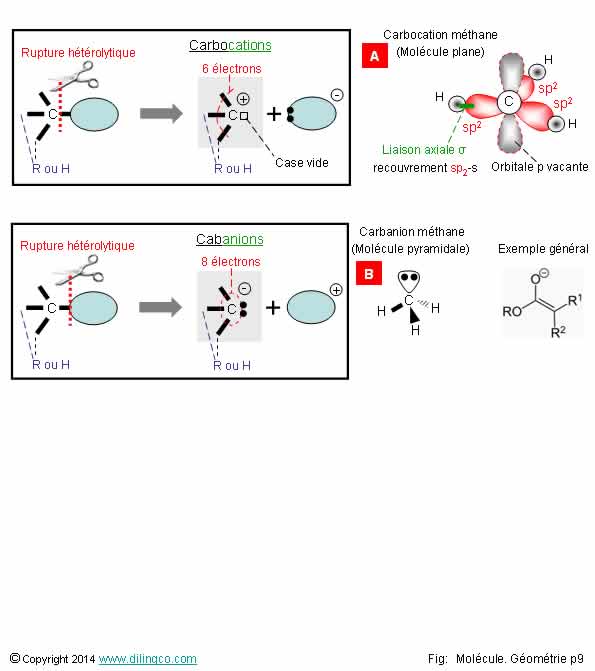
Sélectionner
l’affirmation exacte :
1- Les carbanions,
les carbocations, sont des intermédiaires de réaction en chimie minérale
2-
Rupture hétérolytique d’une liaison covalente : rupture symétrique
3-
[A] : les carbocations sont des molécules planes
3-
[B] : les carbanions sont des molécules planes
L’affirmation
3 est exacte.
Affirmation
1
Non.
Carbanions,
carbocations : Carbone => chimie minérale
Carbocations, cations (charge positive qui les rend
instables).
Carbanions, anions (charge négative qui les rend
instables).
Les
carbocations, les carbanions, sont des intermédiaires de réaction dans des
réactions de chimie organique.
Intermédiaires de réaction : ions ou molécules instables, de courtes durées de
vie, qui apparaissent temporairement au cours
d’une réaction chimique complexe.
Affirmation
2
Non.
Homolytique : partage symétrique des électrons du doublet rompu.
Hétérolytique :
partage non symétrique
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Répulsions

Sélectionner les deux affirmations exactes :
1- VSEPR : Théorie pour prédire la stéréochimie d’une molécule. Théorie basée sur les répulsions des paires d’électrons de la couche de valence
2- Les doublets liants et non liants de l’atome central se positionnent sur les lieux de répulsions les plus fortes
3- Plus l’atome central est électronégatif, plus l’angle atome central/atome périphérique est faible
4- Les électrons appartenant à des doublets différents s’attirent
5- La stéréochimie d’une molécule n’a pas de conséquence sur ses propriétés
Les affirmations 1 et 3 sont exactes.
Affirmation 1
Oui.
VSEPR : Valence Shell Electron Pairs Repulsion.
Théorie :
- pour prédire la géométrie d’une molécule,
- basée sur les répulsions des paires d’électrons de la couche de valence,
- aussi connue sous le nom « théorie de Gillespie ».
Stéréochimie : arrangement dans l’espace des atomes d’une molécule.
Représentation de Cram : Donald James Cram, chimiste américain.
Représentation dans l’espace des atomes d’une molécule.
Affirmation 2
Non.
Les doublets liants et non liants de l’atome central se positionnent sur les lieux de répulsions les plus faibles.
Affirmation3
Oui.
Plus l’atome central est électronégatif, plus il retient les électrons et donc :
- plus les répulsions des doublets non liants sur les liaisons covalentes sont faibles,
- plus l’angle atome central/atome périphérique est faible.
Note :
Même raisonnement pour l’électronégativité des atomes des atomes périphériques : Leurs doublets non liants ont moins d’influence relative, repoussent moins les liaisons covalentes, si l’atome périphérique est très électronégatif.
Affirmation 4
Non.
Les électrons appartenant à des doublets différents se repoussent.
Affirmation 5
Si.
La stéréochimie d’une molécule influence ses propriétés.
Par exemple, une molécule linéaire, où les atomes sont alignés, et une molécule coudée avec un moment dipolaire n’ont pas la même solubilité dans l’eau.
Le moment dipolaire de la molécule coudée et le moment dipolaire de l’eau s’attirent.
Page 2.
Géométries de base

Sélectionner l’affirmation exacte :
1- [A] : Représentation de CRAM d’une molécule octaédrique : 1 trait en pointillé (vers l’arrière), 2 traits vers l’avant (traits épaissis)
2- Une molécule AX2 et une molécule AX2E1 sont des molécules linéaires
3- AX7 : Bi pyramide trigonale
4- Géométrie : Trouver la formule de Lewis, trouver l’atome central, trouver le nombre de liaisons, trouver le nombre de directions, en déduire la figure de base
L’affirmation 4 est exacte.
Affirmation 1
Non.
[A] :
Molécule octaédrique : 6 atomes périphériques.
4 atomes sur le même plan : 2 atomes vers l’avant (Traits forts), 2 vers l’arrière (traits en pointillés).
Représentation de Cram : Donald James Cram, chimiste américain.
Représentation dans l’espace d’une molécule.
Affirmation 2
Non.
AX2E1 est une molécule coudée : Les électrons du doublet non liant repoussent les doublets liants.
AX2 est une molécule linéaire.
Affirmation 3
Non.
AX7 : 7 atomes périphériques dont 5 disposés en pentagone sur le même plan. « 2 pyramides pentagonales ».
Affirmation 4
Oui.
Savoir trouver une représentation de Lewis
Vérifier la règle de l’octet.
Trouver le nombre de directions.
Connaître les principales figures géométriques :
AX2 : Linéaire.
AX3 : Triangulaire.
AX4 : Tétraédrique.
AX5 : Bi pyramide trigonale.
AX6 : Octaédrique.
AX7 : Bipyramide pentagonale.
Page 3.
Approximations

Sélectionner les deux affirmations exactes :
1- En première approximation pour déterminer la géométrie d’une molécule : une liaison covalente multiple constitue une même direction
2- Trouver la forme de Lewis n’est pas utile pour déterminer la géométrie d’une molécule
3- [A] : Une molécule A+2 X+E et une molécule A + 3 X ont la même forme géométrique
4- [B] : En première approximation pour déterminer la géométrie d’une molécule : un doublet non liant constitue une direction
5- Triangulaire (3 directions) = forcément 3 atomes périphériques et des liaisons covalentes simples
Les affirmations 1 et 4 sont exactes.
Affirmation 2
Si.
Exemple : CO2
1- Trouver la représentation de Lewis.
La représentation de Lewis donne les électrons de la couche de valence :
C=6 électrons, 4 électrons de valence,
O=8 électrons, 2 électrons de valence.
Voir Classification périodique
Trouver l’atome central : C
Dessiner la forme de Lewis en plaçant les liaisons covalentes et les doublets non liants.
2- Compter le nombre de liaisons (simple ou multiple) et de doublets non liants.
CO2 total : 2 doubles liaisons, pas de doublet non liant = molécule linéaire
Affirmation 3
Non.
[A] :
Molécule AX2E : 1 atome central + 2 doublets liants + 1 doublet non liant = Molécule coudée.
Affirmation 4
Oui.
[B] :
En première approximation pour déterminer la géométrie d’une molécule : un doublet non liant constitue une direction.
Le doublet non liant n’apparaît pas dans la représentation physique, par atomes, de la molécule.
Des molécules avec :
- 4 liaisons covalentes,
- 3 liaisons covalentes et un doublet non liant,
- 2 liaisons covalentes et 2 doublets non liants,
ont 4 directions en représentations de CRAM mais pas les mêmes formes physiques, tétraédrique, pyramidale, coudée.
Affirmation 5
Non.
Triangulaire (3 directions) s’applique à la manière de trouver la représentation de CRAM, pas à la forme géométrique de la molécule.
Le cas « triangulaire » :
- peut inclure des doublets non liants et des liaisons simples ou multiples.
- peut donner une molécule triangulaire ou une molécule coudée.
Géométrie & directions
La représentation de CRAM d’une molécules est fonction du « nombre de directions » entre l’atome central et les atomes périphériques.
Une « direction » en représentation de CRAM peut être :
- Un doublet non liant,
- Un ou de plusieurs doublet(s) liant(s).
La notation est :
AXyEz
A : Atome central,
X :
Atome périphérique, y=nombre d’atomes,
E : Doublets non liants de l’atome central, z=nombre de doublets non
liants.
Exemples :
BrF5 type AX5E1.
Un atome central de brome entouré de 5 atomes de fluor ; l’atome de fluor a un doublet non liant.
XeF4 type AX4E2
Conventions de représentation:
- Liaisons situées dans le plan de la page : traits pleins,
- Liaisons situées en avant du plan de la page : traits épaissis,
- Liaisons situées en arrière du plan de la page : traits pointillés.
Page 4.
Exemples
F,
Fluor : Z=9
S, Soufre : z=16
I, Iode: Z=53

Sélectionner les deux affirmations exactes :
1- [A] : Octaèdre
2- [B] : 4 électrons de valence
3- Octaèdre : 8 faces
4- Le fluor, deuxième période du tableau périodique, peut avoir plus de 8 électrons de valence
5- Fluor : élément chimique le plus électronégatif, le plus réactif
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
[A] : Bipyramide pentagonale
Affirmation 2
Non.
[B] : Niveau d’énergie 3, le plus élevé ; 6 atomes de valence.
Affirmation 3
Oui.
Octaèdre : 8 faces.
2 électrons sommets,
4 électrons sur un même plan.
Affirmation 4
Non.
Les atomes de la deuxième période du tableau périodique respectent strictement la règle de l’octet.
Affirmation 5
Oui.
Fluor : élément chimique le plus électronégatif du tableau périodique, le plus réactif.
Page 5.
Occupation de l’espace

Sélectionner l’affirmation exacte :
1- Une liaison multiple occupe moins d’espace qu’une liaison simple
(La répulsion vers les autres liaisons est moindre)
2- Un doublet non liant occupe moins d’espace qu’une liaison simple
3- Les angles entre les directions dépendent du nombre de directions mais aussi de la présence de doublets non liants et de liaisons multiples
4- L’angle en [A] est aussi de 109,5 degrés (Le doublet non liant n’a pas plus d’influence qu’une liaison covalente simple)
L’affirmation 3 est exacte.
Page 6.
Géométrie vectorielle

Sélectionner l’affirmation exacte :
1- La géométrie d’une molécule n’a pas d’influence sur le moment dipolaire somme des moments de chaque liaison
2- Molécule tétraèdre avec des atomes externes identiques : Molécule apolaire (Charge électrique résultante nulle)
3- Moment dipolaire d’une liaison : ne dépend pas des charges électriques des atomes de la liaison
4- [A] : molécule apolaire (moment dipolaire résultant nul)
L’affirmation 2 est exacte.
Affirmation 2
Oui.
Le moment dipolaire (électrique) d’une molécule est la somme vectorielle des moments de chaque liaison atomique.
Une molécule tétraèdre, avec des atomes externes identiques, est apolaire : Charge électrique résultante nulle.
Affirmation 3
Si.
Par convention des chimistes, un moment dipolaire est représenté de la charge – à la charge +.
Page 7.
Electronégativité & Polarités

Sélectionner l’affirmation exacte :
1- Connaître la géométrie d’une molécule n’est pas utile pour en déterminer sa polarité
2- Une molécule de géométrie linéaire est forcément apolaire
3- La molécule d’eau est polarisée
4- Le fluor n’est pas très réactif
L’affirmation 3 est exacte.
Affirmation 2
Non.
Exemple : HF, Fluorure d’hydrogène.
La très grande différence d’électronégativité entre les deux atomes rend la molécule HF polarisée et chimiquement très réactive.
Affirmation 3
Oui.
Molécule d’eau, H2O. 3 atomes mais :
- la présence de 2 doublets non liants coudent la molécule,
- les différences d’électronégativités OH polarisent les liaisons OH. (Convention des chimistes : vecteur de – à +)
Le
vecteur moment dipolaire de la molécule d’eau, est la somme vectorielle
des moments dipolaires des 2 liaisons.
Le moment dipolaire n’est pas nul : l’eau est
une molécule polarisée.
Affirmation 4
Si.
Le fluor :
- élément le plus électronégatif du tableau périodique,
- très réactif.
Le fluor se rencontre très souvent associé à d’autres atomes.
La polarité d’une molécule découle de :
- L’électronégativité de ses composants,
- Sa géométrie spatiale.
Page 8.
Géométrie & Hybridation

Sélectionner l’affirmation exacte :
1- [A] : 4 orbitales Hybridées = hybridation sp4
2- [B] : 1 double liaison entre les 2 atomes de carbone
3- [B] : Géométrie linéaire (tous les atomes sont alignés)
4- [C] : Toutes les orbitales p sont utilisées
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A] : 4 orbitales Hybridées = hybridation sp3
Affirmation 4
Non.
[C] : 3 orbitale p. Une orbitale p n’est pas utilisée
Types d’OA hybridées sp3, sp2, sp
Voir hybridation
Hybridation sp3 :
-
Combinaison d’une orbitale s et de 3 orbitales
p (d’où l’exposant 3).
- Résultat : quatre orbitales sp situées sur un même niveau d’énergie.
- Géométrie : tétraédrique.
- Angles entre OA sp3 : 109,5°
Hybridation sp2 :
- Combinaison d’une orbitale s et de 2 orbitales p.
- Résultat : trois orbitales sp et une OA p non hybridée,
Les orbitales sp et p sont situées sur un même niveau d’énergie.
- Géométrie : trigonale.
- Angles entre OA sp2 : 120°
Hybridation sp :
- Combinaison d’une orbitale s et d’une orbitale p.
- Résultat : deux orbitales sp et deux OA p non hybridées situées sur un même niveau d’énergie.
- Géométrie : linéaire.
- Angles entre OA sp : 180°
Page 9.
Carbanions & Carbocations

Sélectionner l’affirmation exacte :
1- Les carbanions, les carbocations, sont des intermédiaires de réaction en chimie minérale
2- Rupture hétérolytique d’une liaison covalente : rupture symétrique
3- [A] : les carbocations sont des molécules planes
3- [B] : les carbanions sont des molécules planes
L’affirmation 3 est exacte.
Affirmation 1
Non.
Carbanions, carbocations : Carbone => chimie minérale
Carbocations, cations (charge positive qui les rend instables).
Carbanions, anions (charge négative qui les rend instables).
Les carbocations, les carbanions, sont des intermédiaires de réaction dans des réactions de chimie organique.
Intermédiaires de réaction : ions ou molécules instables, de courtes durées de vie, qui apparaissent temporairement au cours d’une réaction chimique complexe.
Affirmation 2
Non.
Homolytique : partage symétrique des électrons du doublet rompu.
Hétérolytique : partage non symétrique