Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Molécules. Ions. Métaux.
…
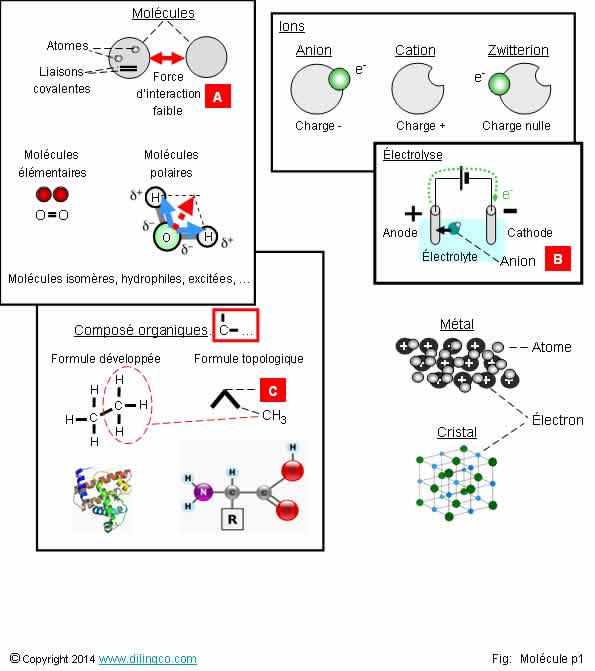
Sélectionner
les deux affirmations exactes :
1- Molécule
élémentaire : molécule formée de 2 atomes différents
2- Molécule :
structure électriquement neutre formée d’au moins 2 atomes
3- [A] :
Liaisons covalentes entre molécules
4-
[B] : Les anions sont attirés par la cathode
5-
[C] : Formule topologique, représentation simplifiée de la représentation
de Lewis : à l’interception de 2 traits, il y a un CH2
6- Composé
organique : au moins un atome de carbone
7- Toutes
les molécules carbonées sont des molécules organiques
Les affirmations
2 et 6 sont exactes.
Affirmation
1
Non.
Molécules élémentaires (ou homonucléaire) : formées d’un seul
type d’atome.
Exemple :
H2, dihydrogène
Note :
Les métaux, formés par des atomes identiques reliés par des ‘liaisons
métalliques’, sont des corps purs non moléculaires.
Affirmation
3
Non.
[A] :
Liaisons d’interactions faibles entre molécules
Exemple :
Liaison de van der Waals
Liaison covalente : liaison formée par 2 électrons mis en
communs par 2 atomes.
Affirmation
4
Non.
[B] :
Les anions, charge électrique négative,
par surplus d’électron(s), sont attirés par l’anode.
Anode :
- charge
électrique positive par manque d’électrons,
- attire les anions, éléments chargés négativement.
Affirmation
5
Non.
[C] :
Le carbone, Z=6, peut établir 4 liaisons de valence.
Voir classification
périodique,
Formule
topologique :
- à
l’interception de 2 traits, il y a un groupement méthylène CH2
- au bout
d’un trait, il y a un groupement méthyle CH3
Affirmation
6
Oui.
Un composé organique a au moins un atome de carbone :
- H2O, H2SO4 ne sont pas des molécules
organiques,
- les
autres atomes peuvent êtres des atomes d’hydrogène,
Exemples :
CH4, Heptane C7H16, …
- ou sans
atomes d’hydrogène : Tétrachloroéthylène (2 carbones & 4 chlores),
- C &
H uniquement = hydrocarbures
Affirmation
7
Non.
Les molécules carbonées ne possèdent pas toutes des liaisons C-H.
Ces
molécules sont dites « inorganiques ».
Exemples :
- CaCO3 : molécule minérale
- oxydes
de carbone simples
(Carbone
et oxygène uniquement : CO, CO2, …),
-
carbonates (ions),
-
cyanure, diamant, graphite.
A l’inverse certains composés organiques ne
contiennent pas de liaison C-H.
Exemples :
urée, acide oxalique, …
Page 2.
Corps purs. Molécules.
Ions
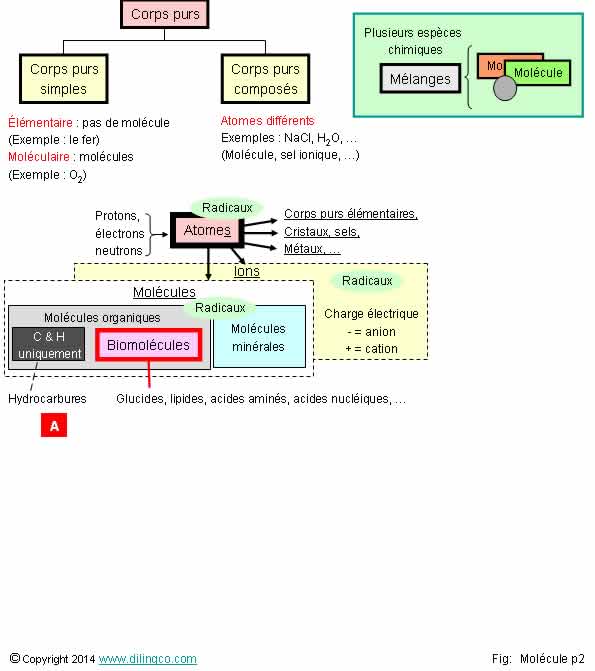
Sélectionner
les deux affirmations exactes :
1- Les
éléments d’un mélange réagissent chimiquement entre eux
2- En
chimie, un radical est forcément une molécule
3- L’eau,
molécule polarisée, permet l’établissement de liaisons hydrogène à faibles
énergies. L’eau est le solvant du vivant
4- Les
biomolécules ne contiennent pas d’atomes de carbone, d’oxygène, d’hydrogène, …
5- [A]. Hydrocarbure :
Molécule organique composée uniquement de carbone et d’hydrogène
6- La chimie
minérale n’est pas concernée par les réactions d’oxydo-réduction, d’acide base
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
Mélange :
- mélange
de minimum 2 substances,
- pas
d’interaction chimiques entre les substances du mélange,
- chacune
garde ses propriétés chimiques ou physiques,
- peuvent
être séparées par action physique,
- peut
être hétérogène (visible à l’œil nu) ou homogène.
Affirmation
2
Non.
Radical :
- espèce
chimique (atome, molécule, ion),
- 1 ou plusieurs électron(s) célibataire(s),
- très instable (durée de vie très courte en
solution),
- ne
respecte pas la règle de l’octet,
- se note
par un point (A.)
Exemples :
Monoxyde
d’azote NO., radical méthyle .CH3, radical
hydrogène H., …
Voir chapitre Radicaux
Affirmation
4
Si.
Biomolécules :
Molécules organiques centrales de la biochimie.
Molécules
organiques : possèdent au moins un atome de carbone, lié à au moins un
atome d’hydrogène (Sauf exceptions : urée, …)
Les
principales catégories de biomolécules étudiées en biochimie sont :
- Les glucides, (sucres/oses,
exemple : glucose)
4 kilocalories/gramme
Utilisation
énergétique et stockage flexible
- Les lipides, (du Grec « Lipos » :
graisse)
9 kilocalories/gramme
Constitution
de réserves énergétiques,
Utilisation
dynamique lourde (c’est le cas de le dire !)
- Les protéines,
4 kilocalories/gramme
Utilisation
exceptionnelle pour la production d’énergie
Circulent sous forme d’acides aminés.
- Les acides nucléiques (bases de l’ADN/ARN).
Affirmation
5
Oui.
[A] :
Hydrocarbures = composés uniquement de carbone et d’hydrogène
(Comme le
mot ‘hydrocarbure’ l’indique)
Page 3
Réaction chimique
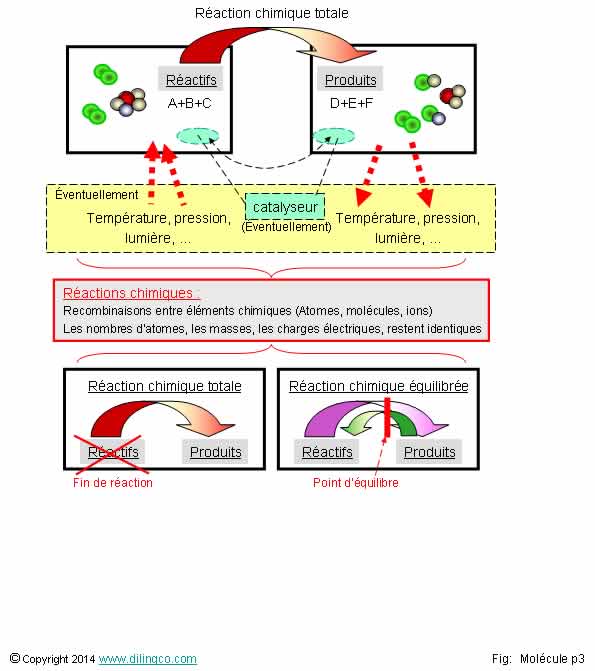
Lors d’une réaction chimique …
Sélectionner
les deux affirmations exactes :
1- Certaines
liaisons entre atomes sont modifiées
2-
Certains atomes disparaissent
3- Les
molécules sont toutes conservées à l’identique
4- Si un
catalyseur est indispensable à une réaction chimique, les quantités initiale et
finale de catalyseur sont identiques
5- Une
réaction chimique peut nécessiter un apport d’énergie mais jamais dégager de
l’énergie
6- Lors
d’une réaction chimique il peut y avoir une variation du total des masses
(Masses réactifs + masses produits)
7- Toutes
les réactions chimiques sont des réactions totales (Plus de réactifs en fin de
réaction)
Les
affirmations 1 et 4 sont exactes.
Voir Réaction
chimique, introduction.
Affirmation
2
Non.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
« Rien
ne se perd, rien ne se crée » => atomes
« Tout
se transforme » => molécules, liaisons, arrangement des atomes
Affirmation
3
Non.
Une réaction chimique est une recombinaison qui se traduit par la rupture de
liaisons et l'établissement de liaisons différentes entre atomes des molécules
impliquées.
Affirmation
5
Non.
Une
réaction chimique qui dégage de l’énergie est dite « exothermique ».
Une combustion est une réaction chimique exothermique d’oxydoréduction.
Une
réaction chimique qui nécessite un apport d’énergie
est dite
« endothermique ».
L’énergie
peut être de la chaleur et/ou de la lumière.
La thermochimie est l’étude énergétique
des systèmes chimiques.
Affirmation
6
Non.
Lors
d’une réaction chimique, le total des masses se conserve.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
Conservation
de la matière
Lors d’une réaction chimique, il y a conservation de la matière.
- Conservation de la masse
Pour une
réaction complète, la masse des produits obtenus =
masse des réactifs initiaux.
- Conservation du nombre total d’atomes,
(Les
composés chimiques s’échangent leurs atomes)
- Conservation de la charge électrique globale.
Page 4
Mésomérie
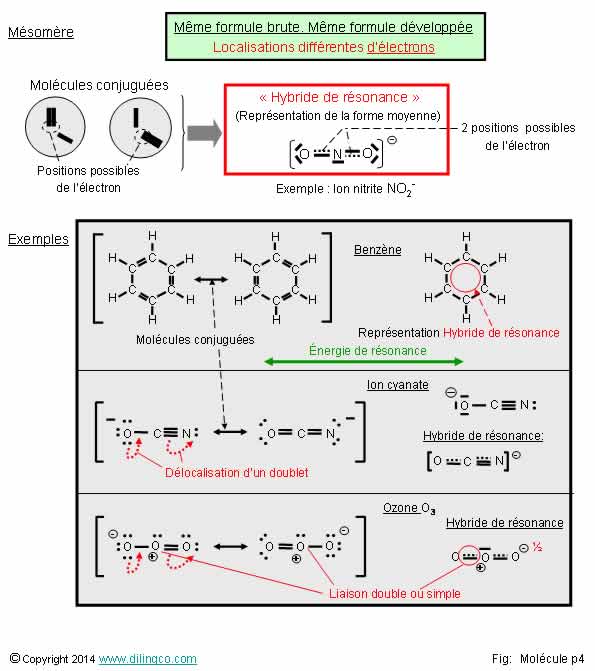
Sélectionner
l’affirmation exacte :
1-
L’hybride de résonance est une des molécules conjuguées d’une molécule mésomère
2- Un
atome d’une molécule mésomère ne peut pas avoir une charge formelle
3- Forme
mésomère de l’ion cyanate : La charge formelle négative est portée par
l’atome d’azote
4-
Energie de résonance : différence entre l’énergie de la molécule réelle et
celle de la molécule conjuguée la plus probable
L’affirmation
4 est exacte.
Affirmation
1
Non.
L’hybride de résonance est la représentation moyenne des diverses molécules conjuguées possibles d’une molécule
mésomère.
Les molécules « mésomères » ont des caractéristiques physiques et
chimiques qui découlent de la mésomérie : Plus
grande stabilité, polarité, …
Mésomérie
ou résonance
-
plusieurs molécules conjuguées
possibles,
-
plusieurs positions d’électron(s) possibles,
On passe d’une forme limite à l’autre par simple déplacement
d’électrons, sans
changement de la disposition des atomes.
-
plusieurs représentations de Lewis (formes limites) possibles.
Affirmation
2
Si.
Un atome
d’une molécule mésomère peut avoir une charge formelle.
Affirmation
3
Non.
La charge
formelle négative est portée par l’atome oxygène (le plus électronégatif des
trois atomes)
Affirmation
4
Oui.
La mésomérie stabilise la molécule et la rend moins réactive.
Exemple :
Pour
briser une molécule de benzène en 6 atomes de carbone et 6 atomes d’hydrogène
il faut plus d’énergie que celle calculée pour briser les 3 liaisons simples
C-C, les 3 liaisons double C=C, et les 6 liaisons C-H d’une forme limite.
Le supplément d’énergie de la molécule mésomère réelle est appelé
« énergie de résonance ».
Page 5
Isomérie. Stéréoisomérie
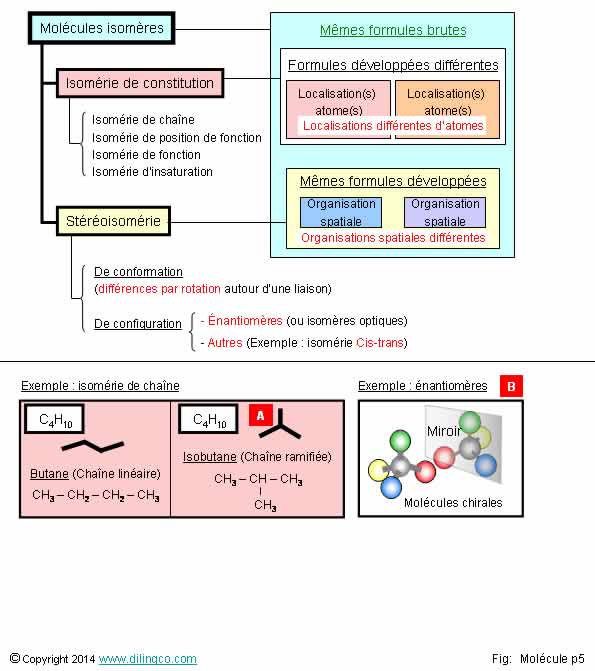
Sélectionner
les deux affirmations exactes :
1-
[A] : La formule brute de l’isobutane est différente de celle du butane
2-
[B] : Exemple de molécules stéréoisomères
3- Des
molécules isomères ont la même formule brute donc leurs propriétés
physiques, chimiques, biologiques sont identiques
4- Des
molécules isomères de constitution ont des formules développées identiques
5- Des
acides gras insaturés peuvent être des isomères Cis-trans
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Non.
[A].
Le butane
et l’isobutane sont deux molécules isomères de chaîne.
Molécules isomères : mêmes formules brutes.
Affirmation
2
Oui.
[B] :
Exemple de molécules :
- stéréoisomères
de configuration,
-
isomères optiques (énantiomères).
2
molécules énantiomères peuvent être différentiées par leur propriété optique :
l’une dévie la lumière polarisée vers la droite, l’autre vers la gauche.
Des
molécules énantiomères sont « chirales ».
Chiral :
images l’une de l’autre dans un miroir ; images non superposables.
Exemples
d’éléments chiraux : main gauche et main droite.
Les
propriétés pharmacologiques et biologiques de 2 énantiomères peuvent être
différentes et dépendre des configurations spatiales.
Exemple :
Dans le
traitement de la maladie de Parkinson, seule la L-Dopa est active.
La D-Dopa
est même toxique pour les neurones !
Affirmation3
Non.
Des molécules isomères :
- ont la
même formule brute,
- peuvent avoir des propriétés physiques, chimiques,
biologiques différentes.
Exemple :
Des molécules
énantiomères, qui ont les mêmes formules brutes, les mêmes formules
développées, mais qui sont différentes dans leur organisation spatiales (représentations
de CRAM différentes) peuvent avoir des effets enzymatiques différents en
pouvant, ou non, se connecter à un site de fixation.
Affirmation
5
Oui.
Les
acides gras insaturés contiennent au
moins une double liaison carbone-carbone ou une
forme cyclique.
La double
liaison permet des isoméries Cis-Trans.
Isomérie
« cis » / « trans »
cis :
les groupements R sont du même côté du
plan déterminé par la double liaison.
trans : les groupements R sont sur
chaque côté de la double liaison.
Pour se
rappeler la signification de Z et E dans un nom IUPAC:
Z =
cis : (moyen
mnémotechnique ciZeaux)
Comme les
deux branches d’un ciseau, les deux groupements sont du même côté de la double
liaison.
E = trans : (moyen mnémotechnique transE)
Les deux
groupements sont de part et d’autre de la double liaison.
Page 6
Exemples d’isomères
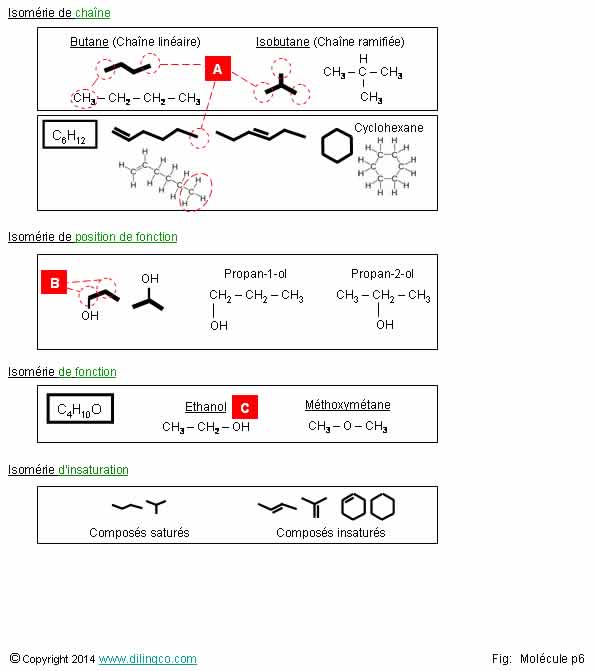
Sélectionner
l’affirmation exacte :
1-
[A] : En bout d’un trait d’une chaîne carbonée il y a un CH
2-
[B] : à l’intersection de 2 traits il y a un CH
3-
[C] : OH, groupement hydroxyle, apparaît dans les fonctions organiques
oxygénées
4- Les
composés organiques insaturés sont plus stables que les composés organiques
saturés
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A] :
Le
carbone respecte strictement la règle de l’octet.
Il peut
avoir 4 liaisons covalentes maximum.
En bout
d’un trait d’une chaîne carbonée il y a un CH3.
Carbone
terminal : 1 liaison vers le carbone de la chaîne, 3 liaisons hydrogène.
CH3 : Groupe méthyle
À
l’interception de 2 traits il un CH2.
Voir Chimie organique, Représentation des molécules.
Affirmation
2
Non.
[B] :
à l’intersection de 2 traits il y a un CH2
Les noms
des composés reflètent la position de la ramification.
Prop :
3.
1, ou 2 =
position de la ramification.
Affirmation
3
Oui.
[C] :
OH, groupement hydroxyle.
Voir chimie organique Principaux groupes.
Voir Eau,
Hydratation d’une molécule organique.
Affirmation
4
Non.
C’est
l’inverse.
Insaturés :
- peut
accepter d’autres atomes et former un autre composé saturé ou encore insaturé
(triple liaison transformée en double liaison),
- instabilité,
-
existence d’une double ou triple liaison, d’un cycle,
- moins d’atomes que permis par la somme des
valences des atomes de carbone pris individuellement.
Composés
saturés/insaturés
Page 7
Oligomère. Polymère
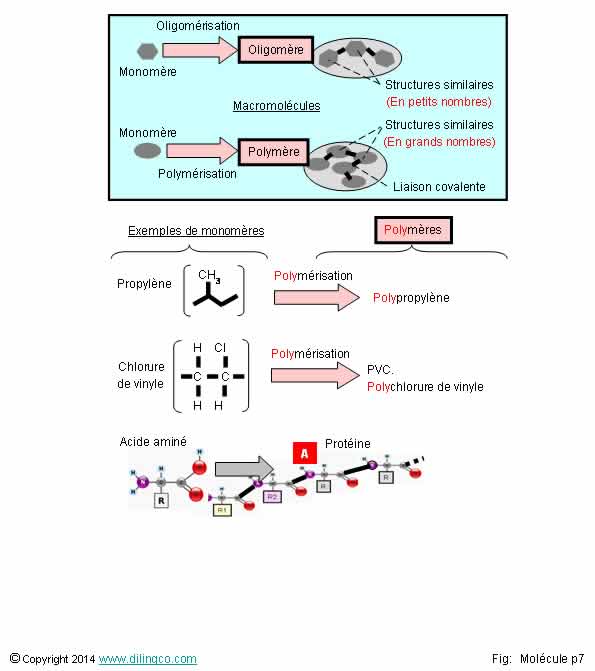
Sélectionner
les deux affirmations exactes :
1-
Monomère : même signification en chimie et en biologie
2- Toutes
les macromolécules sont d’origines synthétiques
3- La
chaîne principale d’un polymère a toujours des atomes de carbone
4-
[A] : Les
protéines sont des polymères d’acides aminés
5- Un
polymère est formé d’une répétition de monomères. Notion de stabilité des
propriétés
Les
affirmations 4 et 5 sont exactes.
Affirmation
1
Non.
Chimie :
Un monomère : substance, le plus souvent
organique, utilisée pour synthétiser un polymère
ou un oligomère.
Biologie :
Un monomère : élément constitutif d’une protéine
multimérique.
Exemple :
hémoglobine.
Chimie :
Oligomère : molécule constituée d’un petit nombre d’unités
monomères.
Biologie :
Oligomère :
fragment court d’ADN, chaîne courte
polypeptidique.
Affirmation
2
Non.
Les
macromolécules ne sont pas toutes d’origines synthétiques.
De nombreuses macromolécules sont d’origines
naturelles.
Exemples :
- Les polysaccharides
(Amidon, cellulose, …),
- Les
protéines,
- Les acides
nucléiques, l’ADN,
- La
soie, le caoutchouc naturel, …
Affirmation
3
Non.
La chaîne
principale d’un polymère n’a pas toujours des atomes de carbone.
Exemple : Les silicones sont des enchaînements d’atomes de silicium et
d’oxygène.
Affirmation
4
Oui.
Les
protéines :
- sont
des polymères d’acides aminés.
- sont
construites à partir de 20 acides aminés de base.
- nombre
et chronologie des acides aminés sont spécifiques à une protéine,
- les
acides aminés sont reliés entre eux par des liaisons
peptidiques pour former une
chaîne polypeptidique plus ou moins
longue.
Note :
Un enzyme est une protéine avec un pouvoir catalytique.
Affirmation
5
Oui.
Un polymère est une molécule :
-
composées d’une répétition d’éléments
(atomes, groupes d’atomes, macromolécules),
- dont
les propriétés globales ne varient pas
si l’on rajoute, ou supprime, un élément de
la répétition.
Exemples
de polymères :
- la cellulose,
l’amidon, …
- la
kératine (Ongles, cheveux),
- de
nombreux polymères industriels.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Molécules. Ions. Métaux. …

Sélectionner les deux affirmations exactes :
1- Molécule élémentaire : molécule formée de 2 atomes différents
2- Molécule : structure électriquement neutre formée d’au moins 2 atomes
3- [A] : Liaisons covalentes entre molécules
4- [B] : Les anions sont attirés par la cathode
5- [C] : Formule topologique, représentation simplifiée de la représentation de Lewis : à l’interception de 2 traits, il y a un CH2
6- Composé organique : au moins un atome de carbone
7- Toutes les molécules carbonées sont des molécules organiques
Les affirmations 2 et 6 sont exactes.
Affirmation 1
Non.
Molécules élémentaires (ou homonucléaire) : formées d’un seul type d’atome.
Exemple : H2, dihydrogène
Note :
Les métaux, formés par des atomes identiques reliés par des ‘liaisons métalliques’, sont des corps purs non moléculaires.
Affirmation 3
Non.
[A] : Liaisons d’interactions faibles entre molécules
Exemple : Liaison de van der Waals
Liaison covalente : liaison formée par 2 électrons mis en communs par 2 atomes.
Affirmation 4
Non.
[B] : Les anions, charge électrique négative, par surplus d’électron(s), sont attirés par l’anode.
Anode :
- charge électrique positive par manque d’électrons,
- attire les anions, éléments chargés négativement.
Affirmation 5
Non.
[C] :
Le carbone, Z=6, peut établir 4 liaisons de valence.
Voir classification périodique,
Formule topologique :
- à l’interception de 2 traits, il y a un groupement méthylène CH2
- au bout d’un trait, il y a un groupement méthyle CH3
Affirmation 6
Oui.
Un composé organique a au moins un atome de carbone :
- H2O, H2SO4 ne sont pas des molécules
organiques,
- les autres atomes peuvent êtres des atomes d’hydrogène,
Exemples : CH4, Heptane C7H16, …
- ou sans atomes d’hydrogène : Tétrachloroéthylène (2 carbones & 4 chlores),
- C & H uniquement = hydrocarbures
Affirmation 7
Non.
Les molécules carbonées ne possèdent pas toutes des liaisons C-H.
Ces molécules sont dites « inorganiques ».
Exemples :
- CaCO3 : molécule minérale
- oxydes de carbone simples
(Carbone et oxygène uniquement : CO, CO2, …),
- carbonates (ions),
- cyanure, diamant, graphite.
A l’inverse certains composés organiques ne contiennent pas de liaison C-H.
Exemples : urée, acide oxalique, …
Page 2.
Corps purs. Molécules. Ions

Sélectionner les deux affirmations exactes :
1- Les éléments d’un mélange réagissent chimiquement entre eux
2- En chimie, un radical est forcément une molécule
3- L’eau, molécule polarisée, permet l’établissement de liaisons hydrogène à faibles énergies. L’eau est le solvant du vivant
4- Les biomolécules ne contiennent pas d’atomes de carbone, d’oxygène, d’hydrogène, …
5- [A]. Hydrocarbure : Molécule organique composée uniquement de carbone et d’hydrogène
6- La chimie minérale n’est pas concernée par les réactions d’oxydo-réduction, d’acide base
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Mélange :
- mélange de minimum 2 substances,
- pas d’interaction chimiques entre les substances du mélange,
- chacune garde ses propriétés chimiques ou physiques,
- peuvent être séparées par action physique,
- peut être hétérogène (visible à l’œil nu) ou homogène.
Affirmation 2
Non.
Radical :
- espèce chimique (atome, molécule, ion),
- 1 ou plusieurs électron(s) célibataire(s),
- très instable (durée de vie très courte en solution),
- ne respecte pas la règle de l’octet,
- se note par un point (A.)
Exemples :
Monoxyde d’azote NO., radical méthyle .CH3, radical hydrogène H., …
Voir chapitre Radicaux
Affirmation 4
Si.
Biomolécules : Molécules organiques centrales de la biochimie.
Molécules organiques : possèdent au moins un atome de carbone, lié à au moins un atome d’hydrogène (Sauf exceptions : urée, …)
Les principales catégories de biomolécules étudiées en biochimie sont :
- Les glucides, (sucres/oses, exemple : glucose)
4 kilocalories/gramme
Utilisation énergétique et stockage flexible
- Les lipides, (du Grec « Lipos » : graisse)
9 kilocalories/gramme
Constitution de réserves énergétiques,
Utilisation dynamique lourde (c’est le cas de le dire !)
- Les protéines,
4 kilocalories/gramme
Utilisation
exceptionnelle pour la production d’énergie
Circulent sous forme d’acides aminés.
- Les acides nucléiques (bases de l’ADN/ARN).
Affirmation 5
Oui.
[A] :
Hydrocarbures = composés uniquement de carbone et d’hydrogène
(Comme le mot ‘hydrocarbure’ l’indique)
Page 3
Réaction chimique

Lors d’une réaction chimique …
Sélectionner les deux affirmations exactes :
1- Certaines liaisons entre atomes sont modifiées
2- Certains atomes disparaissent
3- Les molécules sont toutes conservées à l’identique
4- Si un catalyseur est indispensable à une réaction chimique, les quantités initiale et finale de catalyseur sont identiques
5- Une réaction chimique peut nécessiter un apport d’énergie mais jamais dégager de l’énergie
6- Lors d’une réaction chimique il peut y avoir une variation du total des masses (Masses réactifs + masses produits)
7- Toutes les réactions chimiques sont des réactions totales (Plus de réactifs en fin de réaction)
Les affirmations 1 et 4 sont exactes.
Voir Réaction chimique, introduction.
Affirmation 2
Non.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
« Rien ne se perd, rien ne se crée » => atomes
« Tout se transforme » => molécules, liaisons, arrangement des atomes
Affirmation 3
Non.
Une réaction chimique est une recombinaison qui se traduit par la rupture de liaisons et l'établissement de liaisons différentes entre atomes des molécules impliquées.
Affirmation 5
Non.
Une
réaction chimique qui dégage de l’énergie est dite « exothermique ».
Une combustion est une réaction chimique exothermique d’oxydoréduction.
Une réaction chimique qui nécessite un apport d’énergie est dite « endothermique ».
L’énergie
peut être de la chaleur et/ou de la lumière.
La thermochimie est l’étude énergétique
des systèmes chimiques.
Affirmation 6
Non.
Lors d’une réaction chimique, le total des masses se conserve.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
Conservation de la matière
Lors d’une réaction chimique, il y a conservation de la matière.
- Conservation de la masse
Pour une réaction complète, la masse des produits obtenus = masse des réactifs initiaux.
- Conservation du nombre total d’atomes,
(Les composés chimiques s’échangent leurs atomes)
- Conservation de la charge électrique globale.
Page 4
Mésomérie

Sélectionner l’affirmation exacte :
1- L’hybride de résonance est une des molécules conjuguées d’une molécule mésomère
2- Un atome d’une molécule mésomère ne peut pas avoir une charge formelle
3- Forme mésomère de l’ion cyanate : La charge formelle négative est portée par l’atome d’azote
4- Energie de résonance : différence entre l’énergie de la molécule réelle et celle de la molécule conjuguée la plus probable
L’affirmation 4 est exacte.
Affirmation 1
Non.
L’hybride de résonance est la représentation moyenne des diverses molécules conjuguées possibles d’une molécule mésomère.
Les molécules « mésomères » ont des caractéristiques physiques et chimiques qui découlent de la mésomérie : Plus grande stabilité, polarité, …
Mésomérie ou résonance
- plusieurs molécules conjuguées possibles,
- plusieurs positions d’électron(s) possibles,
On passe d’une forme limite à l’autre par simple déplacement d’électrons, sans changement de la disposition des atomes.
- plusieurs représentations de Lewis (formes limites) possibles.
Affirmation 2
Si.
Un atome d’une molécule mésomère peut avoir une charge formelle.
Affirmation 3
Non.
La charge formelle négative est portée par l’atome oxygène (le plus électronégatif des trois atomes)
Affirmation 4
Oui.
La mésomérie stabilise la molécule et la rend moins réactive.
Exemple :
Pour briser une molécule de benzène en 6 atomes de carbone et 6 atomes d’hydrogène il faut plus d’énergie que celle calculée pour briser les 3 liaisons simples C-C, les 3 liaisons double C=C, et les 6 liaisons C-H d’une forme limite.
Le supplément d’énergie de la molécule mésomère réelle est appelé « énergie de résonance ».
Page 5
Isomérie. Stéréoisomérie

Sélectionner les deux affirmations exactes :
1- [A] : La formule brute de l’isobutane est différente de celle du butane
2- [B] : Exemple de molécules stéréoisomères
3- Des molécules isomères ont la même formule brute donc leurs propriétés physiques, chimiques, biologiques sont identiques
4- Des molécules isomères de constitution ont des formules développées identiques
5- Des acides gras insaturés peuvent être des isomères Cis-trans
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
[A].
Le butane et l’isobutane sont deux molécules isomères de chaîne.
Molécules isomères : mêmes formules brutes.
Affirmation 2
Oui.
[B] : Exemple de molécules :
- stéréoisomères de configuration,
- isomères optiques (énantiomères).
2 molécules énantiomères peuvent être différentiées par leur propriété optique : l’une dévie la lumière polarisée vers la droite, l’autre vers la gauche.
Des molécules énantiomères sont « chirales ».
Chiral : images l’une de l’autre dans un miroir ; images non superposables.
Exemples d’éléments chiraux : main gauche et main droite.
Les propriétés pharmacologiques et biologiques de 2 énantiomères peuvent être différentes et dépendre des configurations spatiales.
Exemple :
Dans le traitement de la maladie de Parkinson, seule la L-Dopa est active.
La D-Dopa est même toxique pour les neurones !
Affirmation3
Non.
Des molécules isomères :
- ont la même formule brute,
- peuvent avoir des propriétés physiques, chimiques, biologiques différentes.
Exemple :
Des molécules énantiomères, qui ont les mêmes formules brutes, les mêmes formules développées, mais qui sont différentes dans leur organisation spatiales (représentations de CRAM différentes) peuvent avoir des effets enzymatiques différents en pouvant, ou non, se connecter à un site de fixation.
Affirmation 5
Oui.
Les acides gras insaturés contiennent au moins une double liaison carbone-carbone ou une forme cyclique.
La double liaison permet des isoméries Cis-Trans.
Isomérie « cis » / « trans »
cis :
les groupements R sont du même côté du
plan déterminé par la double liaison.
trans : les groupements R sont sur
chaque côté de la double liaison.
Pour se
rappeler la signification de Z et E dans un nom IUPAC:
Z =
cis : (moyen
mnémotechnique ciZeaux)
Comme les
deux branches d’un ciseau, les deux groupements sont du même côté de la double
liaison.
E = trans : (moyen mnémotechnique transE)
Les deux groupements sont de part et d’autre de la double liaison.
Page 6
Exemples d’isomères

Sélectionner l’affirmation exacte :
1- [A] : En bout d’un trait d’une chaîne carbonée il y a un CH
2- [B] : à l’intersection de 2 traits il y a un CH
3- [C] : OH, groupement hydroxyle, apparaît dans les fonctions organiques oxygénées
4- Les composés organiques insaturés sont plus stables que les composés organiques saturés
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A] :
Le carbone respecte strictement la règle de l’octet.
Il peut avoir 4 liaisons covalentes maximum.
En bout d’un trait d’une chaîne carbonée il y a un CH3.
Carbone terminal : 1 liaison vers le carbone de la chaîne, 3 liaisons hydrogène.
CH3 : Groupe méthyle
À l’interception de 2 traits il un CH2.
Voir Chimie organique, Représentation des molécules.
Affirmation 2
Non.
[B] : à l’intersection de 2 traits il y a un CH2
Les noms des composés reflètent la position de la ramification.
Prop : 3.
1, ou 2 = position de la ramification.
Affirmation 3
Oui.
[C] :
OH, groupement hydroxyle.
Voir chimie organique Principaux groupes.
Voir Eau, Hydratation d’une molécule organique.
Affirmation 4
Non.
C’est
l’inverse.
Insaturés :
- peut accepter d’autres atomes et former un autre composé saturé ou encore insaturé (triple liaison transformée en double liaison),
- instabilité,
- existence d’une double ou triple liaison, d’un cycle,
- moins d’atomes que permis par la somme des valences des atomes de carbone pris individuellement.
Composés saturés/insaturés
Page 7
Oligomère. Polymère

Sélectionner les deux affirmations exactes :
1- Monomère : même signification en chimie et en biologie
2- Toutes les macromolécules sont d’origines synthétiques
3- La chaîne principale d’un polymère a toujours des atomes de carbone
4- [A] : Les protéines sont des polymères d’acides aminés
5- Un polymère est formé d’une répétition de monomères. Notion de stabilité des propriétés
Les affirmations 4 et 5 sont exactes.
Affirmation 1
Non.
Chimie :
Un monomère : substance, le plus souvent organique, utilisée pour synthétiser un polymère ou un oligomère.
Biologie :
Un monomère : élément constitutif d’une protéine multimérique.
Exemple : hémoglobine.
Chimie :
Oligomère : molécule constituée d’un petit nombre d’unités monomères.
Biologie :
Oligomère : fragment court d’ADN, chaîne courte polypeptidique.
Affirmation 2
Non.
Les
macromolécules ne sont pas toutes d’origines synthétiques.
De nombreuses macromolécules sont d’origines
naturelles.
Exemples :
- Les polysaccharides (Amidon, cellulose, …),
- Les protéines,
- Les acides nucléiques, l’ADN,
- La soie, le caoutchouc naturel, …
Affirmation 3
Non.
La chaîne
principale d’un polymère n’a pas toujours des atomes de carbone.
Exemple : Les silicones sont des enchaînements d’atomes de silicium et
d’oxygène.
Affirmation 4
Oui.
Les protéines :
- sont des polymères d’acides aminés.
- sont construites à partir de 20 acides aminés de base.
- nombre et chronologie des acides aminés sont spécifiques à une protéine,
- les acides aminés sont reliés entre eux par des liaisons peptidiques pour former une chaîne polypeptidique plus ou moins longue.
Note :
Un enzyme est une protéine avec un pouvoir catalytique.
Affirmation 5
Oui.
Un polymère est une molécule :
- composées d’une répétition d’éléments (atomes, groupes d’atomes, macromolécules),
- dont les propriétés globales ne varient pas si l’on rajoute, ou supprime, un élément de la répétition.
Exemples de polymères :
- la cellulose, l’amidon, …
- la kératine (Ongles, cheveux),
- de nombreux polymères industriels.