Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Types de liaisons
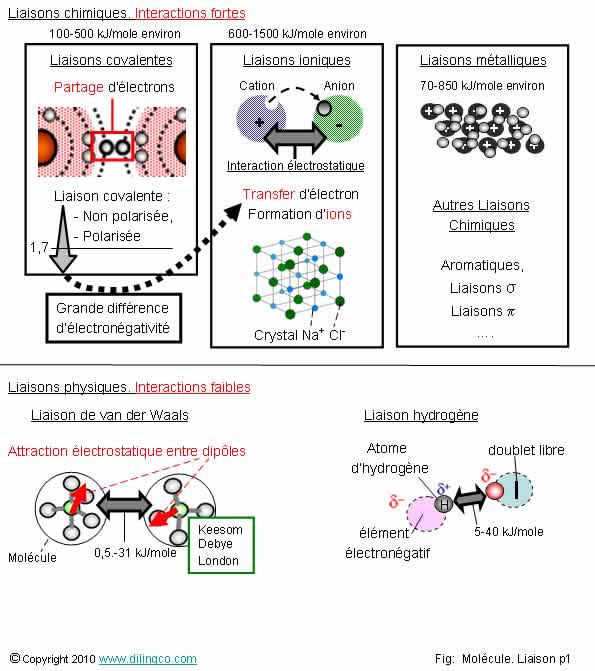
Sélectionner
les deux affirmations exactes :
1-
Liaisons métalliques : les atomes gardent leur structure électronique
stable
2-
Liaisons chimiques : les électrons de valence des atomes sont impliqués
3-
Liaisons physiques : forces d’interactions électrostatiques est entre des
électrons
4- Les
énergies de liaison électrons/noyau n’interviennent pas dans la réalisation, ou
non, des liaisons et des réactions chimiques
5-
Classement par ordre d’énergie de liaison : ionique, covalente,
métallique, hydrogène, van der Waals
6-
L’intensité des interactions faibles ne conditionne pas le mouvement brownien
des molécules ni l’état gazeux, liquide, ou solide d’un corps
Les affirmations
2 et 5 sont exactes.
Affirmation
1
Non.
Liaisons
métalliques : Plusieurs modèles explicatifs.
Exemple :
Cations généralisés et les électrons périphériques mis en communs formant un
« nuage électronique » qui assure la cohésion des matériaux.
Ces électrons libres sont à l’origine de la conduction électrique
des métaux.
Affirmation 2
Oui.
Voir pages suivantes.
Principales
liaisons chimiques :
-
Liaisons covalentes,
-
Liaisons ioniques,
- Liaisons métallique,
- etc.
Affirmation
5
Oui.
Les liaisons
de Van der Waals sont de plusieurs
types :
-
Interactions de Keesom, entre dipôles
permanents,
- Interactions de Debye, entre un
dipôle permanent et un dipôle induits,
-
Interactions de London, entre un dipôle instantané et un
dipôle induits.
Les liaisons
physiques mettent en jeux des énergies, plus ou moins faibles selon les
types ; Energies, dans tous les cas inférieures aux énergies des liaisons
chimiques.
Affirmation
6
Si.
L’intensité
des interactions faibles conditionne l’agitation des molécules entre elles.
Agitation des molécule = mouvement brownien.
L’agitation
des molécules entre elles est liée à l’intensité des interactions faibles.
Force d’interaction très faible : corps à l’état gazeux, plus forte : état liquide,
encore plus forte : état solide.
La température d’un corps est liée à l’agitation des molécules.
Page 2.
Liaisons covalentes &
ioniques
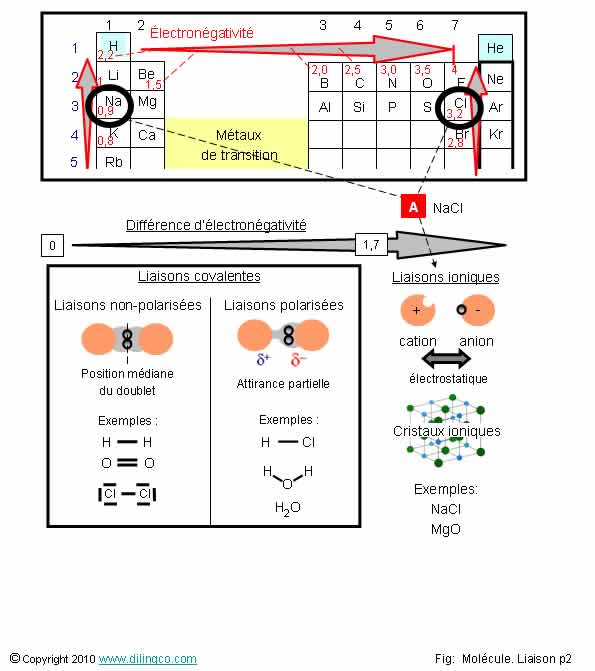
Sélectionner
les deux affirmations exactes :
1- [A] :
Molécule de chlorure de sodium NaCl : liaison covalente Na-Cl (Différence
d’électronégativité > 1,7)
2- La
molécule de dioxygène est polarisée
3- Une
molécule formée de 2 atomes différents est polarisée
4- Toutes
les liaisons covalentes ont la même longueur et la même énergie
5- Il
peut y avoir des doubles liaisons covalentes entre atomes
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
Différence
d’électronégativité chlore-Sodium = (3,2 – 0,9 = 2,3) > 1,7 = NaCl : liaison ionique
Affirmation
2
Non.
La
molécule de dioxygène est formée de 2 atomes
identiques : molécule non polarisée
(apolaire)
Affirmation
3
Oui.
Une
molécule formée de 2 atomes différents est
polarisée.
L’atome
le plus électronégatif est noté -δ, le moins électronégatif +δ.
Affirmation
4
Non.
Longueur
de liaison : distance entre les 2 noyaux
Energie
de liaison : énergie minimale pour rompre la liaison covalente.
Plus la liaison covalente est courte, plus l’énergie de la liaison
est grande.
La longueur de liaison est la distance où les forces d’attraction,
les forces de Coulomb électrons/noyaux, et les forces de répulsion des nuages
électroniques s’annulent. A la longueur de liaison, l’énergie de liaison est
minimale.
La position de ce minimum dépend des charges en présence, des
rayons atomiques, de l’électronégativité, des orbitales.
Forces de Coulomb : des charges électriques éloignées de
signes opposés s’attirent.
Affirmation
5
Oui.
Il peut y
avoir des doubles liaisons covalentes
entre atomes
Exemple :
O=O
Liaison
covalente : partage de 2 électrons par 2 atomes pour former un doublet
liant, une « liaison covalente ».
Voir pages suivantes.
Page 3.
Doublets
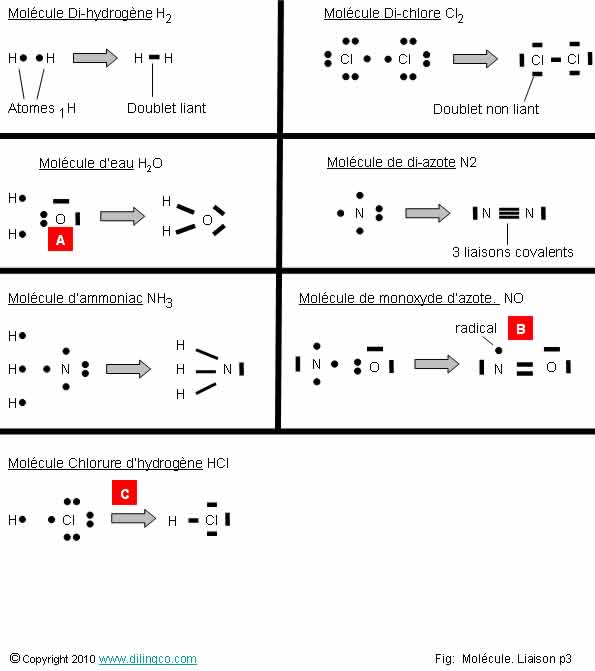
Sélectionner
l’affirmation exacte :
1- [A] : Représentation de la molécule d’eau : 2 doublets
liants et 3 doublets non liants
2- Dans une liaison covalente, un doublet liant, chaque atome voit
les 2 électrons même s’il n’en possède qu’un en propre
3- [B] : Il ne reste pas d’électron
célibataire
4-
[C] : Le gaz HCl = liaison ionique entre ion H et Cl
L’affirmation
2 est exacte.
Affirmation 1
Non.
[A] : Représentation de la molécule d’eau : 2 doublets liants
et 2 doublets non liants.
La figure de Lewis ne représente que les électrons externes (Les 2
électrons de cœur de l’atome d’oxygène ne sont pas représentés).
Affirmation 2
Oui.
Dans une liaison covalente, un doublet liant, chaque atome voit les 2
électrons même s’il n’en possède qu’un en propre.
Dans les règles du duet ou de l’octet des pages suivantes, compter
les liaisons, ou si vous comptez les électrons, 1 liaison = 2 électrons.
Affirmation 3
Non.
[B] : Reste 1 électron célibataire.
Un atome avec 1 ou des électrons célibataires sur les couches
externe est un radical.
Affirmation
4
Non.
[C] :
La différence d’électronégativités H=2,2 et Cl=3,2 est inférieure à 1,7 =
liaison covalente polarisée.
Note :
Acide
chlorhydrique :
- solution aqueuse,
- solutés : ions hydrate
d'hydrogène H3O+ et ions chlorure Cl-.
Page 4.
Règles du duet et de
l’octet
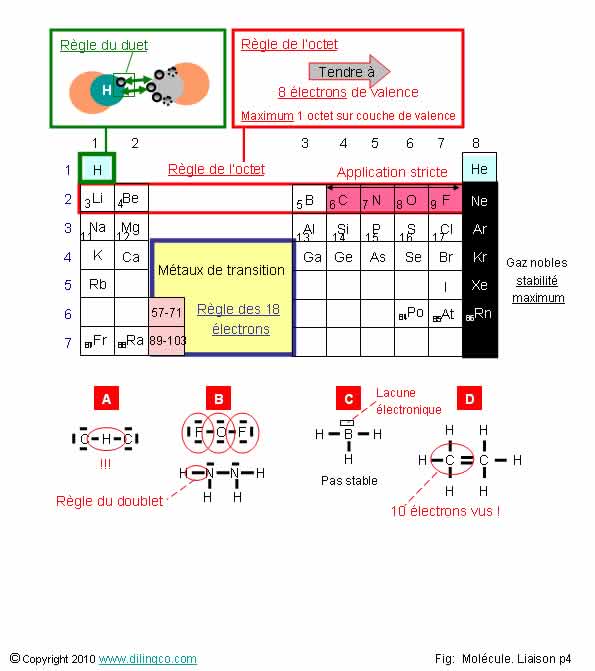
Sélectionner les deux affirmations exactes :
1- Règle de l’octet : chaque atome tend à former des liaisons
covalentes pour acquérir 8 électrons (1 octet) de valence et arriver à une
configuration stable
2- [A] : Les liaisons covalentes C-H-C sont possibles
3- L’atome d’hydrogène ne peut former qu’une liaison avec un autre
atome : l’hydrogène se trouve toujours aux extrémités des molécules
4- [B] : Dans les molécules représentées, N, O, F ne
respectent pas strictement la règle de l’octet
5- Période 3 : La règle de l’octet s’applique
6- [C] : Molécule stable (B, Z=5, 5+3=8 électrons)
7- [D] : Représentation correcte de l’éthane
Les affirmations 1 et 3 sont exactes.
Affirmation 1
Oui.
Règle de l’octet : chaque atome tend à former des liaisons
covalentes pour arriver à une configuration électronique stable.
Saturation de la couche de valence à 8 électrons, ou 4 liaisons covalente, ou un mixte liaisons
covalentes & doublets non liants.
Affirmation 2
Non.
[A].
Les liaisons C-H-C ne sont pas possibles : 2 liaisons
covalentes autour de l’atome d’hydrogène = 4 électrons vus = règle de l’octet non
respectée.
Affirmation 3
Oui.
L’atome d’hydrogène ne peut former qu’une liaison avec un autre
atome : l’hydrogène se trouve toujours aux extrémités des molécules.
L’hydrogène est toujours entouré d’un maximum de 2 électrons.
Affirmation 4
Si.
[B] : N, O, F respectent strictement la règle de l’octet.
Dans les exemples présentés, OF2 et N2H4,
chaque atome est entouré de 4 liaisons (covalentes ou non liantes) = 8
électrons propres ou vus.
Affirmation 5
Non.
Période 3 : La règle de l’octet ne s’applique pas. De très
nombreuses molécules obtenues avec des atomes des périodes supérieures 2 ne
respectent pas la règle de l’octet.
Notes :
- (rappel) ne pas utiliser le modèle de Bohr pour trouver la
configuration électronique si Z>18,
- Les métaux de transition observent la règle des 18 électrons.
Affirmation 6
Non.
Le borane, BH3, n’est pas stable.
Il n’y a pas saturation de la couche de valence.
Rappels : La stabilité est liée à la couche de valence.
B, Z=5 = 3 électrons de valence.
BH3 : 8 électrons. 2 électrons de cœur, 6 électrons de
valence.
Affirmation 7
Non.
[D] : Les atomes de carbone voient 5 doublets (10
électrons) !
Les atomes de carbone respectent strictement la règle de l’octet.
Carbone
: 4 liaisons ou doublets non liants maximum.
L'éthane est un hydrocarbure de la famille des alcanes.
Voir Noms en Chimie organique.
Stabilité
électronique
Lors des
réactions chimiques les atomes cherchent à saturer
leurs couches externes (celles des électrons de valence représentées dans le modèle
de Lewis) :
- Par perte ou gain d’un électron (liaison ionique),
- Par mise en commun d’électrons (liaison covalente).
Règle de l’octet
Les atomes d’une molécule ont tendance à
perdre/gagner/mettre en commun des électrons pour saturer leur couche externe à 8 électrons.
Les 8 électrons peuvent être dans des doublets liants ou non.
Notes :
- 8 électrons (4 doublets) =1 octet.
- La règle de l’octet est valable pour les atomes de la période 2. À partir de la
troisième période il existe des molécules qui ne respectent pas la règle de
l’octet.
Règle du duet.
La stabilité électronique de l’hydrogène est obtenue lorsque
l’atome ressemble à son gaz rare voisin, l’hélium (2 électrons).
Lors des réactions chimiques, les atomes d’hydrogène ont donc tendance à
créer un
doublet d’électrons.
Gaz nobles/rares
Les gaz nobles sont aussi appelés gaz rares.
Les gaz rares :
- éléments chimiques les plus stables (couche de valence
saturée),
- possèdes 8 électrons sur leur couche de valence (2 électrons pour
l’hélium,
- n’existent que sous forme d’atome, jamais sous forme
d’ion,
- n’ont pas tendance à créer des liaisons covalentes avec d’autres atomes,
- sont au nombre de 6 : hélium, néon, argon, krypton, xénon,
radon.
Page 5.
Que des atomes périodes 1
& 2

Sélectionner les deux affirmations exactes :
1- [A] : 10 électrons
2- [A] : L’atome le plus électronégatif est C
3- Si le nombre total d’électrons est impair = 1 électron
célibataire = la molécule est un radical
4- [B] : Les halogènes peuvent être placés en milieu de
chaine
5- Nombre d’électrons de valence : C=6, F=9, H=1
6- [C] : La représentation de Lewis de l’atome de fluor est
correcte
Les affirmations 3 et 6 sont exactes.
Affirmation 2
Non.
[A] : L’atome le plus électronégatif est le Fluor.
Affirmation 4
Non.
[B] : Les halogènes, 7 électrons de valence, n’acceptent de
voir qu’un électron supplémentaire (règle de l’octet): 1 liaison covalente
vers un autre atome.
Les halogènes sont à placer en extrémité de la représentation
de Lewis.
Même chose, mais pour cause de la règle du duet, l’hydrogène se trouve
toujours aux extrémités des molécules
Affirmation 5
Non.
Nombre d’électrons de valence : C=4, F=7, H=1
Page 6.
Exceptions. Atomes de la
période 3
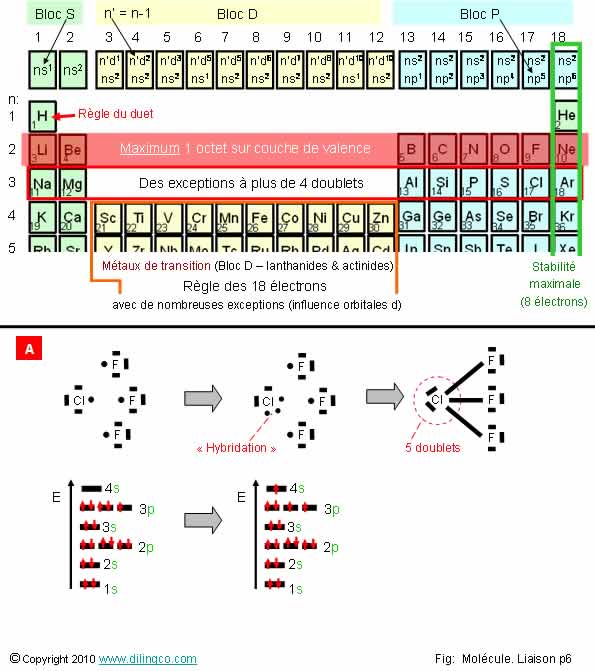
Sélectionner
l’affirmation exacte :
1- L’atome
de chlore et atome de fluor : 5 électrons de valence
2-
[A] : Le trifluorure de chlore ClF3 n’existe pas : l’atome de chlore
ne peut établir qu’une liaison covalente
3- Chlore excité : 1 électron passe en 4s, il reste 2 paires
d’électrons sur 3p
4- Chlore excité : 1 électron passe en 4s, il reste 1 paire
d’électrons et 2 électrons célibataires sur 3p
L’affirmation
4 est exacte.
Affirmation
1
Non.
Atome de
chlore, atome de fluor:
-
Halogène,
- 7ème
groupe : 7 électrons de valence,
- ou,
Bloc p, = 1s2 1p5 = 7
électrons de valence.
- cherchent
à établir une liaison covalente pour atteindre la stabilité atomique maximale à
8 électrons
Affirmation
2
Si.
L’atome
de chlore, dans sont état fondamental, est
monovalent
Un seul électron libre = le chlore ne peut faire qu’une seule liaison.
Chlore excité devient « hypervalent » :
Un
électron de l’OA 3p passe vers l’OA 3d.
L’atome
de chlore se retrouve avec 5.
Bien que
peu stable, la molécule trifluorure existe.
Autres
exemples :
- Pentachlorure
de phosphore : 5 liaisons sur P.
-
Hexafluorure de soufre : 6 liaisons sur S.
Affirmation 4
Oui.
Chlore excité : 1 électron passe en 4s, il reste 1 paire
d’électrons et 2 électrons célibataires sur 3p
Raison :
Règle de Hund : Pour le remplissage d’un niveau
d’énergie, répartir les électrons avec le maximum de spins parallèles, puis compléter les
cases quantiques de manière à obtenir des paires d’électrons (électrons de
spins opposés).
Voir Exclusions. Pauli & Hund
Page 7.
Ions. Charge formelle
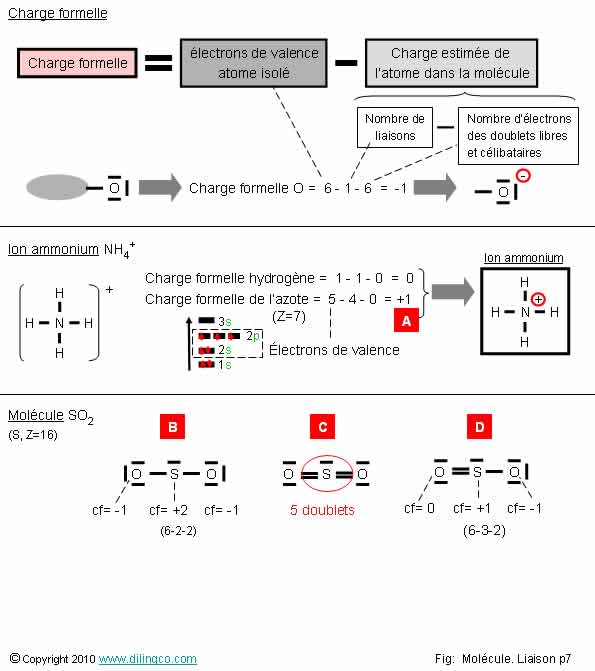
Sélectionner
l’affirmation exacte :
1- [A]-
Charge formelle de l’azote : 7-4-0 = +3
2- La
charge globale = somme des charges formelles
3- Les
molécules [B], [C], [D] n’ont pas la même formule chimique
4- [B]
est la molécule exacte
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A]-
Azote : Groupe 5 = 5 électrons de valence.
Charge
formelle de l’azote : 5-4-0 = +1
Affirmation
2
Oui.
La charge globale de la molécule = somme des charges formelles de
chaque atome.
Molécule non chargée : Charge globale nulle.
Exemple
figure : SO2
Anion, charge
globale négative par électron(s) supplémentaire(s).
Cations,
charge globale positive, par manque d’électrons(s).
Note :
Pour vérifier vos calculs sur les charges formelles, vérifier les
sommes.
Affirmation
3
Si.
Les
molécules [B], [C], [D] ont la même formule chimique SO2.
Affirmation
4
Non.
[B] :
la molécule ne respecte pas la règle de l’octet pour l’atome de soufre (S voit
5 doublets, 10 électrons). Elle n’est pas à retenir : les 2 autres
respectent la règle.
La
formule [D] est la bonne : elle a les charge formelles atomiques les moins
importantes.
Page 8.
Méthodes de construction
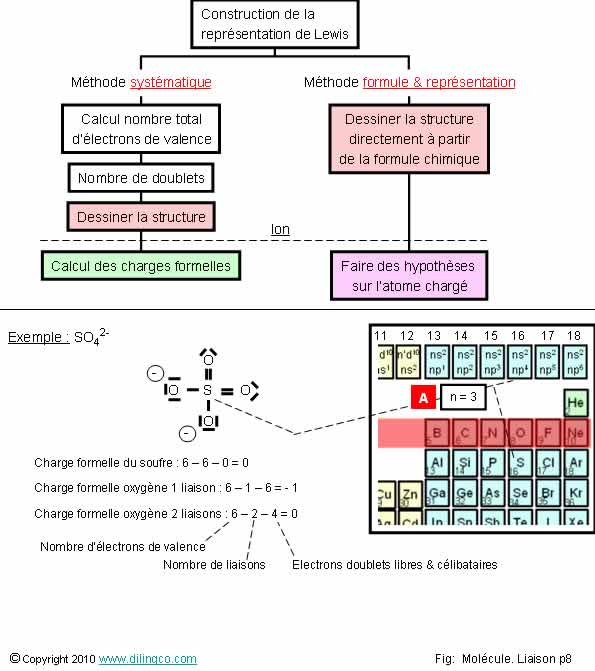
Sélectionner
l’affirmation exacte :
1- [A].
n=2 : Niveau d’énergie de stabilité électronique du soufre
2- Charge
formelle du soufre : électrons de valence – nombre de liaisons – nombre
d’électrons dans doublets libres = 0
3- Charge
formelle oxygène avec 1 liaison = 0
4- Le
soufre respecte strictement la règle de l’octet
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A].
n=3 :
- Niveau
d’énergie de stabilité électronique du soufre,
- 3ème période du tableau.
S :
1s2 2s2 2p6 3s2
3p4
Revoir
Orbitales atomiques
Affirmation
3
Non.
Charge
formelle oxygène : -1 ou 0 (se rappeler retrancher 1 ou 2 liaisons
ou refaire les calculs)
Affirmation
4
Non.
Seuls les
électrons de la 2ème période, C à F, respectent strictement la règle
de l’octet (8 électrons maximum sur la couche de valence).
Page 9.
Construction. Méthode
systématique
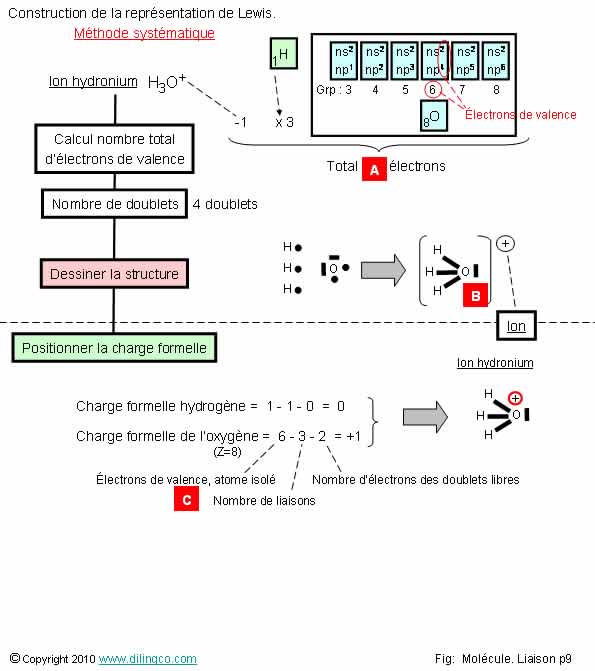
Sélectionner
l’affirmation exacte :
1- [A] :
Total =11 électrons de valence, atomes pris séparément
2- [B] :
L’atome d’oxygène a, en propre et en comptant les électrons de cœur, 8
électrons
3- La
charge formelle de l’ion hydronium est sur l’atome d’oxygène
4- [C] :
Electrons de valence de l’atome d’hydrogène
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A] :
Oxygène :
6 électrons de valence,
Hydrogène :
1, 3 atomes= 3
Manque 1
électron dans l’ion hydronium (Charge +) : -1
Total = 6
+ 3 -1 = 9 électrons de valence, atomes pris séparément.
Affirmation
2
Non.
[B] :
Dans cet exemple, l’atome d’oxygène a, en propre 2 électrons de cœur et 5
électrons sur les OA s2 et p4.
Total =
8-7 : Il lui manque bien un électron (8-7).
Ceci corrobore les résultats du calcul des charges formelles.
Affirmation
4
Non.
[C] :
Nombre de liaisons avec l’atome d’oxygène.
Electrons
de valence de l’atome d’hydrogène
Méthode
« Systématique »
La méthode
« Systématique »
utilise une succession systématique d’étapes :
1-
[A] : Calculer le nombre total des électrons
de valence
(Ajouter
les électrons de valence de tous les atomes constituant la molécule)
2-
[B] : Retrancher/ajouter (éventuellement), la charge de l’ion
-
Retrancher 1 électron par charge
positive,
-
Ajouter 1 électron par charge négative.
3-
[C] : Calculer le nombre de doublets
En cas
d’un nombre impair d’électrons, on obtient un radical
(1 électron célibataire)
4-
[D] : Construire l’architecture de
Lewis
-
Entourer l’atome de Z le plus important par les atomes les plus nombreux,
-
Respecter au maximum la règle de l’octet.
5-
[E] : Cas d’un ion
Positionner
la/les charge(s) formelle(s)
Note :
La
méthode systématique peut s’avérer plus lente que la méthode
« Représentation de Lewis des atomes & hypothèse ».
Page 10.
Méthode représentation des
atomes
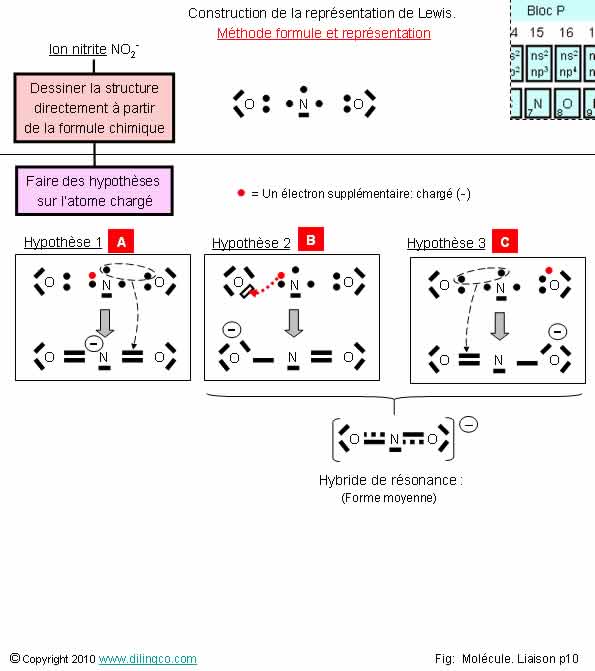
Sélectionner
l’affirmation exacte :
1- [A] :
Représentation de Lewis correcte de l’ion nitrite
2-
[B] : 7 électrons sur la couche externe de l’oxygène : impossible
3- [B]
& [C] sont des formules mésomères de l’ion nitrite
4- L’ion
nitrique est une molécule linéaire, les 3 atomes sont sur un même axe
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A] :L’atome
d’azote, deuxième période du tableau de
classement périodique, respecte strictement la règle de l’octet : saturation à 8 électrons. Ici : 9
électrons vus !
Règle de l’octet : voir 2ème page de ce chapitre.
Affirmation
2
Si.
[B] :
7 électrons sur la couche externe de l’oxygène.
Si
possible = anion oxygène.
Affirmation
4
Non.
L’ion
nitrique n’est pas une molécule linéaire.
Les
répulsions entre électrons des doubles ou simples liaisons ne sont pas
exactement réparties et symétriques autour de l’atome d’azote.
Voir chapitre Géométrie des molécules.
Ion nitrite : NO2-
Ion nitrate : NO3-
Page 11.
Systématiser le dessin
Sélectionner
l’affirmation exacte :
1-
Molécule de trifluorure
de chlore : le chlore est entouré de 3 doublets liants et d’un électron
célibataire (Nombre total impair d’électrons)
2- 1
électron célibataire = anion
3-
[A] : L’oxygène est un atome de la deuxième période. Il respecte
strictement la règle de l’octet (8 électrons maximum vus sur la couche de
valence
4-
[B] : Le chlore doit respecte strictement la règle de l’octet
L’affirmation
3 est exacte.
Affirmation
1
Non.
Molécule de trifluorure de chlore :
- 1 atome
de chlore = 17 électrons (dont 7 de valence : groupe 17, ou S2p5)
- 3 atome
de fluor = 3x9 = 27 électrons
Total :
44 électrons = pas d’électrons célibataire.
Affirmation
2
Non.
1
électron célibataire = radical
Pour
avoir un anion, l’électron doit provenir de l’extérieur : le nombre
d’électrons doit être supérieur au total des électrons des atomes de la
molécule.
Affirmation
4
Non.
[B] :
Le chlore du trifluorure de chlore voit 5 doublets, 10 électrons.
Les atomes de la troisième période du tableau de
classement périodique ne respectent pas strictement la règle de l’octet.
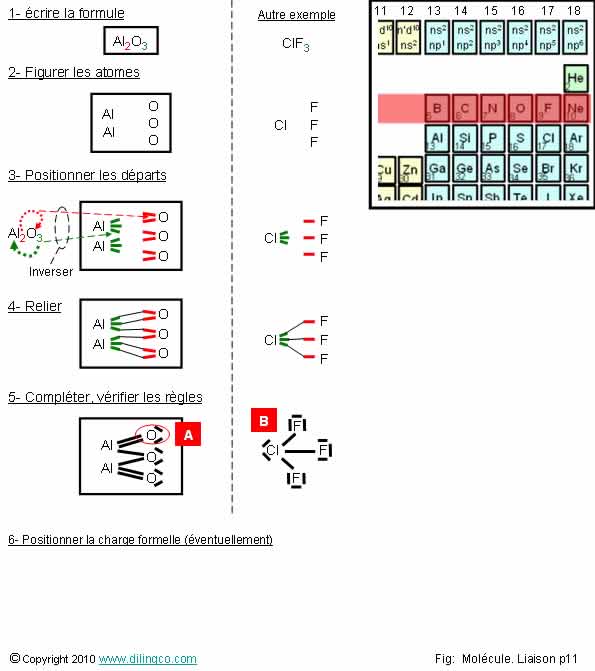
Pour
systématiser la construction des molécules par la représentation des atomes :
1-
Figurer les atomes suivants leurs nombres indiqués dans la formule,
2-
Positionner les départs des doublets liants,
Le nombre des départs à représenter pour chaque atome
s’obtient en inversant les indices nombres
d’atomes.
3- Relier
un à un les départs de liaisons,
4-
Compléter la molécule en positionnant les doublets non liants,
5-
Positionner les électrons célibataires éventuels restants.
6- En cas
de molécule chargée, positionner la charge formelle
(Voir pages précédentes).
Compléter
la molécule
L’étape,
compléter la molécule, est la plus complexe :
- Trouver
le nombre d’électrons de valence des atomes initiaux
(En
utilisant les groupes du tableau pour les blocs s et p, ou la représentation
des OA, s,p,d,f)
- Entourer l’atome initial, en respectant les règles, pour trouver le nombre de doublets et d’électrons célibataires initiaux,
- Si
nécessaire, ouvrir un doublet pour obtenir 2 électrons et les compter dans les
doublets liants,
- Dans un
doublet liant, chaque atome de la liaison apporte un électron.
Exemples :
- L’atome
d’aluminium a 3 électrons de valence. L’atome est relié à 3 atomes d’oxygène
par 3 liaisons, chacune par un électron mis en commun.
- L’atome d’oxygène a 6 électrons de valence. Dans la molécule, 2 électrons
participent aux doublets liants : il faut rajouter, 4 électrons (2
doublets non liants).
Page
12.
Interactions
faibles
Sélectionner
l’affirmation exacte :
1- Les interactions
électrostatiques se produisent entre molécules apolaires
2- Les
interactions électrostatiques (liaisons de Van der Waals, ou « liaisons
physiques ») sont plus intenses que les liaisons chimiques
3-
Liaisons covalentes : Liaisons chimiques de partage de doublets liants
entre atomes d’une molécule
4- Les liaisons de Van der Waals ne
se créent qu’en cas de dipôles permanents
L’affirmation
3 est exacte.
Affirmation
1
Non.
Les interactions
électrostatiques se produisent entre dipôles
de molécules polarisées
Affirmation
2
Non.
Liaison
de Van der Waals :
Interaction électrostatique de faible intensité entre
molécules, atomes, ou entre une
molécule et un cristal.
Liaisons
chimiques :
Mise en
commun de doublet(s) liants, les liaisons covalentes.
Les
liaisons covalentes sont plus fortes que les liaisons électrostatiques.
Affirmation
4
Non.
Liaisons
de Van der Waals :
- Dipôle permanent <-> Dipôle permanent.
Interaction de Keesom,
- Dipôle permanent <-> Dipôle induit.
Interaction de Debye,
- Dipôle instantané <-> Dipôle instantané.
Interaction de London.
Les
interactions de London sont moins fortes que les interactions de Debye.
Les interactions de Debye sont moins fortes que les interactions de Keesom.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Types de liaisons

Sélectionner les deux affirmations exactes :
1- Liaisons métalliques : les atomes gardent leur structure électronique stable
2- Liaisons chimiques : les électrons de valence des atomes sont impliqués
3- Liaisons physiques : forces d’interactions électrostatiques est entre des électrons
4- Les énergies de liaison électrons/noyau n’interviennent pas dans la réalisation, ou non, des liaisons et des réactions chimiques
5- Classement par ordre d’énergie de liaison : ionique, covalente, métallique, hydrogène, van der Waals
6- L’intensité des interactions faibles ne conditionne pas le mouvement brownien des molécules ni l’état gazeux, liquide, ou solide d’un corps
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Non.
Liaisons métalliques : Plusieurs modèles explicatifs.
Exemple : Cations généralisés et les électrons périphériques mis en communs formant un « nuage électronique » qui assure la cohésion des matériaux.
Ces électrons libres sont à l’origine de la conduction électrique des métaux.
Affirmation 2
Oui.
Voir pages suivantes.
Principales liaisons chimiques :
- Liaisons covalentes,
-
Liaisons ioniques,
- Liaisons métallique,
- etc.
Affirmation 5
Oui.
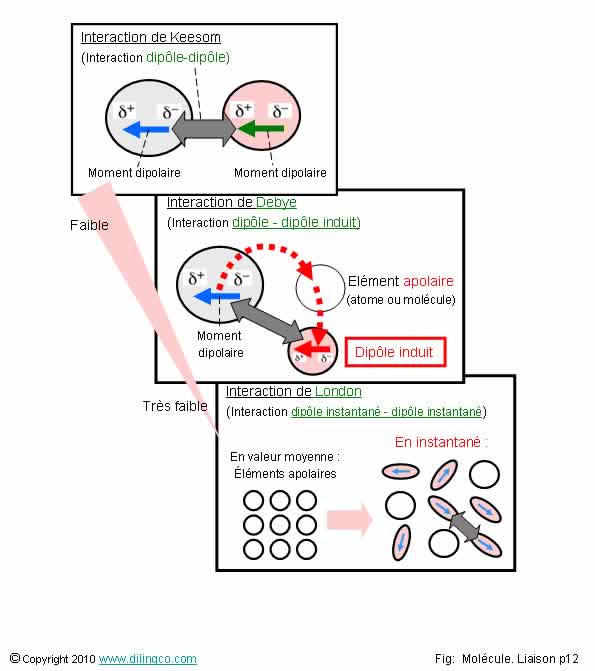
Les liaisons de Van der Waals sont de plusieurs types :
-
Interactions de Keesom, entre dipôles
permanents,
- Interactions de Debye, entre un
dipôle permanent et un dipôle induits,
- Interactions de London, entre un dipôle instantané et un dipôle induits.
Les liaisons physiques mettent en jeux des énergies, plus ou moins faibles selon les types ; Energies, dans tous les cas inférieures aux énergies des liaisons chimiques.
Affirmation 6
Si.
L’intensité des interactions faibles conditionne l’agitation des molécules entre elles.
Agitation des molécule = mouvement brownien.
L’agitation des molécules entre elles est liée à l’intensité des interactions faibles.
Force d’interaction très faible : corps à l’état gazeux, plus forte : état liquide, encore plus forte : état solide.
La température d’un corps est liée à l’agitation des molécules.
Page 2.
Liaisons covalentes & ioniques

Sélectionner les deux affirmations exactes :
1- [A] : Molécule de chlorure de sodium NaCl : liaison covalente Na-Cl (Différence d’électronégativité > 1,7)
2- La molécule de dioxygène est polarisée
3- Une molécule formée de 2 atomes différents est polarisée
4- Toutes les liaisons covalentes ont la même longueur et la même énergie
5- Il peut y avoir des doubles liaisons covalentes entre atomes
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Différence d’électronégativité chlore-Sodium = (3,2 – 0,9 = 2,3) > 1,7 = NaCl : liaison ionique
Affirmation 2
Non.
La molécule de dioxygène est formée de 2 atomes identiques : molécule non polarisée (apolaire)
Affirmation 3
Oui.
Une molécule formée de 2 atomes différents est polarisée.
L’atome le plus électronégatif est noté -δ, le moins électronégatif +δ.
Affirmation 4
Non.
Longueur de liaison : distance entre les 2 noyaux
Energie de liaison : énergie minimale pour rompre la liaison covalente.
Plus la liaison covalente est courte, plus l’énergie de la liaison est grande.
La longueur de liaison est la distance où les forces d’attraction, les forces de Coulomb électrons/noyaux, et les forces de répulsion des nuages électroniques s’annulent. A la longueur de liaison, l’énergie de liaison est minimale.
La position de ce minimum dépend des charges en présence, des rayons atomiques, de l’électronégativité, des orbitales.
Forces de Coulomb : des charges électriques éloignées de signes opposés s’attirent.
Affirmation 5
Oui.
Il peut y avoir des doubles liaisons covalentes entre atomes
Exemple : O=O
Liaison covalente : partage de 2 électrons par 2 atomes pour former un doublet liant, une « liaison covalente ».
Voir pages suivantes.
Page 3.
Doublets

Sélectionner l’affirmation exacte :
1- [A] : Représentation de la molécule d’eau : 2 doublets liants et 3 doublets non liants
2- Dans une liaison covalente, un doublet liant, chaque atome voit les 2 électrons même s’il n’en possède qu’un en propre
3- [B] : Il ne reste pas d’électron célibataire
4- [C] : Le gaz HCl = liaison ionique entre ion H et Cl
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A] : Représentation de la molécule d’eau : 2 doublets liants et 2 doublets non liants.
La figure de Lewis ne représente que les électrons externes (Les 2 électrons de cœur de l’atome d’oxygène ne sont pas représentés).
Affirmation 2
Oui.
Dans une liaison covalente, un doublet liant, chaque atome voit les 2 électrons même s’il n’en possède qu’un en propre.
Dans les règles du duet ou de l’octet des pages suivantes, compter les liaisons, ou si vous comptez les électrons, 1 liaison = 2 électrons.
Affirmation 3
Non.
[B] : Reste 1 électron célibataire.
Un atome avec 1 ou des électrons célibataires sur les couches externe est un radical.
Affirmation 4
Non.
[C] : La différence d’électronégativités H=2,2 et Cl=3,2 est inférieure à 1,7 = liaison covalente polarisée.
Note :
Acide chlorhydrique :
- solution aqueuse,
- solutés : ions hydrate d'hydrogène H3O+ et ions chlorure Cl-.
Page 4.
Règles du duet et de l’octet

Sélectionner les deux affirmations exactes :
1- Règle de l’octet : chaque atome tend à former des liaisons covalentes pour acquérir 8 électrons (1 octet) de valence et arriver à une configuration stable
2- [A] : Les liaisons covalentes C-H-C sont possibles
3- L’atome d’hydrogène ne peut former qu’une liaison avec un autre atome : l’hydrogène se trouve toujours aux extrémités des molécules
4- [B] : Dans les molécules représentées, N, O, F ne respectent pas strictement la règle de l’octet
5- Période 3 : La règle de l’octet s’applique
6- [C] : Molécule stable (B, Z=5, 5+3=8 électrons)
7- [D] : Représentation correcte de l’éthane
Les affirmations 1 et 3 sont exactes.
Affirmation 1
Oui.
Règle de l’octet : chaque atome tend à former des liaisons covalentes pour arriver à une configuration électronique stable.
Saturation de la couche de valence à 8 électrons, ou 4 liaisons covalente, ou un mixte liaisons covalentes & doublets non liants.
Affirmation 2
Non.
[A].
Les liaisons C-H-C ne sont pas possibles : 2 liaisons covalentes autour de l’atome d’hydrogène = 4 électrons vus = règle de l’octet non respectée.
Affirmation 3
Oui.
L’atome d’hydrogène ne peut former qu’une liaison avec un autre atome : l’hydrogène se trouve toujours aux extrémités des molécules.
L’hydrogène est toujours entouré d’un maximum de 2 électrons.
Affirmation 4
Si.
[B] : N, O, F respectent strictement la règle de l’octet.
Dans les exemples présentés, OF2 et N2H4, chaque atome est entouré de 4 liaisons (covalentes ou non liantes) = 8 électrons propres ou vus.
Affirmation 5
Non.
Période 3 : La règle de l’octet ne s’applique pas. De très nombreuses molécules obtenues avec des atomes des périodes supérieures 2 ne respectent pas la règle de l’octet.
Notes :
- (rappel) ne pas utiliser le modèle de Bohr pour trouver la configuration électronique si Z>18,
- Les métaux de transition observent la règle des 18 électrons.
Affirmation 6
Non.
Le borane, BH3, n’est pas stable.
Il n’y a pas saturation de la couche de valence.
Rappels : La stabilité est liée à la couche de valence.
B, Z=5 = 3 électrons de valence.
BH3 : 8 électrons. 2 électrons de cœur, 6 électrons de valence.
Affirmation 7
Non.
[D] : Les atomes de carbone voient 5 doublets (10 électrons) !
Les atomes de carbone respectent strictement la règle de l’octet.
Carbone
: 4 liaisons ou doublets non liants maximum.
L'éthane est un hydrocarbure de la famille des alcanes.
Voir Noms en Chimie organique.
Stabilité électronique
Lors des réactions chimiques les atomes cherchent à saturer leurs couches externes (celles des électrons de valence représentées dans le modèle de Lewis) :
- Par perte ou gain d’un électron (liaison ionique),
- Par mise en commun d’électrons (liaison covalente).
Règle de l’octet
Les atomes d’une molécule ont tendance à perdre/gagner/mettre en commun des électrons pour saturer leur couche externe à 8 électrons.
Les 8 électrons peuvent être dans des doublets liants ou non.
Notes :
- 8 électrons (4 doublets) =1 octet.
- La règle de l’octet est valable pour les atomes de la période 2. À partir de la
troisième période il existe des molécules qui ne respectent pas la règle de
l’octet.
Règle du duet.
La stabilité électronique de l’hydrogène est obtenue lorsque l’atome ressemble à son gaz rare voisin, l’hélium (2 électrons).
Lors des réactions chimiques, les atomes d’hydrogène ont donc tendance à créer un doublet d’électrons.
Gaz nobles/rares
Les gaz nobles sont aussi appelés gaz rares.
Les gaz rares :
- éléments chimiques les plus stables (couche de valence saturée),
- possèdes 8 électrons sur leur couche de valence (2 électrons pour l’hélium,
- n’existent que sous forme d’atome, jamais sous forme d’ion,
- n’ont pas tendance à créer des liaisons covalentes avec d’autres atomes,
- sont au nombre de 6 : hélium, néon, argon, krypton, xénon, radon.
Page 5.
Que des atomes périodes 1 & 2

Sélectionner les deux affirmations exactes :
1- [A] : 10 électrons
2- [A] : L’atome le plus électronégatif est C
3- Si le nombre total d’électrons est impair = 1 électron célibataire = la molécule est un radical
4- [B] : Les halogènes peuvent être placés en milieu de chaine
5- Nombre d’électrons de valence : C=6, F=9, H=1
6- [C] : La représentation de Lewis de l’atome de fluor est correcte
Les affirmations 3 et 6 sont exactes.
Affirmation 2
Non.
[A] : L’atome le plus électronégatif est le Fluor.
Affirmation 4
Non.
[B] : Les halogènes, 7 électrons de valence, n’acceptent de voir qu’un électron supplémentaire (règle de l’octet): 1 liaison covalente vers un autre atome.
Les halogènes sont à placer en extrémité de la représentation
de Lewis.
Même chose, mais pour cause de la règle du duet, l’hydrogène se trouve
toujours aux extrémités des molécules
Affirmation 5
Non.
Nombre d’électrons de valence : C=4, F=7, H=1
Page 6.
Exceptions. Atomes de la période 3

Sélectionner l’affirmation exacte :
1- L’atome de chlore et atome de fluor : 5 électrons de valence
2- [A] : Le trifluorure de chlore ClF3 n’existe pas : l’atome de chlore ne peut établir qu’une liaison covalente
3- Chlore excité : 1 électron passe en 4s, il reste 2 paires d’électrons sur 3p
4- Chlore excité : 1 électron passe en 4s, il reste 1 paire d’électrons et 2 électrons célibataires sur 3p
L’affirmation 4 est exacte.
Affirmation 1
Non.
Atome de chlore, atome de fluor:
- Halogène,
- 7ème groupe : 7 électrons de valence,
- ou, Bloc p, = 1s2 1p5 = 7 électrons de valence.
- cherchent à établir une liaison covalente pour atteindre la stabilité atomique maximale à 8 électrons
Affirmation 2
Si.
L’atome de chlore, dans sont état fondamental, est monovalent
Un seul électron libre = le chlore ne peut faire qu’une seule liaison.
Chlore excité devient « hypervalent » :
Un électron de l’OA 3p passe vers l’OA 3d.
L’atome de chlore se retrouve avec 5.
Bien que peu stable, la molécule trifluorure existe.
Autres exemples :
- Pentachlorure de phosphore : 5 liaisons sur P.
- Hexafluorure de soufre : 6 liaisons sur S.
Affirmation 4
Oui.
Chlore excité : 1 électron passe en 4s, il reste 1 paire d’électrons et 2 électrons célibataires sur 3p
Raison :
Règle de Hund : Pour le remplissage d’un niveau d’énergie, répartir les électrons avec le maximum de spins parallèles, puis compléter les cases quantiques de manière à obtenir des paires d’électrons (électrons de spins opposés).
Voir Exclusions. Pauli & Hund
Page 7.
Ions. Charge formelle

Sélectionner l’affirmation exacte :
1- [A]- Charge formelle de l’azote : 7-4-0 = +3
2- La charge globale = somme des charges formelles
3- Les molécules [B], [C], [D] n’ont pas la même formule chimique
4- [B] est la molécule exacte
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A]- Azote : Groupe 5 = 5 électrons de valence.
Charge formelle de l’azote : 5-4-0 = +1
Affirmation 2
Oui.
La charge globale de la molécule = somme des charges formelles de chaque atome.
Molécule non chargée : Charge globale nulle.
Exemple figure : SO2
Anion, charge globale négative par électron(s) supplémentaire(s).
Cations, charge globale positive, par manque d’électrons(s).
Note :
Pour vérifier vos calculs sur les charges formelles, vérifier les sommes.
Affirmation 3
Si.
Les molécules [B], [C], [D] ont la même formule chimique SO2.
Affirmation 4
Non.
[B] : la molécule ne respecte pas la règle de l’octet pour l’atome de soufre (S voit 5 doublets, 10 électrons). Elle n’est pas à retenir : les 2 autres respectent la règle.
La formule [D] est la bonne : elle a les charge formelles atomiques les moins importantes.
Page 8.
Méthodes de construction

Sélectionner l’affirmation exacte :
1- [A]. n=2 : Niveau d’énergie de stabilité électronique du soufre
2- Charge formelle du soufre : électrons de valence – nombre de liaisons – nombre d’électrons dans doublets libres = 0
3- Charge formelle oxygène avec 1 liaison = 0
4- Le soufre respecte strictement la règle de l’octet
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A].
n=3 :
- Niveau d’énergie de stabilité électronique du soufre,
- 3ème période du tableau.
S : 1s2 2s2 2p6 3s2 3p4
Revoir Orbitales atomiques
Affirmation 3
Non.
Charge formelle oxygène : -1 ou 0 (se rappeler retrancher 1 ou 2 liaisons ou refaire les calculs)
Affirmation 4
Non.
Seuls les électrons de la 2ème période, C à F, respectent strictement la règle de l’octet (8 électrons maximum sur la couche de valence).
Page 9.
Construction. Méthode systématique

Sélectionner l’affirmation exacte :
1- [A] : Total =11 électrons de valence, atomes pris séparément
2- [B] : L’atome d’oxygène a, en propre et en comptant les électrons de cœur, 8 électrons
3- La charge formelle de l’ion hydronium est sur l’atome d’oxygène
4- [C] : Electrons de valence de l’atome d’hydrogène
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A] :
Oxygène : 6 électrons de valence,
Hydrogène : 1, 3 atomes= 3
Manque 1 électron dans l’ion hydronium (Charge +) : -1
Total = 6 + 3 -1 = 9 électrons de valence, atomes pris séparément.
Affirmation 2
Non.
[B] : Dans cet exemple, l’atome d’oxygène a, en propre 2 électrons de cœur et 5 électrons sur les OA s2 et p4.
Total =
8-7 : Il lui manque bien un électron (8-7).
Ceci corrobore les résultats du calcul des charges formelles.
Affirmation 4
Non.
[C] : Nombre de liaisons avec l’atome d’oxygène.
Electrons de valence de l’atome d’hydrogène
Méthode « Systématique »
La méthode « Systématique » utilise une succession systématique d’étapes :
1- [A] : Calculer le nombre total des électrons de valence
(Ajouter les électrons de valence de tous les atomes constituant la molécule)
2- [B] : Retrancher/ajouter (éventuellement), la charge de l’ion
- Retrancher 1 électron par charge positive,
- Ajouter 1 électron par charge négative.
3- [C] : Calculer le nombre de doublets
En cas d’un nombre impair d’électrons, on obtient un radical (1 électron célibataire)
4- [D] : Construire l’architecture de Lewis
- Entourer l’atome de Z le plus important par les atomes les plus nombreux,
- Respecter au maximum la règle de l’octet.
5- [E] : Cas d’un ion
Positionner la/les charge(s) formelle(s)
Note :
La méthode systématique peut s’avérer plus lente que la méthode « Représentation de Lewis des atomes & hypothèse ».
Page 10.
Méthode représentation des atomes

Sélectionner l’affirmation exacte :
1- [A] : Représentation de Lewis correcte de l’ion nitrite
2- [B] : 7 électrons sur la couche externe de l’oxygène : impossible
3- [B] & [C] sont des formules mésomères de l’ion nitrite
4- L’ion nitrique est une molécule linéaire, les 3 atomes sont sur un même axe
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A] :L’atome d’azote, deuxième période du tableau de classement périodique, respecte strictement la règle de l’octet : saturation à 8 électrons. Ici : 9 électrons vus !
Règle de l’octet : voir 2ème page de ce chapitre.
Affirmation 2
Si.
[B] : 7 électrons sur la couche externe de l’oxygène.
Si possible = anion oxygène.
Affirmation 4
Non.
L’ion nitrique n’est pas une molécule linéaire.
Les répulsions entre électrons des doubles ou simples liaisons ne sont pas exactement réparties et symétriques autour de l’atome d’azote.
Voir chapitre Géométrie des molécules.
Ion nitrite : NO2-
Ion nitrate : NO3-
Page 11.
Systématiser le dessin

Sélectionner l’affirmation exacte :
1- Molécule de trifluorure de chlore : le chlore est entouré de 3 doublets liants et d’un électron célibataire (Nombre total impair d’électrons)
2- 1 électron célibataire = anion
3- [A] : L’oxygène est un atome de la deuxième période. Il respecte strictement la règle de l’octet (8 électrons maximum vus sur la couche de valence
4- [B] : Le chlore doit respecte strictement la règle de l’octet
L’affirmation 3 est exacte.
Affirmation 1
Non.
Molécule de trifluorure de chlore :
- 1 atome de chlore = 17 électrons (dont 7 de valence : groupe 17, ou S2p5)
- 3 atome de fluor = 3x9 = 27 électrons
Total : 44 électrons = pas d’électrons célibataire.
Affirmation 2
Non.
1 électron célibataire = radical
Pour avoir un anion, l’électron doit provenir de l’extérieur : le nombre d’électrons doit être supérieur au total des électrons des atomes de la molécule.
Affirmation 4
Non.
[B] :
Le chlore du trifluorure de chlore voit 5 doublets, 10 électrons.
Les atomes de la troisième période du tableau de
classement périodique ne respectent pas strictement la règle de l’octet.
Pour systématiser la construction des molécules par la représentation des atomes :
1- Figurer les atomes suivants leurs nombres indiqués dans la formule,
2- Positionner les départs des doublets liants,
Le nombre des départs à représenter pour chaque atome s’obtient en inversant les indices nombres d’atomes.
3- Relier un à un les départs de liaisons,
4- Compléter la molécule en positionnant les doublets non liants,
5- Positionner les électrons célibataires éventuels restants.
6- En cas de molécule chargée, positionner la charge formelle
(Voir pages précédentes).
Compléter la molécule
L’étape, compléter la molécule, est la plus complexe :
- Trouver le nombre d’électrons de valence des atomes initiaux
(En
utilisant les groupes du tableau pour les blocs s et p, ou la représentation
des OA, s,p,d,f)
- Entourer l’atome initial, en respectant les règles, pour trouver le nombre de doublets et d’électrons célibataires initiaux,
- Si nécessaire, ouvrir un doublet pour obtenir 2 électrons et les compter dans les doublets liants,
- Dans un doublet liant, chaque atome de la liaison apporte un électron.
Exemples :
- L’atome
d’aluminium a 3 électrons de valence. L’atome est relié à 3 atomes d’oxygène
par 3 liaisons, chacune par un électron mis en commun.
- L’atome d’oxygène a 6 électrons de valence. Dans la molécule, 2 électrons
participent aux doublets liants : il faut rajouter, 4 électrons (2
doublets non liants).
Page 12.
Interactions faibles

Sélectionner l’affirmation exacte :
1- Les interactions électrostatiques se produisent entre molécules apolaires
2- Les interactions électrostatiques (liaisons de Van der Waals, ou « liaisons physiques ») sont plus intenses que les liaisons chimiques
3- Liaisons covalentes : Liaisons chimiques de partage de doublets liants entre atomes d’une molécule
4- Les liaisons de Van der Waals ne se créent qu’en cas de dipôles permanents
L’affirmation 3 est exacte.
Affirmation 1
Non.
Les interactions électrostatiques se produisent entre dipôles de molécules polarisées
Affirmation 2
Non.
Liaison de Van der Waals :
Interaction électrostatique de faible intensité entre molécules, atomes, ou entre une molécule et un cristal.
Liaisons chimiques :
Mise en
commun de doublet(s) liants, les liaisons covalentes.
Les liaisons covalentes sont plus fortes que les liaisons électrostatiques.
Affirmation 4
Non.
Liaisons de Van der Waals :
- Dipôle permanent <-> Dipôle permanent. Interaction de Keesom,
- Dipôle permanent <-> Dipôle induit. Interaction de Debye,
- Dipôle instantané <-> Dipôle instantané. Interaction de London.
Les
interactions de London sont moins fortes que les interactions de Debye.
Les interactions de Debye sont moins fortes que les interactions de Keesom.