Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Classification des atomes
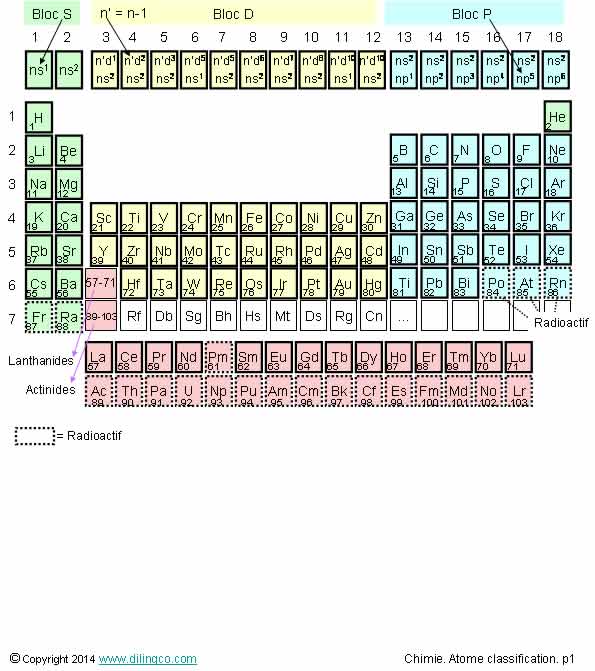
Sélectionner les deux affirmations exactes :
1- Classement atomique présenté : par masse atomique
2- Les électrons de valences sont les électrons les plus attachés
au noyau (et donc intervenant le moins dans les réactions chimiques)
3- Classement atomique présenté : par numéro atomique Z
4- Oxygène : 6 protons. Carbone : 8 protons
5- L’uranium est un actinide
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Le classement périodique présenté est fonction du numéro atomique
Z des atomes
La classification par masse atomique est celle du tableau initial de Mendeleïev.
Classement atomique usuel : le classement se fait par numéros
atomiques.
Affirmation 4
Non, c’est l’inverse.
Carbone : 6 protons et 6 électrons.
Oxygène : 8 protons et 8 électrons.
Ces valeurs sont à se rappeler.
Mnémotechnique : ordre alphabétique C, O, 6, 8
Affirmation 5
Oui.
L’uranium est un actinide.
Actinides : voir Wikipédia
Les
actinides sont des métaux lourds radioactifs, fissibles en neutrons rapides.
L’uranium et le thorium sont relativement abondants dans la
nature.
Lanthanides : voir Wikipédia
Les lanthanides font partie des « terres rares » de l’ancienne
appellation.
Sites Web
recommandés :
Tableau périodique :
http://fr.wikipedia.org/wiki/Tableau_périodique_des_éléments
Liste alphabétique des éléments chimiques :
http://fr.wikipedia.org/wiki/Liste_des_éléments
Tableau périodique
Le tableau de classification présenté :
- une évolution/actualisation de la classification de Mendeleïev,
- éléments chimiques rangés en fonction de leurs configurations
électroniques,
- fait ressortir des familles d’éléments, aux configurations et propriétés voisines.
Liste des éléments
Actinium Ac 89
Aluminium Al 13
Américium Am 95
Antimoine Sb 51
Argent Ag 47
Argon Ar 18
Arsenic As 33
Astate At 85
Azote N 7
Baryum Ba 56
Berkélium Bk 97
Béryllium Be 4
Bismuth Bi 83
Bohrium Bh 107
Bore B 5
Brome Br 35
Cadmium Cd 48
Césium Cs 55
Calcium Ca 20
Californium Cf 98
Carbone C 6
Cérium Ce 58
Chlore Cl 17
Chrome Cr 24
Cobalt Co 27
Copernicium Cn 112
Cuivre Cu 29
Curium Cm 96
DarmstadtiumDs 110
Dubnium Db 105
Dysprosium Dy 66
Einsteinium Es 99
Erbium Er 68
Étain Sn 50
Europium Eu 63
Fer Fe 26
Fermium Fm 100
Fluor F 9
Francium Fr 87
Gadolinium Gd 64
Gallium Ga 31
Germanium Ge 32
Hafnium Hf 72
Hassium Hs 108
Hélium He 2
Holmium Ho 67
Hydrogène H 1
Indium In 49
Iode I 53
Iridium Ir 77
Krypton Kr 36
Lanthane La 57
Lawrencium Lr 103
Lithium Li 3
Lutécium Lu 71
Magnésium Mg 12
Manganèse Mn 25
Meitnerium Mt 109
Mendélévium Md 101
Mercure Hg 80
Molybdène Mo 42
Néodyme Nd 60
Néon Ne 10
Neptunium Np 93
Nickel Ni 28
Niobium Nb 41
Nobélium No 102
Or Au 79
Osmium Os 76
Oxygène O 8
Palladium Pd 46
Phosphore P 15
Platine Pt 78
Plomb Pb 82
Plutonium Pu 94
Polonium Po 84
Potassium K 19
Praséodyme Pr 59
Prométhium Pm 61
Protactinium Pa 91
Radium Ra 88
Radon Rn 86
Rhénium Re 75
Rhodium Rh 45
Roentgenium Rg 111
Rubidium Rb 37
Ruthénium Ru 44
RutherfordiumRf 104
Samarium Sm 62
Scandium Sc 21
Seaborgium Sg 106
Sélénium Se 34
Silicium Si 14
Sodium Na 11
Soufre S 16
Strontium Sr 38
Tantale Ta 73
Technétium Tc 43
Tellure Te 52
Terbium Tb 65
Thallium Tl 81
Thorium Th 90
Thulium Tm 69
Titane Ti 22
Tungstène W 74
Ununhexium Uuh 116
Ununoctium Uuo 118
Ununpentium Uup 115
Ununquadium Uuq 114
Ununseptium Uus 117
Ununtrium Uut 113
Uranium U 92
Vanadium V 23
Xénon Xe 54
Ytterbium Yb 70
Yttrium Y 39
Zinc Zn 30
Zirconium Zr 40
Page 2.
Périodes & Groupes
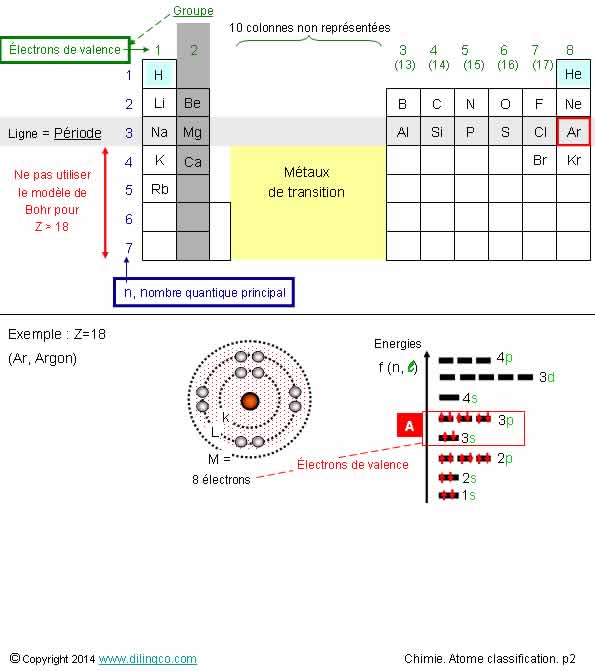
Sélectionner
l’affirmation exacte :
1- Les
lignes correspondent aux électrons de valence
2- Les colonnes
correspondent aux électrons de valence. Numéro de groupe = nombre d’électrons
de valence
3- [A] :
6 électrons de valence
4- Les
métaux de transition n’ont pas d’électrons de valence
L’affirmation
2 est exacte.
Affirmation 1
Non.
7 Lignes appelées « périodes », d’où classification « périodique »
des éléments chimiques ».
Une ligne correspond à une valeur de n, nombre quantique principal.
Affirmation
2
Oui.
Les colonnes correspondent aux électrons de valence.
Pour les atomes autres que les métaux de transition :
Colonne = Numéro de groupe = nombre d’électrons de valence
Note :
Si l’on
fait abstraction des 10 colonnes des métaux de transition, le numéro de colonne
(numéro de groupe) donne directement le nombre d’électrons de valence.
Si on
inclut les dix colonnes, le groupe 3 devient 13, etc. Retirer 10 du numéro de
groupe pour trouver le nombre d’électrons de valence.
Affirmation
3
Non.
8
électrons de valence.
Ici n le plus élevé = 3, 2 électrons sur 3s, 6 électrons sur 3p.
Rappel :
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Affirmation
4
Si.
Les
métaux de transition :
- 38
éléments,
-
appartiennent au bloc D (Voir pages suivantes)
- ont des
électrons de valence qui dépendent des orbitales s et d.
Page 3.
Blocs S, D, P, F
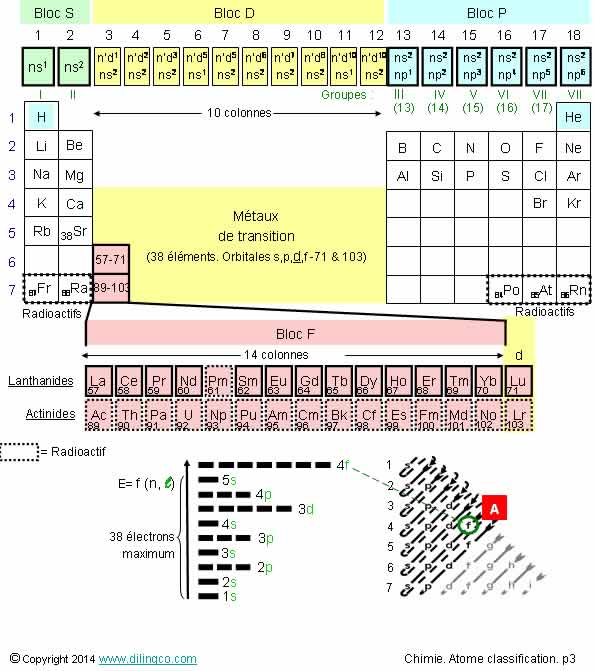
Sélectionner
les deux affirmations exactes :
1- Toutes
les périodes (lignes) ont 18 colonnes
2- Les
atomes du tableau périodique n’ont que des orbitales s, d, p
3- Périodes
6 et 7 : 32 colonnes (32 atomes)
4- Lanthanides
et actinides : les électrons de ces 28 atomes ne sont que dans les
orbitales f
5- [A] :
Certains atomes classés dans les métaux de transition ont des électrons
d’orbitales f. (Exemple 4f : n = 4 = période 4)
6- Orbitales
f : jamais dans des atomes du bloc p
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
Les
périodes, lignes, correspondent au nombre quantique n de l’atome.
Période
1 : 2 colonnes.
L’hélium
est dans la colonne 18, colonne des gaz rares : propriétés identiques à
celles d’un gaz rare.
Périodes
2 et 3 : 8 colonnes,
Périodes
4 et 5 : 18 colonnes,
Périodes
6 et 7 : 32 colonnes
Les 14 colonnes du bloc F sont
habituellement présentées en dessous de la ligne 7 pour ne pas alourdir la
présentation du tableau périodique.
Affirmation
4
Non.
Lanthanides
et actinides : les électrons de ces 28 atomes sont sur les orbitales
jusqu’à f.
Orbitales
s, et sous-couches p, d, f, répartis selon les règles de Pauli, Hund, etc.
Voir Orbitales
Affirmation
5
Oui.
Certains
atomes classés dans les métaux de transition ont des électrons d’orbitales f
Exemple : Hf, Halfnium :
1s2
2s2 2p6 3s2 3p6 4s2 3d10
4p6 5s2 4d10 5p6 6s2 4f14 5d2
Figure : Le Bloc F souligné est celui des atomes Lanthanides et Actinides.
Voir aussi la liste des Métaux de transition de Wikipédia
Affirmation
6
Si.
Les atomes supérieurs à Z=38 des blocs s, d, p ont des orbitales f.
Page 4.
Electrons de valence
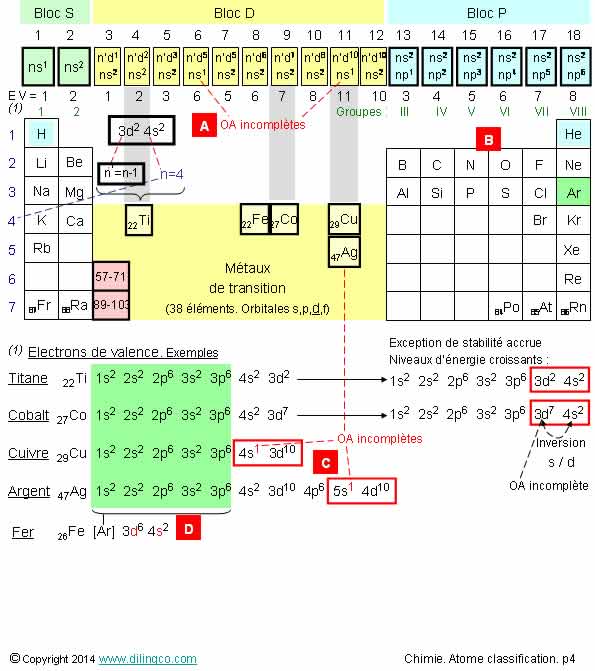
Sélectionner l’affirmation exacte :
1- [A]. Les orbitale s des colonnes 6 et 10 du bloc D sont
complètes
2- [B]. Azote : 5 électrons de valence, O, S : 6
électrons de valence
3- [C]. Cuivre : 10 électrons de valence
4- [D]. Fe : l’écriture est fausse (les orbitales d et s sont
inversées)
L’affirmation 2 est exacte.
Question 1
Non.
[A]. Pour être complètes, les orbitales s doivent contenir 2
électrons.
Affirmation 2
Oui.
[B]. Azote : 5 électrons de valence, O, S : 6 électrons
de valence
Les numéros des groupes des Bloc S et P donnent le nombre
d’électrons de valence.
Affirmation 3
Non.
[C]. Cuivre : 11 électrons de valence
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
(Ici 4s)
Voir Cu exception de stabilité pour comprendre l’inversion 4s 3d.
Affirmation 4
Non.
L’OA externe 3d a une énergie très légèrement supérieure à 4s.
Les OA
externes
3d 4s
peuvent s’inverser en cas de très légères variations d’énergies.
Au lieu d’écrire Fe : [Ar] 4s2 3d6
On écrit : Fe : [Ar] 3d6 4s2 pour montrer que les électrons
d’ionisation proviennent d’abord de l’orbitale s, et que les électrons
4s sont aussi des électrons de valence.
Notes :
- Même chose pour tous les autres éléments possédant des électrons
sur une OA externe 3d,
- La notation relative à [Ar], Argon, 18 électrons, évite d’avoir
à spécifier les orbitales basses.
Electrons
de valence
Rechercher Couche de valence sur Google
Note :
Les exemples titane et cobalt proviennent de Métaux de Transition
de Wikipédia. La liste ne fait pas apparaître l’inversion 4s 3d.
Bloc
s :
Nsx :
Exemple :
Ca. Calcium. Z=20
n=4 (4ème
ligne/période), deuxième colonne
ns2 = 4s2 : 2 électrons de valence. Sur l’orbitale 4s
Nombre total d’électrons :
20 électrons au total (18 électrons de cœur, 2 électrons de valence)
Bloc D :
n’dx nsy
Exemple : CU, Cuivre. Z=29
n=4 (4ème
ligne/période), onzième colonne
n’= 4-1=3
n’d10 ns1=3d10 4s1
Le cuivre est une exception de stabilité : inverser 4d et 3d.
4s1 3d10
29 électrons (18 électrons de cœur, 11 électrons de valence)
Bloc P :
Exemple : B, Bore. Z=5
n=2
2s2 2p1
2 électrons de cœur, 3 électrons de valence
Page 5.
Métaux
Figure :
Les métaux sont soulignés en grisé.
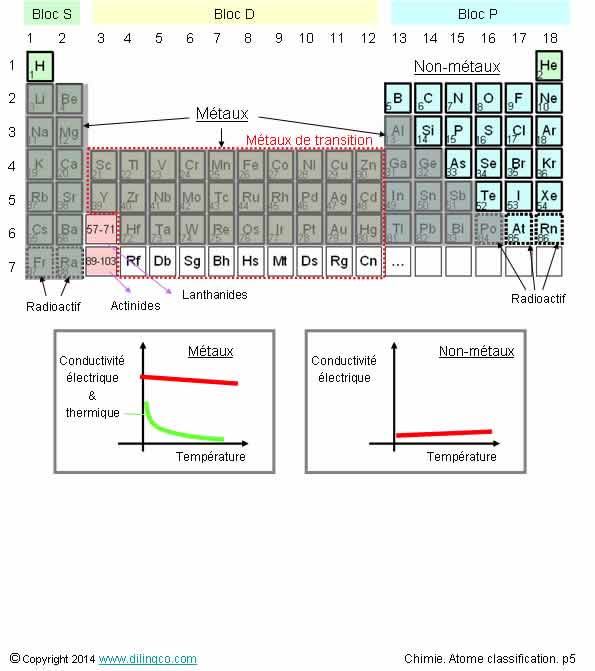
Sélectionner
l’affirmation exacte :
1- Le
manganèse n’est pas un métal
2- Le
Fluor est un métal
3- Les
métaux sont moins conducteurs que les non métaux.
4- Quand
la température augmente, un isolant perd de sa capacité d'isolation électrique
et thermique. Inversement un conducteur perd de sa conductibilité
L’affirmation
4 est exacte.
Les métaux sont de plus ou moins bons conducteurs
électrique et thermique.
Les non-métaux sont, à l’inverse, des isolants.
Page 6.
Familles du bloc p
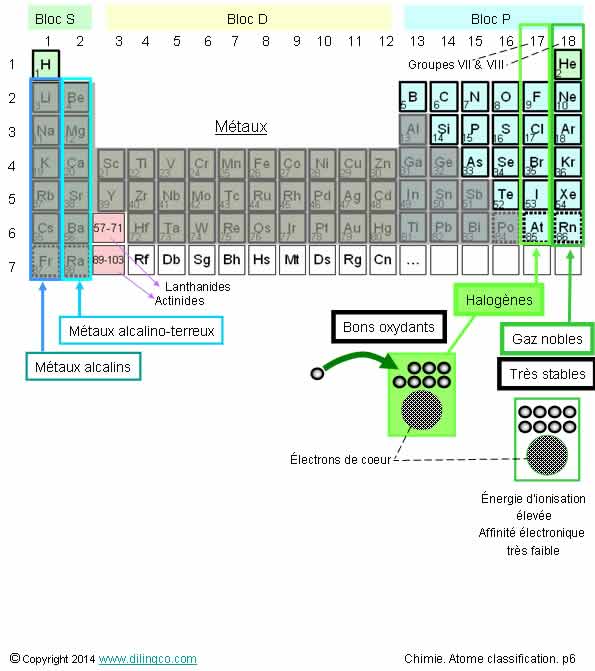
Sélectionner
les deux affirmations exactes :
1- L’hélium
est classé dans la colonne 18 : propriétés identiques à celles des gaz
nobles (ou gaz rares)
2- Famille d’éléments : même colonne du tableau, même nombre d’électrons
de valence, propriétés chimiques similaires
3- Une
configuration en np6 est très peu stable
4- Tous
les corps simples halogènes sont des gaz
5- Les
halogènes, comme les gaz rares, sont très stables
Les
affirmations 1 et 2 sont exactes.
Affirmation
3
Non.
np6 = bloc p
Bloc
p : 6 colonnes, np1, np2, np3, np4, np5, np6
(Voir
pages précédentes)
np6 =
groupe VII = colonne des gaz rares (ou nobles)
Couche de
valence complète à 8 électrons : Les gaz nobles sont
très stables.
Énergie d’ionisation élevée.
Affinité
électronique pratiquement nulle.
Affirmation
4
Non.
Exemples :
Br2
= di-brome = liquide,
I2
= di-ode = solide.
Affirmation
5
Non.
Les halogènes gagnent facilement un électron = bons oxydants.
Gaz
rares
- Colonne 18,
- Aussi
appelés gaz nobles,
- Très peu réactifs (configuration électronique très stable),
-
Configuration de valence en ns2 np6,
- Les
corps simples sont des gaz monoatomiques.
(Corps
simples : éléments composés d’atomes identiques).
Hélium
L’hélium
est classé dans la colonne 18 du fait de ses propriétés comparables à celles
des gaz nobles.
Une particule alpha est un noyau d'hélium He2+
(atome d'hélium ayant perdu 2 électrons).
Halogènes
- Colonne 17,
- Oxydants
En
gagnant un électrons, les anions obtiennent une configuration de valence en np6 ;
configuration très stables (celle des gaz rares)
- Les
corps simples correspondants sont formés de deux atomes.
Page 7.
Familles du bloc s
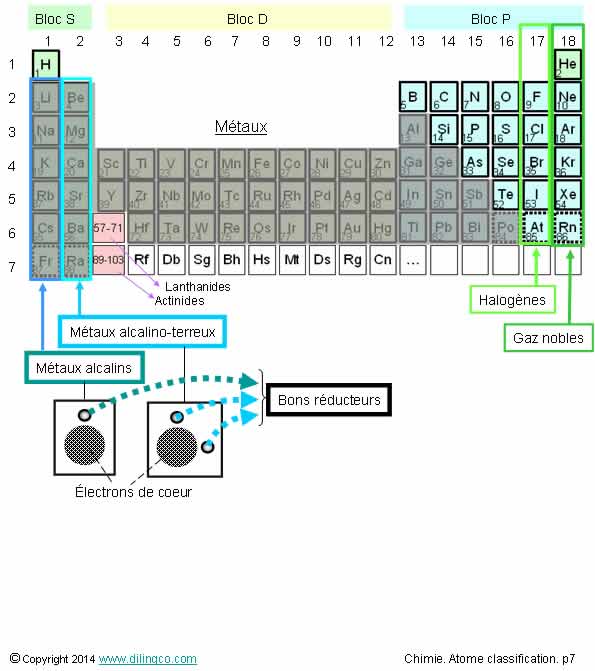
Sélectionner
l’affirmation exacte :
1- Les alcalin
et les alcalino-terreux ne sont pas des métaux
2- Ions
alcalins et alcalino-terreux sont des anions
3- Métaux
alcalins et alcalino-terreux : bons réducteurs
4- Métaux
alcalins et alcalino-terreux : énergie d’ionisation très élevée
L’affirmation
3 est exacte.
Affirmation
1
Si.
Les alcalin
et les alcalino-terreux sont des métaux.
Voir page précédente « Métaux ».
Affirmation
2
Non.
Les
alcalins et les alcalino-terreux perdent 1 ou 2
électrons= cation.
Leur
charge devient positive par manque d’électron(s) : cation.
Rappel :
Un cation, par besoin de
récupérer un électron, est attiré par une cathode
lors de l’électrolyse.
Un cation
a une charge globale positive :
moins d’électrons que de protons
Exemples :
Na+, K+
Na :
Sodium, K : Potassium
Affirmation
3
Oui.
Les métaux alcalins et alcalino-terreux perdent facilement 1 ou 2
électrons : ils sont de bons réducteurs
Affirmation
4
Non.
Les
métaux alcalins et les métaux alcalino-terreux sont très
réactifs et perdent facilement 1 ou 2 électrons pour retrouver une
configuration des gaz rares très stable (8 électrons sur l’OA externe).
Ils ont
un potentiel de première ionisation le plus faible
de leur période.
A la
configuration stable, 8 électrons externes le potentiel d’ionisation est très
élevé.
Métaux
alcalins
- Première colonne du tableau,
(À
l’exception de l’hydrogène)
- Réducteurs (Libèrent un électron),
- très
réactifs.
Métaux
alcalino-terreux
- Deuxième colonne du tableau,
- Réducteurs (Libèrent deux électrons),
- très réactifs.
Page
8.
Mnémotechnique
Lili Becha Bien Chez Notre Oncle Ferdinand Nestor
Napoléon, Mangea Allègrement Six Poulets Sans Claquer d' Argent
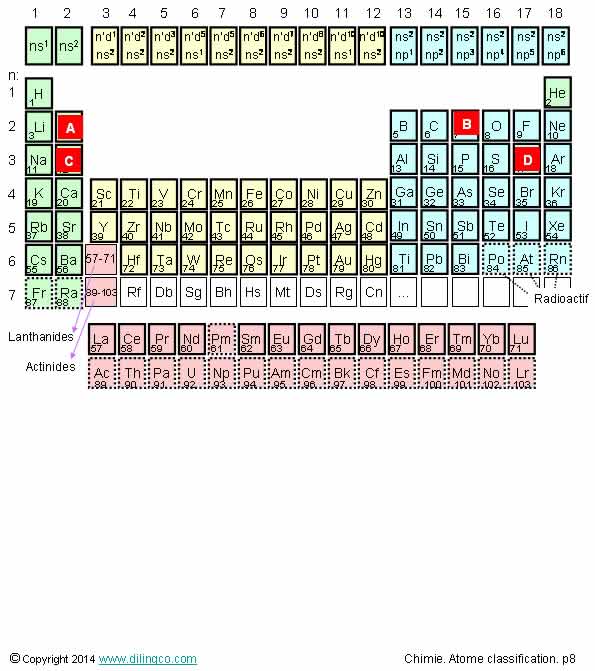
Sélectionner
l’affirmation exacte :
1- [A]:
B, Bore
2- [B]:
N, Azote
3- [C]:
Manganèse
4- [D]:
Soufre
L’affirmation
2 est exacte.
Période
2
Lithium, Béryllium, Bore,
Carbone, Nitrogène
(Azote), Oxygène, Fluor, Néon.
Mnémotechnique (exemple) :
« Lili Becha Bien Chez Notre Oncle Ferdinand Nestor »
Période 3
Sodium(Na), Magnésium, Aluminium, Silicium, Phosphore, Soufre, Chlore, Argon.
Napoléon, Mangea Allègrement Six Poulets Sans Claquer d' Argent
Période 4
(Voir Internet)
Rechercher
« Mnémotechnique tableau périodique » sur Internet pour trouver de
nombreux exemples.
Période
2
« Lili Becha Bien Chez Notre Oncle Ferdinand Nestor »
Période 3
Napoléon, Mangea Allègrement Six Poulets Sans Claquer d' Argent
Période 4
…Voir Internet.
Page
9.
Volume d’un atome
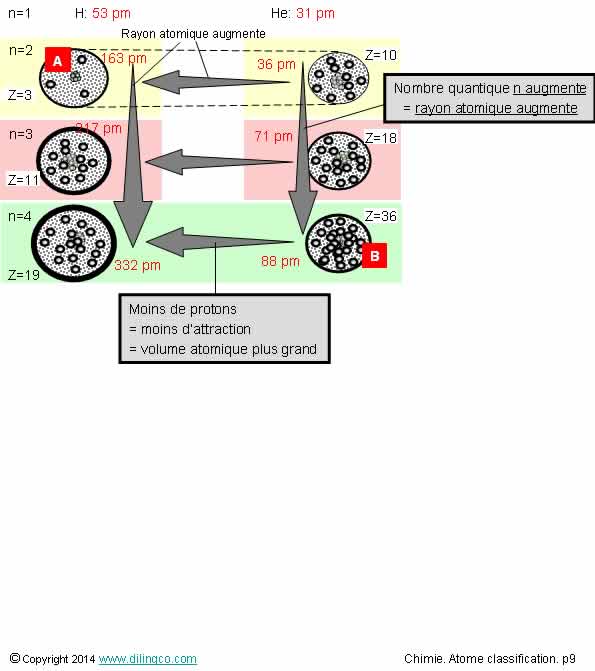
Sélectionner
l’affirmation exacte :
1- Même
période : Plus il ya d’électrons plus gros est l’atome
2- Même
colonne : Plus le nombre quantique n croît, plus gros est l’atome 3- Un
atome avec beaucoup d’électrons est toujours plus gros qu’un atome de nombre
d’électron plus petit
4-
L’hélium est le plus gros atome
L’affirmation
2 est exacte.
Affirmation
3
Non.
Idée fausse : Le volume d’un atome dépend de son
nombre d’électrons.
A n constant, la somme des attractions des protons prime sur le
nombre d’électrons
= contracte l’atome.
Affirmation
3 :
Non.
Un atome
avec beaucoup d’orbitales et n important, peut
être plus petit qu’un atome de nombre quantique n inférieur (les OA
sont toutes centrées sur le noyau et ne se « rajoutent pas » mais se
combines).
Affirmation
4 :
Non.
L’hélium
est le plus petit
atome.
Rayon
atomique
Le rayon
atomique (rayon de l’orbitale de valence) :
-
S’accroît avec le nombre quantique n,
- Diminue
avec la charge effective Z* du noyau
(Z*= Z –
constant d’écran des électrons)
La charge effective du noyau apparaît plus petite :
Zi* = Z - s
s
= constante d'écran
d’autant importante que le nombre d’électrons est important.
Notes :
- Figure : pm= pico mètre = 10-12
m
- L’énergie est à calculer pour chaque électron de l’atome
(indice i dans la formule).
Voir :
- chapitre Atome quantique,
- “Calcul de la charge effective. Règles de Slater” sur
Wikipédia.
Evolutions
sur une ligne
L’attraction du noyau sur les électrons augmente avec
le nombre de protons.
Plus de protons = plus de charges = plus d’attraction =
moins de volume.
Note :
Les
évolutions volumiques présentées sont globalement vraies.
Il peut y
avoir, dans le détail, des atomes voisins, qui ne respectent pas les tendances
générales.
Evolutions
sur une colonne
Une
colonne correspond à des atomes avec la même configuration de valence.
Le nombre et l’énergie des orbitales des atomes
d’une même colonne, et donc le volume
de l’atome, s’accroît avec le nombre quantique n.
Page 10.
Électronégativité. Ionisation
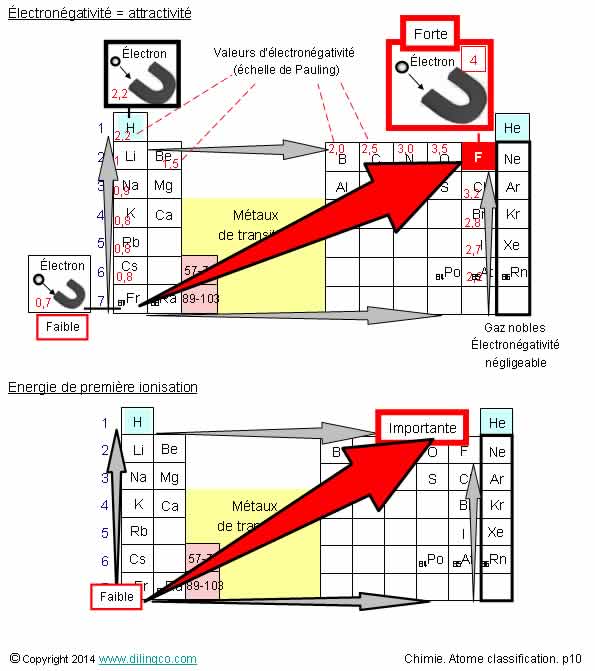
Sélectionner
l’affirmation exacte :
1- Electronégativité :
capacité d’un atome à repousser des électrons d’un atome voisin
2-
Energie d’ionisation : énergie produite lors de l’ionisation d’un atome
3- Métaux
alcalins et alcalino-terreux : énergie d’ionisation très élevée
4- Le Fluor a la plus grande électronégativité. L’électronégativité
des gaz rares est très faible.
L’affirmation
4 est exacte.
Affirmation
1
Non.
Electronégativité : capacité d’un atome à
attirer des électrons d’atomes voisins.
= capacité à établir des liaisons avec d’autres atomes. L’électronégativité des gaz rares est très faible.
La
différence d’électronégativité entre les 2 éléments détermine la nature de la
liaison covalente obtenue.
Voir ci-dessous.
Affirmation
2
Non.
Energie
de première ionisation : énergie à fournir à
un atome isolé (gazeux) pour lui
arracher son premier électron.
A(g)
------> A+(g) + e- = ion + électron libre
Notes :
- Après
la première ionisation, il peut y avoir d’autres arrachements d’électrons,
d’autres ionisations : deuxième ionisation, etc.
- Les
énergies nécessaires pour ces ionisations ne sont pas liées à l’énergie de
première ionisation. Elles dépendent des structures électroniques successives
obtenues.
Exemple :
-
première ionisation d’un métal alcalin : facile (bon réducteur),
- seconde
ionisation, pour lui arracher 1 de ses 8 électrons externes = difficile.
Affirmation
3
Non.
Les métaux alcalins et les métaux alcalino-terreux sont très
réactifs et perdent facilement 1 ou 2 électrons pour retrouver une
configuration des gaz rares très stable (8 électrons sur l’OA externe).
Ils ont
un potentiel de première ionisation le plus faible
de leur période.
A la
configuration stable, 8 électrons externes, l’énergie d’ionisation est très
élevée.
Affirmation
4
Oui.
Le Fluor est le plus électronégatif du tableau.
(À la
meilleure propension à attirer un électron)
Par
contre, l’électronégativité des gaz rares est très
faible
(N’attirent
pas les électrons des éléments voisins, ayant déjà 8 électrons en couche
externe)
Electronégativité
- Capacité d’un élément, à attirer des électrons d’un autre élément,
(Élément :
atome ou molécule)
- La différence des électronégativités de deux
éléments détermine la nature de la liaison
chimique :
- Différence < 1,7 => Liaison covalente
-
Différence > 1,7 => Liaison covalente dite « ionique »
(Les liaisons chimiques sont étudiées dans le chapitre molécules)
- L’échelle
de Pauling est la plus utilisée pour calculer la différence d’électonégativité,
- Le Fluor est l’élément le plus électronégatif du
tableau (4 sur l’échelle de Pauling).
Le
Francium, en bas à gauche du tableau, a la plus petite électronégativité
(Si on fait
exception des gaz rares qui sont très stables)
Energie
d’ionisation
Energie à fournir à un atome, ou à une molécule, pour lui arracher un électron.
On
définit des énergies de première ionisation, enlever le premier électron, de
deuxième ionisation, etc.
Evolutions
sur une ligne (période)
L’attraction du noyau sur les électrons augmente
avec sont nombre de protons (plus
de protons = plus d’attraction = plus d’énergie à fournir pour arracher un
électron) : L’énergie d’ionisation augmente de
gauche à droite sur une période (ligne),
L’électronégativité augmente de gauche à droite sur une période. L’atome
cherchant à obtenir un, ou des, électrons pour compléter sa couche externe à 8
électrons.
Notes :
-
Exception de la dernière colonne, les gaz rares, qui sont très stables Les
évolutions présentées sont globalement vraies.
- Il peut
y avoir, dans le détail, des atomes voisins, qui ne respectent pas les
tendances générales.
Evolutions
sur une colonne
Les
diagrammes d’énergies du chapitre précédent Polyélectrons montrent que le
nombre quantique n évolue avec le nombre d’électrons.
La constante d’écran est liée au nombre d’électrons.
- L’énergie d’ionisation augmente de bas en haut
(lorsque n diminue = moins d’écran),
- L’électronégativité augmente également de bas en
haut (lorsque n diminue =moins
d’écran).
Mnémotechnique
Pour
retenir l’ordre des éléments les plus électronégatifs :
font que le brome s’y cache (et inverser N et CI)
F
- O – N - CI - Br – S - C - H
F
- O – CI – N - Br – S - C - H
Page 11.
Masses & volumes molaires
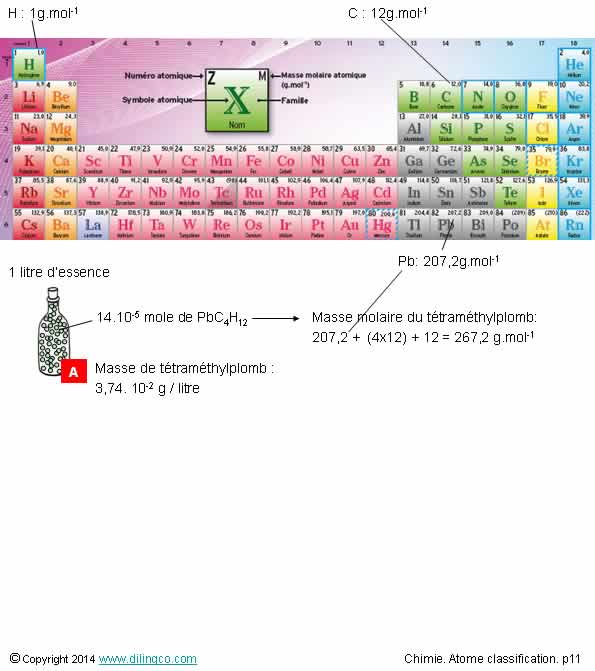
Sélectionner
les deux affirmations exactes :
1- Mole =
masse molaire
2- Les
nombres d’atomes d’une mole d’atomes de plomb et d’une mole d’atomes de carbone
sont différents (Le plomb est plus lourd que le carbone)
3- Les
masses atomiques du plomb et du carbone sont identiques
4- [A] :
Masse de tétraméthylplomb dans un litre d’essence = nombre de moles par litre x
masse molaire du tétraméthylplomb
5- Masse
molaire de l’eau : 2x1 + 16 = 18g par mole
6- Aux CNTP,
le volume molaire d’un gaz parfait = 24 litres par mole
Les affirmations
4 et 5 sont exactes.
Affirmation1
Non
Mole : quantité d’éléments = 602 000 000 000 000 000 000 000
éléments.
(1 mole
d’atomes si les éléments considérés sont des atomes)
Masse molaire = masse d’une mole d’éléments.
Si on
considère des atomes, la masse molaire dépend de la masse atomique des
atomes ; Masse différente d’un atome à l’autre.
Affirmations
2
Non.
Une mole est une quantité.
Dans une
mole il y a toujours le même nombre d’éléments :
602 000 000 000 000 000 000 000 éléments.
(Atomes
si on considère une mole d’atomes).
Les masses atomiques, et donc les molaires, des atomes de plomb et de carbone
sont différentes ; ce qui explique les différences de masses.
Affirmation
3
Non.
Masse (molaire)
atomique du plomb : 207,2 u environ
Masse (molaire)
atomique du carbone : 12, 01 u environ
u :
unité de masse
des atomes : 1, 66 10-27 kg environ
Affirmation
5
Oui.
Le tableau périodique donne la masse molaire des corps simples.
Exemples :
Hydrogène :
1g par mole,
Carbone :
12g par mole,
Oxygène :
16g par mole.
Masse molaire d’un corps composé = somme des masses molaires de
ses composants.
Exemple : H2O = 2x1 + 16 = 18g par mole
(18g.mol-1)
Affirmation
6
Non.
Volume molaire : volume occupé par une mole.
Pour les
gaz parfaits Vm =Volume /n moles.
CNTP :
Conditions normales de température et de pression.
- t=O°C
(Ou 273,15 T absolue)
- P= 1013
hPa
CNTP, volume molaire d’un gaz parfait = 22,4 litres par mole
Pression
atmosphérique, 20°C : 24 litres par mole.
(Pa/20°C :
gaz moins compressé)
Rappel :
1 m3
= 1000L
CNTP,
volume molaire d’un gaz parfait = 0,0224 m3. mol-1
Rappels :
1 Mole :
=
quantité d’éléments identique au nombre d’atomes contenu dans 12 grammes de
carbone 12
(12 :
isotope 12)
= 6,02214040×1023 atomes
= Nombre d’Avogadro
(Symbole :
NA)
Dans les
formules de masse, cette constante est l’inverse d’une quantité de matière,
d’où la notation mol-1.
u :
unité de masse
des atomes : 1, 66 10-27 kg environ
Masses
La masse atomique, masse d’une mole d’atomes, est exprimée en g.mol-1
(g.mol-1 : Grammes par mole)
La masse molaire d’une molécule est la somme des masses atomiques des atomes
constituants la molécule.
(Ne pas
oublier les coefficients stoechiométriques)
Page 12.
Révision. Exemple :
Carbone

Sélectionner
l’affirmation exacte :
1-
[A] : 6 électrons de valence = groupe 6
2-
[B] : Deuxième période, bloc d
3-
[C] : Le carbone a une bonne électronégativité
4-
[D] : 4 électrons de valence = 4 énergies d’ionisation possibles
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A] :
4 électrons de valence = groupe 4
Affirmation
2
Non.
[B] :
Deuxième période, bloc p
Affirmation
3
Oui.
[C] :
Oui, le carbone a une bonne électronégativité.
(Mais
bien sûr moins que le fluor, revoir figure d’une page précédente)
Affirmation
4
Non.
[D] :
4 électrons de valence
Tous les
électrons d’un atome peuvent être arrachés, si on y met de l’énergie !
= 6
énergies d’ionisation possibles
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Classification des atomes

Sélectionner les deux affirmations exactes :
1- Classement atomique présenté : par masse atomique
2- Les électrons de valences sont les électrons les plus attachés au noyau (et donc intervenant le moins dans les réactions chimiques)
3- Classement atomique présenté : par numéro atomique Z
4- Oxygène : 6 protons. Carbone : 8 protons
5- L’uranium est un actinide
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Le classement périodique présenté est fonction du numéro atomique Z des atomes
La classification par masse atomique est celle du tableau initial de Mendeleïev.
Classement atomique usuel : le classement se fait par numéros atomiques.
Affirmation 4
Non, c’est l’inverse.
Carbone : 6 protons et 6 électrons.
Oxygène : 8 protons et 8 électrons.
Ces valeurs sont à se rappeler.
Mnémotechnique : ordre alphabétique C, O, 6, 8
Affirmation 5
Oui.
L’uranium est un actinide.
Actinides : voir Wikipédia
Les
actinides sont des métaux lourds radioactifs, fissibles en neutrons rapides.
L’uranium et le thorium sont relativement abondants dans la nature.
Lanthanides : voir Wikipédia
Les lanthanides font partie des « terres rares » de l’ancienne
appellation.
Sites Web recommandés :
Tableau périodique :
http://fr.wikipedia.org/wiki/Tableau_périodique_des_éléments
Liste alphabétique des éléments chimiques :
http://fr.wikipedia.org/wiki/Liste_des_éléments
Tableau périodique
Le tableau de classification présenté :
- une évolution/actualisation de la classification de Mendeleïev,
- éléments chimiques rangés en fonction de leurs configurations électroniques,
- fait ressortir des familles d’éléments, aux configurations et propriétés voisines.
Liste des éléments
Actinium Ac 89
Aluminium Al 13
Américium Am 95
Antimoine Sb 51
Argent Ag 47
Argon Ar 18
Arsenic As 33
Astate At 85
Azote N 7
Baryum Ba 56
Berkélium Bk 97
Béryllium Be 4
Bismuth Bi 83
Bohrium Bh 107
Bore B 5
Brome Br 35
Cadmium Cd 48
Césium Cs 55
Calcium Ca 20
Californium Cf 98
Carbone C 6
Cérium Ce 58
Chlore Cl 17
Chrome Cr 24
Cobalt Co 27
Copernicium Cn 112
Cuivre Cu 29
Curium Cm 96
DarmstadtiumDs 110
Dubnium Db 105
Dysprosium Dy 66
Einsteinium Es 99
Erbium Er 68
Étain Sn 50
Europium Eu 63
Fer Fe 26
Fermium Fm 100
Fluor F 9
Francium Fr 87
Gadolinium Gd 64
Gallium Ga 31
Germanium Ge 32
Hafnium Hf 72
Hassium Hs 108
Hélium He 2
Holmium Ho 67
Hydrogène H 1
Indium In 49
Iode I 53
Iridium Ir 77
Krypton Kr 36
Lanthane La 57
Lawrencium Lr 103
Lithium Li 3
Lutécium Lu 71
Magnésium Mg 12
Manganèse Mn 25
Meitnerium Mt 109
Mendélévium Md 101
Mercure Hg 80
Molybdène Mo 42
Néodyme Nd 60
Néon Ne 10
Neptunium Np 93
Nickel Ni 28
Niobium Nb 41
Nobélium No 102
Or Au 79
Osmium Os 76
Oxygène O 8
Palladium Pd 46
Phosphore P 15
Platine Pt 78
Plomb Pb 82
Plutonium Pu 94
Polonium Po 84
Potassium K 19
Praséodyme Pr 59
Prométhium Pm 61
Protactinium Pa 91
Radium Ra 88
Radon Rn 86
Rhénium Re 75
Rhodium Rh 45
Roentgenium Rg 111
Rubidium Rb 37
Ruthénium Ru 44
RutherfordiumRf 104
Samarium Sm 62
Scandium Sc 21
Seaborgium Sg 106
Sélénium Se 34
Silicium Si 14
Sodium Na 11
Soufre S 16
Strontium Sr 38
Tantale Ta 73
Technétium Tc 43
Tellure Te 52
Terbium Tb 65
Thallium Tl 81
Thorium Th 90
Thulium Tm 69
Titane Ti 22
Tungstène W 74
Ununhexium Uuh 116
Ununoctium Uuo 118
Ununpentium Uup 115
Ununquadium Uuq 114
Ununseptium Uus 117
Ununtrium Uut 113
Uranium U 92
Vanadium V 23
Xénon Xe 54
Ytterbium Yb 70
Yttrium Y 39
Zinc Zn 30
Zirconium Zr 40
Page 2.
Périodes & Groupes

Sélectionner l’affirmation exacte :
1- Les lignes correspondent aux électrons de valence
2- Les colonnes correspondent aux électrons de valence. Numéro de groupe = nombre d’électrons de valence
3- [A] : 6 électrons de valence
4- Les métaux de transition n’ont pas d’électrons de valence
L’affirmation 2 est exacte.
Affirmation 1
Non.
7 Lignes appelées « périodes », d’où classification « périodique » des éléments chimiques ».
Une ligne correspond à une valeur de n, nombre quantique principal.
Affirmation 2
Oui.
Les colonnes correspondent aux électrons de valence.
Pour les atomes autres que les métaux de transition :
Colonne = Numéro de groupe = nombre d’électrons de valence
Note :
Si l’on fait abstraction des 10 colonnes des métaux de transition, le numéro de colonne (numéro de groupe) donne directement le nombre d’électrons de valence.
Si on inclut les dix colonnes, le groupe 3 devient 13, etc. Retirer 10 du numéro de groupe pour trouver le nombre d’électrons de valence.
Affirmation 3
Non.
8 électrons de valence.
Ici n le plus élevé = 3, 2 électrons sur 3s, 6 électrons sur 3p.
Rappel :
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Affirmation 4
Si.
Les métaux de transition :
- 38 éléments,
- appartiennent au bloc D (Voir pages suivantes)
- ont des électrons de valence qui dépendent des orbitales s et d.
Page 3.
Blocs S, D, P, F

Sélectionner les deux affirmations exactes :
1- Toutes les périodes (lignes) ont 18 colonnes
2- Les atomes du tableau périodique n’ont que des orbitales s, d, p
3- Périodes 6 et 7 : 32 colonnes (32 atomes)
4- Lanthanides et actinides : les électrons de ces 28 atomes ne sont que dans les orbitales f
5- [A] : Certains atomes classés dans les métaux de transition ont des électrons d’orbitales f. (Exemple 4f : n = 4 = période 4)
6- Orbitales f : jamais dans des atomes du bloc p
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Les périodes, lignes, correspondent au nombre quantique n de l’atome.
Période 1 : 2 colonnes.
L’hélium est dans la colonne 18, colonne des gaz rares : propriétés identiques à celles d’un gaz rare.
Périodes 2 et 3 : 8 colonnes,
Périodes 4 et 5 : 18 colonnes,
Périodes 6 et 7 : 32 colonnes
Les 14 colonnes du bloc F sont habituellement présentées en dessous de la ligne 7 pour ne pas alourdir la présentation du tableau périodique.
Affirmation 4
Non.
Lanthanides et actinides : les électrons de ces 28 atomes sont sur les orbitales jusqu’à f.
Orbitales s, et sous-couches p, d, f, répartis selon les règles de Pauli, Hund, etc.
Voir Orbitales
Affirmation 5
Oui.
Certains atomes classés dans les métaux de transition ont des électrons d’orbitales f
Exemple : Hf, Halfnium :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2
Figure : Le Bloc F souligné est celui des atomes Lanthanides et Actinides.
Voir aussi la liste des Métaux de transition de Wikipédia
Affirmation 6
Si.
Les atomes supérieurs à Z=38 des blocs s, d, p ont des orbitales f.
Page 4.
Electrons de valence

Sélectionner l’affirmation exacte :
1- [A]. Les orbitale s des colonnes 6 et 10 du bloc D sont complètes
2- [B]. Azote : 5 électrons de valence, O, S : 6 électrons de valence
3- [C]. Cuivre : 10 électrons de valence
4- [D]. Fe : l’écriture est fausse (les orbitales d et s sont inversées)
L’affirmation 2 est exacte.
Question 1
Non.
[A]. Pour être complètes, les orbitales s doivent contenir 2 électrons.
Affirmation 2
Oui.
[B]. Azote : 5 électrons de valence, O, S : 6 électrons de valence
Les numéros des groupes des Bloc S et P donnent le nombre d’électrons de valence.
Affirmation 3
Non.
[C]. Cuivre : 11 électrons de valence
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
(Ici 4s)
Voir Cu exception de stabilité pour comprendre l’inversion 4s 3d.
Affirmation 4
Non.
L’OA externe 3d a une énergie très légèrement supérieure à 4s.
Les OA
externes
3d 4s
peuvent s’inverser en cas de très légères variations d’énergies.
Au lieu d’écrire Fe : [Ar] 4s2 3d6
On écrit : Fe : [Ar] 3d6 4s2 pour montrer que les électrons d’ionisation proviennent d’abord de l’orbitale s, et que les électrons 4s sont aussi des électrons de valence.
Notes :
- Même chose pour tous les autres éléments possédant des électrons sur une OA externe 3d,
- La notation relative à [Ar], Argon, 18 électrons, évite d’avoir à spécifier les orbitales basses.
Electrons de valence
Rechercher Couche de valence sur Google
Note :
Les exemples titane et cobalt proviennent de Métaux de Transition de Wikipédia. La liste ne fait pas apparaître l’inversion 4s 3d.
Bloc s :
Nsx :
Exemple : Ca. Calcium. Z=20
n=4 (4ème ligne/période), deuxième colonne
ns2 = 4s2 : 2 électrons de valence. Sur l’orbitale 4s
Nombre total d’électrons :
20 électrons au total (18 électrons de cœur, 2 électrons de valence)
Bloc D :
n’dx nsy
Exemple : CU, Cuivre. Z=29
n=4 (4ème
ligne/période), onzième colonne
n’= 4-1=3
n’d10 ns1=3d10 4s1
Le cuivre est une exception de stabilité : inverser 4d et 3d.
4s1 3d10
29 électrons (18 électrons de cœur, 11 électrons de valence)
Bloc P :
Exemple : B, Bore. Z=5
n=2
2s2 2p1
2 électrons de cœur, 3 électrons de valence
Page 5.
Métaux
Figure : Les métaux sont soulignés en grisé.

Sélectionner l’affirmation exacte :
1- Le manganèse n’est pas un métal
2- Le Fluor est un métal
3- Les métaux sont moins conducteurs que les non métaux.
4- Quand la température augmente, un isolant perd de sa capacité d'isolation électrique et thermique. Inversement un conducteur perd de sa conductibilité
L’affirmation 4 est exacte.
Les métaux sont de plus ou moins bons conducteurs électrique et thermique.
Les non-métaux sont, à l’inverse, des isolants.
Page 6.
Familles du bloc p

Sélectionner les deux affirmations exactes :
1- L’hélium
est classé dans la colonne 18 : propriétés identiques à celles des gaz
nobles (ou gaz rares)
2- Famille d’éléments : même colonne du tableau, même nombre d’électrons
de valence, propriétés chimiques similaires
3- Une configuration en np6 est très peu stable
4- Tous les corps simples halogènes sont des gaz
5- Les halogènes, comme les gaz rares, sont très stables
Les affirmations 1 et 2 sont exactes.
Affirmation 3
Non.
np6 = bloc p
Bloc p : 6 colonnes, np1, np2, np3, np4, np5, np6
(Voir pages précédentes)
np6 = groupe VII = colonne des gaz rares (ou nobles)
Couche de
valence complète à 8 électrons : Les gaz nobles sont
très stables.
Énergie d’ionisation élevée.
Affinité électronique pratiquement nulle.
Affirmation 4
Non.
Exemples :
Br2 = di-brome = liquide,
I2 = di-ode = solide.
Affirmation 5
Non.
Les halogènes gagnent facilement un électron = bons oxydants.
Gaz rares
- Colonne 18,
- Aussi appelés gaz nobles,
- Très peu réactifs (configuration électronique très stable),
- Configuration de valence en ns2 np6,
- Les corps simples sont des gaz monoatomiques.
(Corps simples : éléments composés d’atomes identiques).
Hélium
L’hélium est classé dans la colonne 18 du fait de ses propriétés comparables à celles des gaz nobles.
Une particule alpha est un noyau d'hélium He2+ (atome d'hélium ayant perdu 2 électrons).
Halogènes
- Colonne 17,
- Oxydants
En gagnant un électrons, les anions obtiennent une configuration de valence en np6 ; configuration très stables (celle des gaz rares)
- Les corps simples correspondants sont formés de deux atomes.
Page 7.
Familles du bloc s

Sélectionner l’affirmation exacte :
1- Les alcalin et les alcalino-terreux ne sont pas des métaux
2- Ions alcalins et alcalino-terreux sont des anions
3- Métaux alcalins et alcalino-terreux : bons réducteurs
4- Métaux alcalins et alcalino-terreux : énergie d’ionisation très élevée
L’affirmation 3 est exacte.
Affirmation 1
Si.
Les alcalin et les alcalino-terreux sont des métaux.
Voir page précédente « Métaux ».
Affirmation 2
Non.
Les alcalins et les alcalino-terreux perdent 1 ou 2 électrons= cation.
Leur charge devient positive par manque d’électron(s) : cation.
Rappel :
Un cation, par besoin de récupérer un électron, est attiré par une cathode lors de l’électrolyse.
Un cation a une charge globale positive : moins d’électrons que de protons
Exemples : Na+, K+
Na : Sodium, K : Potassium
Affirmation 3
Oui.
Les métaux alcalins et alcalino-terreux perdent facilement 1 ou 2 électrons : ils sont de bons réducteurs
Affirmation 4
Non.
Les métaux alcalins et les métaux alcalino-terreux sont très réactifs et perdent facilement 1 ou 2 électrons pour retrouver une configuration des gaz rares très stable (8 électrons sur l’OA externe).
Ils ont un potentiel de première ionisation le plus faible de leur période.
A la configuration stable, 8 électrons externes le potentiel d’ionisation est très élevé.
Métaux alcalins
- Première colonne du tableau,
(À l’exception de l’hydrogène)
- Réducteurs (Libèrent un électron),
- très
réactifs.
Métaux alcalino-terreux
- Deuxième colonne du tableau,
- Réducteurs (Libèrent deux électrons),
- très réactifs.
Page 8.
Mnémotechnique
Lili Becha Bien Chez Notre Oncle Ferdinand Nestor
Napoléon, Mangea Allègrement Six Poulets Sans Claquer d' Argent

Sélectionner l’affirmation exacte :
1- [A]: B, Bore
2- [B]: N, Azote
3- [C]: Manganèse
4- [D]: Soufre
L’affirmation 2 est exacte.
Période 2
Lithium, Béryllium, Bore, Carbone, Nitrogène (Azote), Oxygène, Fluor, Néon.
Mnémotechnique (exemple) :
« Lili Becha Bien Chez Notre Oncle Ferdinand Nestor »
Période 3
Sodium(Na), Magnésium, Aluminium, Silicium, Phosphore, Soufre, Chlore, Argon.
Napoléon, Mangea Allègrement Six Poulets Sans Claquer d' Argent
Période 4
(Voir Internet)
Rechercher « Mnémotechnique tableau périodique » sur Internet pour trouver de nombreux exemples.
Période 2
« Lili Becha Bien Chez Notre Oncle Ferdinand Nestor »
Période 3
Napoléon, Mangea Allègrement Six Poulets Sans Claquer d' Argent
Période 4
…Voir Internet.
Page 9.
Volume d’un atome

Sélectionner l’affirmation exacte :
1- Même période : Plus il ya d’électrons plus gros est l’atome
2- Même colonne : Plus le nombre quantique n croît, plus gros est l’atome 3- Un atome avec beaucoup d’électrons est toujours plus gros qu’un atome de nombre d’électron plus petit
4- L’hélium est le plus gros atome
L’affirmation 2 est exacte.
Affirmation 3
Non.
Idée fausse : Le volume d’un atome dépend de son
nombre d’électrons.
A n constant, la somme des attractions des protons prime sur le nombre d’électrons = contracte l’atome.
Affirmation 3 :
Non.
Un atome avec beaucoup d’orbitales et n important, peut être plus petit qu’un atome de nombre quantique n inférieur (les OA sont toutes centrées sur le noyau et ne se « rajoutent pas » mais se combines).
Affirmation 4 :
Non.
L’hélium est le plus petit atome.
Rayon atomique
Le rayon atomique (rayon de l’orbitale de valence) :
- S’accroît avec le nombre quantique n,
- Diminue avec la charge effective Z* du noyau
(Z*= Z –
constant d’écran des électrons)
La charge effective du noyau apparaît plus petite :
Zi* = Z - s
s = constante d'écran d’autant importante que le nombre d’électrons est important.
Notes :
- Figure : pm= pico mètre = 10-12 m
- L’énergie est à calculer pour chaque électron de l’atome
(indice i dans la formule).
Voir :
- chapitre Atome quantique,
- “Calcul de la charge effective. Règles de Slater” sur Wikipédia.
Evolutions sur une ligne
L’attraction du noyau sur les électrons augmente avec le nombre de protons.
Plus de protons = plus de charges = plus d’attraction = moins de volume.
Note :
Les évolutions volumiques présentées sont globalement vraies.
Il peut y avoir, dans le détail, des atomes voisins, qui ne respectent pas les tendances générales.
Evolutions sur une colonne
Une colonne correspond à des atomes avec la même configuration de valence.
Le nombre et l’énergie des orbitales des atomes d’une même colonne, et donc le volume de l’atome, s’accroît avec le nombre quantique n.
Page 10.
Électronégativité. Ionisation

Sélectionner l’affirmation exacte :
1- Electronégativité : capacité d’un atome à repousser des électrons d’un atome voisin
2- Energie d’ionisation : énergie produite lors de l’ionisation d’un atome
3- Métaux alcalins et alcalino-terreux : énergie d’ionisation très élevée
4- Le Fluor a la plus grande électronégativité. L’électronégativité des gaz rares est très faible.
L’affirmation 4 est exacte.
Affirmation 1
Non.
Electronégativité : capacité d’un atome à attirer des électrons d’atomes voisins.
= capacité à établir des liaisons avec d’autres atomes. L’électronégativité des gaz rares est très faible.
La différence d’électronégativité entre les 2 éléments détermine la nature de la liaison covalente obtenue.
Voir ci-dessous.
Affirmation 2
Non.
Energie de première ionisation : énergie à fournir à un atome isolé (gazeux) pour lui arracher son premier électron.
A(g) ------> A+(g) + e- = ion + électron libre
Notes :
- Après la première ionisation, il peut y avoir d’autres arrachements d’électrons, d’autres ionisations : deuxième ionisation, etc.
- Les énergies nécessaires pour ces ionisations ne sont pas liées à l’énergie de première ionisation. Elles dépendent des structures électroniques successives obtenues.
Exemple :
- première ionisation d’un métal alcalin : facile (bon réducteur),
- seconde ionisation, pour lui arracher 1 de ses 8 électrons externes = difficile.
Affirmation 3
Non.
Les métaux alcalins et les métaux alcalino-terreux sont très réactifs et perdent facilement 1 ou 2 électrons pour retrouver une configuration des gaz rares très stable (8 électrons sur l’OA externe).
Ils ont un potentiel de première ionisation le plus faible de leur période.
A la configuration stable, 8 électrons externes, l’énergie d’ionisation est très élevée.
Affirmation 4
Oui.
Le Fluor est le plus électronégatif du tableau.
(À la meilleure propension à attirer un électron)
Par contre, l’électronégativité des gaz rares est très faible
(N’attirent pas les électrons des éléments voisins, ayant déjà 8 électrons en couche externe)
Electronégativité
- Capacité d’un élément, à attirer des électrons d’un autre élément,
(Élément : atome ou molécule)
- La différence des électronégativités de deux
éléments détermine la nature de la liaison
chimique :
- Différence < 1,7 => Liaison covalente
- Différence > 1,7 => Liaison covalente dite « ionique »
(Les liaisons chimiques sont étudiées dans le chapitre molécules)
- L’échelle de Pauling est la plus utilisée pour calculer la différence d’électonégativité,
- Le Fluor est l’élément le plus électronégatif du tableau (4 sur l’échelle de Pauling).
Le Francium, en bas à gauche du tableau, a la plus petite électronégativité
(Si on fait exception des gaz rares qui sont très stables)
Energie d’ionisation
Energie à fournir à un atome, ou à une molécule, pour lui arracher un électron.
On définit des énergies de première ionisation, enlever le premier électron, de deuxième ionisation, etc.
Evolutions sur une ligne (période)
L’attraction du noyau sur les électrons augmente avec sont nombre de protons (plus de protons = plus d’attraction = plus d’énergie à fournir pour arracher un électron) : L’énergie d’ionisation augmente de gauche à droite sur une période (ligne),
L’électronégativité augmente de gauche à droite sur une période. L’atome cherchant à obtenir un, ou des, électrons pour compléter sa couche externe à 8 électrons.
Notes :
- Exception de la dernière colonne, les gaz rares, qui sont très stables Les évolutions présentées sont globalement vraies.
- Il peut y avoir, dans le détail, des atomes voisins, qui ne respectent pas les tendances générales.
Evolutions sur une colonne
Les
diagrammes d’énergies du chapitre précédent Polyélectrons montrent que le
nombre quantique n évolue avec le nombre d’électrons.
La constante d’écran est liée au nombre d’électrons.
- L’énergie d’ionisation augmente de bas en haut (lorsque n diminue = moins d’écran),
- L’électronégativité augmente également de bas en haut (lorsque n diminue =moins d’écran).
Mnémotechnique
Pour retenir l’ordre des éléments les plus électronégatifs :
font que le brome s’y cache (et inverser N et CI)
F - O – N - CI - Br – S - C - H
F - O – CI – N - Br – S - C - H
Page 11.
Masses & volumes molaires

Sélectionner les deux affirmations exactes :
1- Mole = masse molaire
2- Les nombres d’atomes d’une mole d’atomes de plomb et d’une mole d’atomes de carbone sont différents (Le plomb est plus lourd que le carbone)
3- Les masses atomiques du plomb et du carbone sont identiques
4- [A] : Masse de tétraméthylplomb dans un litre d’essence = nombre de moles par litre x masse molaire du tétraméthylplomb
5- Masse molaire de l’eau : 2x1 + 16 = 18g par mole
6- Aux CNTP, le volume molaire d’un gaz parfait = 24 litres par mole
Les affirmations 4 et 5 sont exactes.
Affirmation1
Non
Mole : quantité d’éléments = 602 000 000 000 000 000 000 000 éléments.
(1 mole d’atomes si les éléments considérés sont des atomes)
Masse molaire = masse d’une mole d’éléments.
Si on considère des atomes, la masse molaire dépend de la masse atomique des atomes ; Masse différente d’un atome à l’autre.
Affirmations 2
Non.
Une mole est une quantité.
Dans une mole il y a toujours le même nombre d’éléments :
602 000 000 000 000 000 000 000 éléments.
(Atomes
si on considère une mole d’atomes).
Les masses atomiques, et donc les molaires, des atomes de plomb et de carbone
sont différentes ; ce qui explique les différences de masses.
Affirmation 3
Non.
Masse (molaire) atomique du plomb : 207,2 u environ
Masse (molaire) atomique du carbone : 12, 01 u environ
u : unité de masse des atomes : 1, 66 10-27 kg environ
Affirmation 5
Oui.
Le tableau périodique donne la masse molaire des corps simples.
Exemples :
Hydrogène : 1g par mole,
Carbone : 12g par mole,
Oxygène : 16g par mole.
Masse molaire d’un corps composé = somme des masses molaires de
ses composants.
Exemple : H2O = 2x1 + 16 = 18g par mole
(18g.mol-1)
Affirmation 6
Non.
Volume molaire : volume occupé par une mole.
Pour les gaz parfaits Vm =Volume /n moles.
CNTP : Conditions normales de température et de pression.
- t=O°C (Ou 273,15 T absolue)
- P= 1013 hPa
CNTP, volume molaire d’un gaz parfait = 22,4 litres par mole
Pression atmosphérique, 20°C : 24 litres par mole.
(Pa/20°C : gaz moins compressé)
Rappel :
1 m3 = 1000L
CNTP, volume molaire d’un gaz parfait = 0,0224 m3. mol-1
Rappels :
1 Mole :
= quantité d’éléments identique au nombre d’atomes contenu dans 12 grammes de carbone 12
(12 : isotope 12)
= 6,02214040×1023 atomes
= Nombre d’Avogadro
(Symbole : NA)
Dans les formules de masse, cette constante est l’inverse d’une quantité de matière, d’où la notation mol-1.
u : unité de masse des atomes : 1, 66 10-27 kg environ
Masses
La masse atomique, masse d’une mole d’atomes, est exprimée en g.mol-1
(g.mol-1 : Grammes par mole)
La masse molaire d’une molécule est la somme des masses atomiques des atomes constituants la molécule.
(Ne pas oublier les coefficients stoechiométriques)
Page 12.
Révision. Exemple : Carbone

Sélectionner l’affirmation exacte :
1- [A] : 6 électrons de valence = groupe 6
2- [B] : Deuxième période, bloc d
3- [C] : Le carbone a une bonne électronégativité
4- [D] : 4 électrons de valence = 4 énergies d’ionisation possibles
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A] : 4 électrons de valence = groupe 4
Affirmation 2
Non.
[B] : Deuxième période, bloc p
Affirmation 3
Oui.
[C] : Oui, le carbone a une bonne électronégativité.
(Mais bien sûr moins que le fluor, revoir figure d’une page précédente)
Affirmation 4
Non.
[D] : 4 électrons de valence
Tous les électrons d’un atome peuvent être arrachés, si on y met de l’énergie !
= 6 énergies d’ionisation possibles