Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Répartition électronique
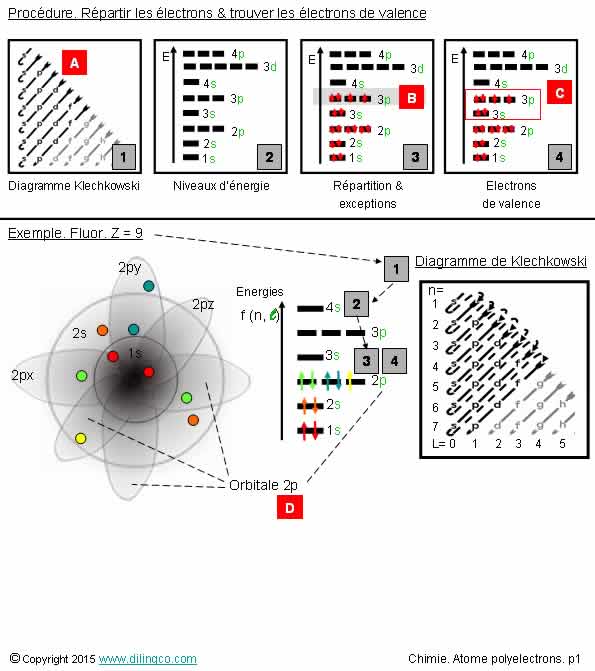
Sélectionner l’affirmation exacte :
1- [A] : Procédure : commencer par retrouver l’ordre des
orbitale avec le principe de Pauli
2- [B] : 1 paire d’électrons et 2 électrons célibataires =
Faux (Répartition correcte : 2 paires d’électrons)
3- [C] : 4 électrons de valence
4- [D] : orbitale 2p
L’affirmation 4 est exacte.
Affirmation 1
Non.
[A] : Procédure : commencer par retrouver l’ordre des
orbitale avec le diagramme de Klechkowski
Affirmation 2
Non.
[B] : La répartition est correcte.
Voir chapitre précédent règle de Hund.
Règle de Hund : Pour le remplissage du dernier niveau
d’énergie, répartir les électrons avec le maximum de spins parallèles, puis compléter les
cases quantiques de manière à obtenir des paires d’électrons (électrons de
spins opposés).
Affirmation 3
Non.
[C] : 6 électrons de valence
Les électrons de valence sont ceux :
- De la couche n la plus élevée, (ici n=3) et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Affirmation 4
Oui.
[D] : orbitale 2p
La réponse a cette question pouvait être trouvée en utilisant le
diagramme de Klechkowski : 1s, 2s, 2p, …
Ou en notant la forme d’altères p(x), p(y), p(z) dans
la représentation des orbitales de l’atome.
Procédure pour répartir les électrons et retrouver les électrons
de valence
Voir figure.
Ordre des orbitales
1- Commencer par retrouver l’ordre des orbitales en utilisant le
diagramme de Klechkowski
Il est impératif de savoir retrouver et utiliser le diagramme Klechkowski.
Diagramme des énergies
2- Utiliser l’ordre des orbitales pour tracer le diagramme des
énergies.
Le diagramme présenté est valide pour les atomes polyélectrons où
l’énergie est fonction des 2 premiers nombres quantiques.
Voir atomes hydrogénoïdes si un seul électron.
Répartition des électrons
3- appliquer le principe d’exclusion de Pauli,
Maximum 2 électrons par case quantique et les 2 électrons ont un
spin opposé,
et la règle de Hund : Pour le remplissage du dernier niveau
d’énergie, répartir les électrons avec le maximum de spins parallèles, puis compléter les
cases quantiques de manière à obtenir des paires d’électrons (électrons de
spins opposés).
Appliquer les exceptions : Inversion de couches 4s & 3d, métaux de transition chrome,
cuivre, …
Electrons de valence
4- Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Page 2.
Rappels. Klechkowski
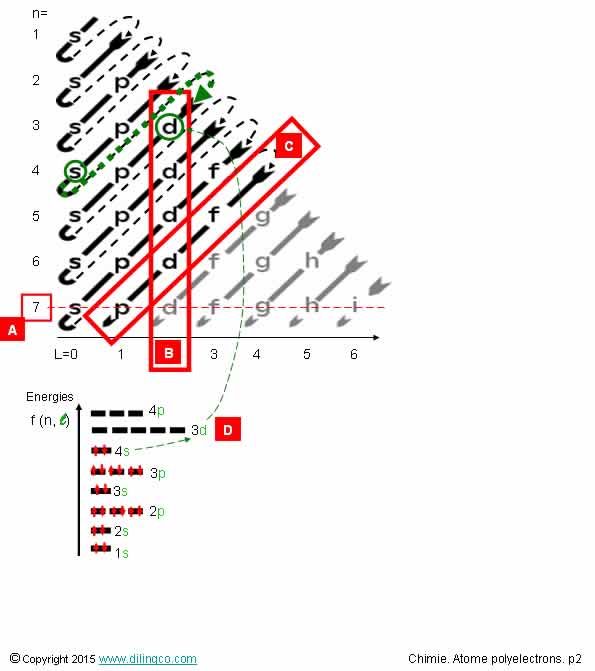
Sélectionner l’affirmation exacte :
1. [A] : n, nombre quantique principal, n = 1
2. [B] : L, nombre quantique secondaire, L = 3
3. [C] : Diagonale de même énergie
4. [D] : 3d
L’affirmation 4 est exacte.
Affirmation 1
Non.
Ordonner les n de bas en haut, dans le sens de progression de
l’énergie.
[A] : n=7
Revoir chapitre « Atome quantique Nombre quantique »
Affirmation 2
Non.
[B] : L, nombre quantique secondaire, L = 2
(Ordonner L en abscisses à partir de 0).
L nombre quantique secondaire (azimutal) :
- participe (n+L) à la définition de l’énergie,
- lié au type d’orbitale : L = 1 = orbitale p, L= 2 =
orbitale d, …
Affirmation 3
Non.
[C] : Diagonale de mêmes sommes n+L
Pour cette diagonale soulignée, n+L = 8
L’énergie sur cette diagonale progresse en même temps que n.
L’énergie des orbitales atomiques (OA), augmente lorsque n+l augmente.
Pour les valeurs de la somme (n+L) égales, l’énergie la plus basse
correspond à la valeur n la plus basse.
Page 3.
Rappels. Orbitales
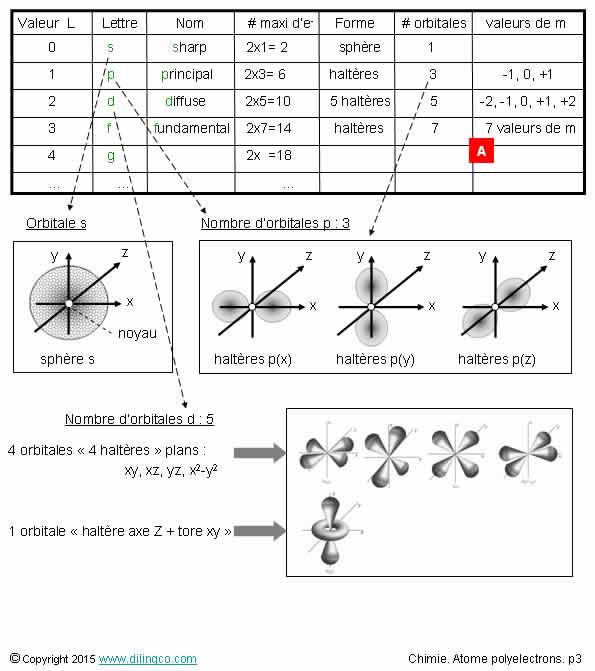
Sélectionner
l’affirmation exacte :
1- L= 0
n’est possible que si n=1 (il n’y a d’OA sphérique que si n=1)
2- Pas
d’électron avec les nombres quantiques n=2 et L=2
3- L=3
n’est possible que pour n=4
4-
[A] : L=3, 6 valeurs de m : 6 orbitales
L’affirmation
2 est exacte.
Affirmation
1
Non.
L=0 : orbitale s, sphérique.
Le nombre
quantique secondaire L est > 0 et inférieur à
n-1
Exemple :
n=5,
L=0,
L=1, L=2, L=3
La couche
5 à donc les OA : s, p, d, et f
(Notations correctes : 5s,
5p, 5d, 5f)
Affirmation
2
Oui.
L entier
< n-1
n=2, le
nombre quantique secondaire L peut avoir les valeurs : 0 et 1
Pas
d’électron avec n=2 et L=2
Conseil : pour répondre à ce genre de question, redessiner
le diagramme de
Klechkowski
Affirmation
3
Non.
Voir diagramme de Klechkowski
Affirmation
4
Non.
[A] :
L = 3 = orbitales f,
Voir figure [B] :
m= -3,
-2, -1, 0, +1, +2, +3,
7 valeurs
de m = 7 orbitales (ou 7
sous-couches)
Rappels :
OA : Orbitale atomique
Nombres
quantiques n & L
Le nombre
principal n :
n > 0,
entiers
Les
valeurs possibles du nombre quantique L découlent du nombre n :
L entiers
de 0 à <n-1
n=1 L=0
n=2
L=0, L=1
n=3 L=0, L=1,
L=2
n= … L=………
De même,
les valeurs possibles du nombre quantique m sont égales à –L et +L
Orbitales
L=0 --->
orbitale s (sharp), (1 orbitale ;
sphérique)
L=1
---> orbitales p (3 orbitales ;
haltères x,y, z)
L=2 ---> orbitales d (5 orbitales
--à nombre quantique m=-2, -1, 0,
+1, +2)
L=3 ---> orbitales f (7 orbitales
--à m=-3, -2, -1, 0, +1, +2, +3)
Nombre
maximal d’électrons
Le nombre d’électrons d’une couche n est limité à 2n2 électrons
Une couche est composée de sous-couche(s) appelées Orbitales.
Le nombre d’électrons par sous-couches est limité à 2 par
sous-couche :
Couches S, Saturation : 2
électrons, (1 seule orbitale possible)
Couches p, Saturation : 6 électrons, (3 orbitales x,y,z)
Couches d, Saturation : 10 électrons, (5 orbitales)
Couches f, Saturation : 14 électrons, (7 orbitales)
Energies.
Cas général
Energies => n+ l
Pour les autres atomes, l’énergie dépend des nombres quantiques
n et l.
Règle de Klechkovski :
[A] :
Lorsque la somme n+l est identique pour deux OA, l’OA
de plus basse énergie est celle de n le plus petit.
Nomenclature.
Rappels
La
nomenclature des orbitales « n l » est :
- Premier chiffre : nombre
quantique n,
- Deuxième lettre : associée à la valeur du nombre quantique l :
l=0 --à lettre associée s (sharp),
Une orbitale s par
nombre quantique n
l=1 --à lettre associée p (principal),
Trois orbitales p par
nombre quantique n
(3
valeurs de m possibles : -1, 0, +1)
l=2 --à lettre associée d (diffuse),
Cinq orbitales d
par nombre quantique n
(5
valeurs de m possibles : -2, -1, 0, +1, +2)
l=3 --à lettre associée f (fundamental),
Sept orbitales f par
nombre quantique n
(7
valeurs de m possibles)
Page 4.
Règle de Hund. Electrons
de valence
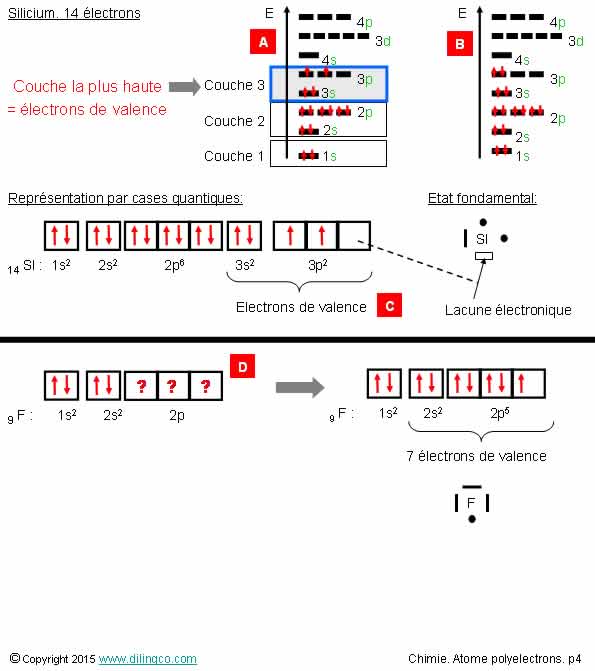
Sélectionner l’affirmation exacte :
1- [A] : Configuration de plus grande stabilité électronique que
la configuration [B]
2- Silicium : la couche 3p est la couche de valence. 2 électrons de
valence
3- [C] : 4 électrons de cœur
4- [D] : Fluor 9F => 5 électrons 2p => 5 électrons
de valence
L’affirmation 1 est exacte.
Affirmation 1
Oui.
La configuration de plus grande stabilité, [A], respecte la règle
de Hund.
La règle de Hund demande à répartir les électrons sur le plus grand
nombre d’orbitales dégénérées, et de mettre un même spin, pour obtenir l’état
fondamental de plus grande stabilité.
Note :
Très souvent le rectangle de l’orbitale dégénérée n’est pas indiqué dans la
représentation de Lewis.
Affirmation 2
Non.
Silicium : la couche n=3, n le plus élevée, est la couche de
valence.
Silicium : 4 électrons de valence.
(La représentation de Lewis est très explicite)
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Affirmation 3
Non.
[C] : n=3 couche la plus élevée. 4 électrons de valence.
Affirmation 4
Non.
[D] : n le plus élevé = 2
7 électrons de valence : 2 électrons 2s et 5 électrons 2p
Lacune électronique
[C] : Il y a lacune électronique si une des orbitales
dégénérées est sans électron.
Il est recommandé de représenter une lacune par un rectangle vide dans la
représentation de Lewis.
Page 5.
Ions
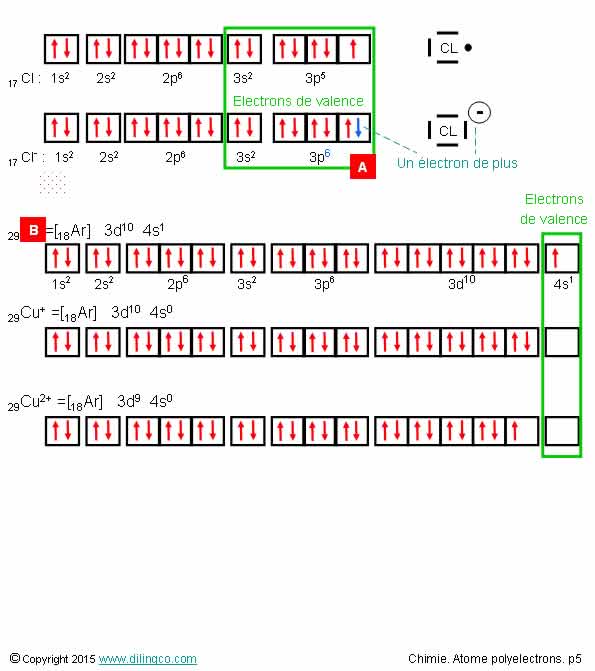
Sélectionner
les deux affirmations exactes :
1- Un
cation a plus d’électron(s) que l’atome correspondant
2- La
perte d’un électron modifie le numéro atomique Z
3-
[A] : Z=17. Plus un électron : anion chlorure
4- [B] : Cation de cuivre
5-
[B] : Représentation correcte de l’atome de cuivre (Non seulement Il faut
inverser 4s et 3d, mais aussi un électron passe dans la couche 3d)
Les affirmations 3 et 5 sont exactes.
Affirmation
1
Non.
Un cation est attiré par une cathode : il
a donc une charge globale positive. Charge
positive : moins d’électrons que de protons
Affirmation 2
Non.
Le
numéro atomique est lié au nombre de protons de l’atome.
Le nombre de protons (et donc Z), ne change pas par perte ou gain d’électron(s)
Affirmation
3
Oui.
[A] :
Z=17.
Anion :
- ion qui, ayant gagné un ou plusieurs électron(s),
- porte une ou plusieurs charge(s) électrique(s).
Affirmation
4
Non.
[B] :
atome (non chargé) de cuivre.
Z = 29 = 18 + 10 + 1 = le nombre d’électrons = nombre de
proton
Le cuivre est un métal de transition qui est une exception de stabilité.
Affirmation
5
Oui
[B]. Voir
exception de stabilité
Rappels :
Ions :
Anions, Cations, Zwitterions.
Les ions
peuvent être :
- Monoatomiques (un seul atome),
- Polyatomiques.
Anion
Un anion est un ion chargé négativement par excès d’électron(s) par rapport à l’atome
Mnémotechnique : anion => ajout d’électron(s)
Exemple : Cl-
Lors
d’une électrolyse, les anions sont attirés par l’anode, électrode
positive (électrode + : attire les ions -).
Cation
Un cation
est un ion chargé positivement par perte d’électron(s) par rapport à l’atome
Exemple : Na+
Lors
d’une électrolyse, les cations sont attirés par la cathode, électrode
négative.
Zwitterions
Ions
possédant des charges positives et négatives.
Exemple :
Acides aminés.
Configuration
électronique
1- Commencer par définir la configuration de l’atome,
2- Ajouter (Anions), ou retirer (cation), un ou plusieurs électron(s) en respectant
les règles de remplissage
Page 6.
OA Chlore
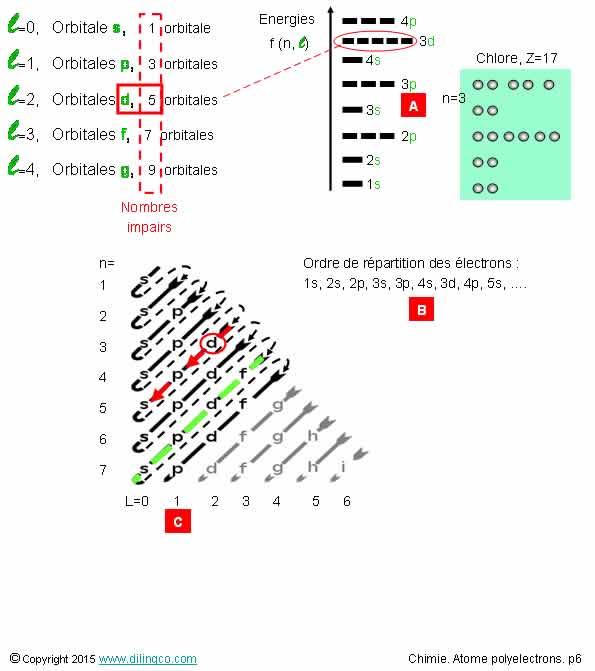
Sélectionner
l’affirmation exacte :
1-
[A] : Atome de chlore : 17 électrons de valence
2- [B] :
après 4s, il y a 3d. d=>5 sous-couches
3- [C] :
7p => nombre quantique secondaire L=7
4- Les
orbitales s ne sont présentes que si n = 1
L’affirmation
2 est exacte.
Affirmation
1
Non.
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Chlore :
n le plus élevé = 3
Orbitales
concernée par les électrons de valence : 3s et 3d.
Affirmation
2
Oui.
[B] :
après 4s, il y a 3d. d=>5 sous-couches
Revoir le chapitre Atome quantique
Affirmation
3
Non.
[B] :
7p : nombre quantique n=7, nombre quantique l
= 1
Page 7.
Bohr. Electrons de
valence
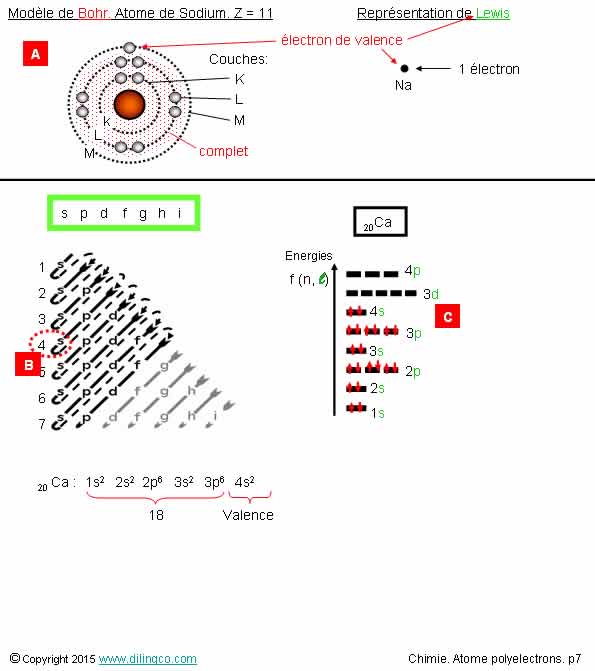
Sélectionner l’affirmation exacte :
1- [A] : Le modèle de Bohr ne peut pas être utilisé pour
trouver les électrons de valence
2- [B] : Les électrons de l’orbitale 4s ont une énergie
supérieure aux électrons de l’orbitale 4p
3- [C] : 2 électrons de valence
4- Le modèle de Bohr aurait pu être utilisé pour déterminer les
électrons de valence
L’affirmation 3 est exacte.
Affirmation 1
Si.
Le modèle de Bohr peut être utilisé pour trouver les
électrons de valence des atomes de nombre atomique Z inférieur à 19 (Trois premières
périodes du tableau périodique des éléments.
[A] : modèle de Bohr. Couches 2 & 3 : placer d’abord
un électron à midi, 3h, 6h, 9h, et continuer si nécessaire pour faire des
paires d’électrons
Affirmation 2
Non.
4 s est moins énergétique que 4p : Voir diagramme d’énergies
de la figure.
Affirmation 4
Non.
Le modèle de Bohr ne peut pas être utilisé pour les atomes de
Z>18.
Calcium : Z=20
Page 8.
Hybridations sp
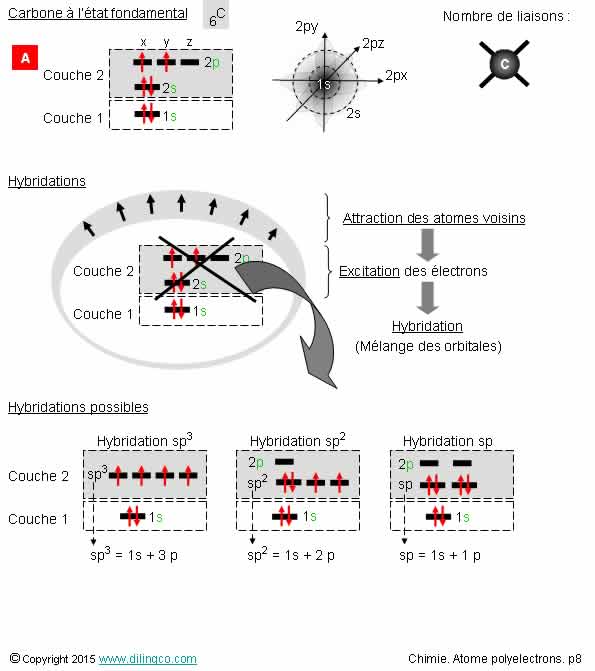
Sélectionner
l’affirmation exacte :
1-
[A] : 2 orbitales hybridées = Hybridation sp2
2-
L’hybridation diminue le nombre d’électrons d’un atome
3- Hybridation
sp3 : Combinaison d’une orbitale s avec 3 orbitales p. Résultat = 4 orbitales
hybrides sp3
4- Le niveau
d’énergie 2 du modèle quantique peut avoir plus de 4 orbitales
L’affirmation
3 est exacte.
Affirmation
1
Non.
[A] :
2 orbitales hybridées sp :
Hybridation sp
(sp= 1s +
1p = 2 orbitales hybridées sp)
Affirmation
2
Non.
L’hybridation
sp modifie les positions et les formes des orbitales d’un atome. Les
orbitales, zones de présences probables des électrons, sont modifiées, mais pas
le nombre d’électrons.
Les
orbitales hybrides permettent d’expliquer la forme des orbitales moléculaires
et des géométries moléculaires.
OA :
orbitales
atomiques
Orbitales
hybridées
L’hybridation consiste à combiner les orbitales atomiques d’une même couche, pour obtenir
des orbitales sp plus conformes à la réalité des atomes.
Types d’OA hybridées
Trois types d’hybridations : sp3, sp2, sp
Hybridation
sp3 :
-
Combinaison d’une orbitale s et de 3 orbitales
p (d’où l’exposant 3).
- Résultat : quatre orbitales sp situées sur un même niveau d’énergie.
-
Géométrie : tétraédrique.
- Angles
entre OA sp3 : 109,5°
Hybridation
sp2 :
-
Combinaison d’une orbitale s et de 2 orbitales p.
-
Résultat : trois orbitales sp et une OA p non hybridée,
Les
orbitales sp et p sont situées sur un même niveau d’énergie.
-
Géométrie : trigonale.
- Angles
entre OA sp2 : 120°
Hybridation
sp :
-
Combinaison d’une orbitale s et d’une orbitale p.
-
Résultat : deux orbitales sp et deux OA p
non hybridées situées sur un même niveau d’énergie.
-
Géométrie : linéaire.
- Angles
entre OA sp : 180°
Page 9.
Exemples d’hybridations sp
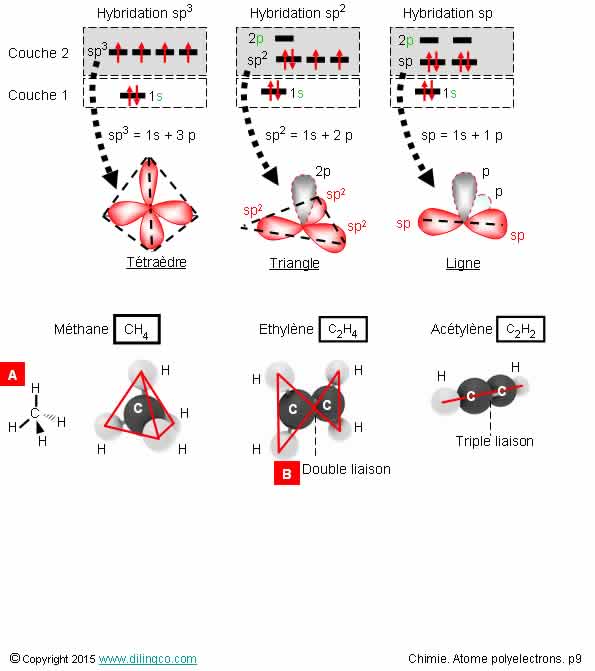
Sélectionner
les deux affirmations exactes :
1- Un atome
de carbone excité est toujours hybridé sp3
2-
[A] : Représentation de Lewis du méthane
3- Hybridation
sp3 : combinaison d’une orbitale s avec 3 orbitales p pour donner 4
orbitales sp3
4- Atome
de carbone : Le nombre d’électrons de valence dépend de la molécule ;
Ne respecte pas toujours la règle de l’octet.
5- Les
liaisons covalentes d’orbitales hybrides ne sont pas toujours axiales
Les
affirmations 3 et 5 sont exactes.
Affirmation
2
Non.
Représentation de CRAM d’une molécule de méthane.
La représentation
CRAM permet de représenter la géométrie spatiale d’une molécule.
Hybridation sp3, géométrie tétraédrique.
Pointillés : atome H vers l’arrière.
Triangle gras : atome H vers l’avant.
Affirmation
4
Non.
Atome de
carbone : Respect strict de la règle de l’octet.
(Couche
de valence saturée à 8 électrons)
Affirmation
5
Oui.
Liaisons
covalentes d’orbitales hybrides σ (sigma) : recouvrement axial.
Liaisons
covalentes d’orbitales hybrides π. (pi) : recouvrement latéral.
Liaisons covalentes σ:
- recouvrement axial,
- une seule liaison axiale par atomes reliés
- plus fortes que les liaisons pi
(Le
recouvrement axial est plus fort que le recouvrement latéral).
Page 10.
Orbitales moléculaires
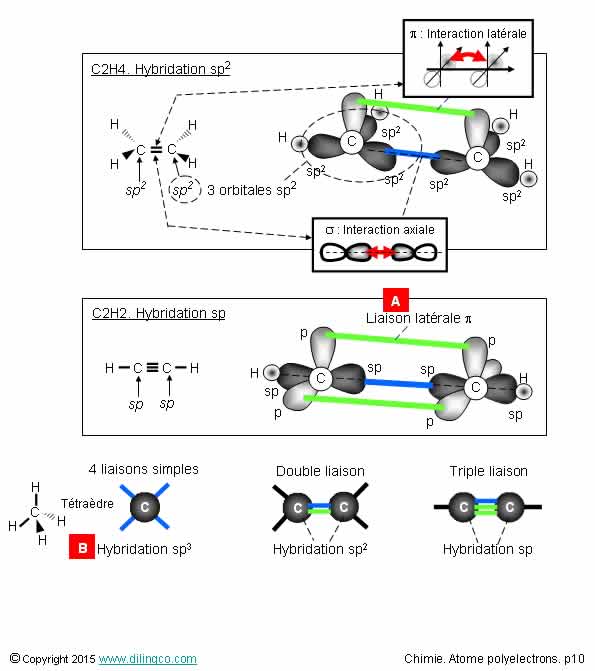
2 atomes qui se rapprochent pour former une
molécule, …
Sélectionner les deux
affirmations exactes :
1- La méthode de combinaison linéaire d’orbitales atomiques
(CLOA) permet d’obtenir le diagramme des orbitales d’une molécule
2- Les orbitales 1s et 2s forment des orbitales pi de
recouvrement latéral
3- Les orbitales moléculaires 2p sont toujours des orbitales
pi
4- [A] : 2 liaisons axiales sigma
5- Les orbitales se recouvrent toujours pour former des
orbitales moléculaires
6- Les orbitales combinées obtenues sont toujours liantes
7- Indice de liaison = (Nb d’électrons dans les OM liantes
– Nb d’électrons dans les OM antiliantes) / 2
Les affirmations 1 et 7 sont exactes.
Affirmation 1
Oui.
CLOA : Combinaison linéaire d’orbitales atomiques.
OA : Orbitale atomique.
OM : Orbitale moléculaire.
Pour obtenir le diagramme des orbitales d’une
molécule :
1- déterminer le nombre d’électrons de chaque atome,
2- placer les électrons sur les axes d’énergies des
orbitales atomiques des atomes respectif, figure (1)
& (2),
3- combiner les OA par niveau pour obtenir les orbitales
moléculaires.
Tenir compte de :
- pas de recouvrement d’OA si les différences
d’énergies > 14eV (*)
- chaque couche donne une OM liante et une OA antiliante,
- répartir les électrons sur le diagramme des
orbitales en respectant les diverses règles (Règle de KlechKowski, exclusion de
Pauli, règle de Hund, …)
Note :
(*) La figure présente le cas de molécules homonucléaires où l’aspect
différence énergétique n’a pas lieu d’être, les atomes étant identiques et
leurs OA avec des énergies identiques.
Affirmation 2
Non.
Les orbitales 1s et 2s forment des orbitales sigma de
recouvrement axial.
Affirmation 3
Non.
Les orbitales moléculaires 2p sont des orbitales :
- de recouvrement latéral, orbitales pi x et pi y,
- de recouvrement axial, orbitale sigma z.
Affirmation 4
Non.
[A] : 1 liaison axiale sigma 2pz, une liaison
latérale pi 2px.
Rappel (Voir page précédente) :
Maximum 1 liaison axiale entre 2 atomes.
Affirmation 5
Non.
Les orbitales ne se combinent que s’il y a moins de 14 eV entre les OA
concernées.
Molécules homonucléaires (mêmes atomes) : énergies
des orbitales identiques, les orbitales se combinent.
Note :
C’est le cas du diagramme des orbitales moléculaires et
des exemples présentés.
Molécules hétéronucléaires (exemple : HCl) :
- Faire des diagrammes
atomiques avec des échelles d’énergies exactes.
- Tenir compte des différences d’énergies, >14 eV, pour
combiner ou non les orbitales.
Note :
Voir les très nombreux
exemples de diagrammes sur Internet.
Affirmation 6
Non.
Les orbitales se combinent entre elles pour former :
- 1 OM liante
et
- 1 OM antiliante.
Si les deux types d’OM sont remplis par un doublet
d’électrons, les OM s’opposent et il n’y a pas d’orbitale moléculaire hybridée résultante.
Affirmation 7
Oui.
Indice de liaison = (Nb d’électrons dans les OM liantes –
Nb d’électrons dans les OM antiliantes) / 2
Indice de liaison positif, plus
d’électrons dans les OM liantes : liaison entre atomes stable.
Indice négatif : liaison atomique instable.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Répartition électronique

Sélectionner l’affirmation exacte :
1- [A] : Procédure : commencer par retrouver l’ordre des orbitale avec le principe de Pauli
2- [B] : 1 paire d’électrons et 2 électrons célibataires = Faux (Répartition correcte : 2 paires d’électrons)
3- [C] : 4 électrons de valence
4- [D] : orbitale 2p
L’affirmation 4 est exacte.
Affirmation 1
Non.
[A] : Procédure : commencer par retrouver l’ordre des orbitale avec le diagramme de Klechkowski
Affirmation 2
Non.
[B] : La répartition est correcte.
Voir chapitre précédent règle de Hund.
Règle de Hund : Pour le remplissage du dernier niveau d’énergie, répartir les électrons avec le maximum de spins parallèles, puis compléter les cases quantiques de manière à obtenir des paires d’électrons (électrons de spins opposés).
Affirmation 3
Non.
[C] : 6 électrons de valence
Les électrons de valence sont ceux :
- De la couche n la plus élevée, (ici n=3) et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Affirmation 4
Oui.
[D] : orbitale 2p
La réponse a cette question pouvait être trouvée en utilisant le diagramme de Klechkowski : 1s, 2s, 2p, …
Ou en notant la forme d’altères p(x), p(y), p(z) dans la représentation des orbitales de l’atome.
Procédure pour répartir les électrons et retrouver les électrons de valence
Voir figure.
Ordre des orbitales
1- Commencer par retrouver l’ordre des orbitales en utilisant le diagramme de Klechkowski
Il est impératif de savoir retrouver et utiliser le diagramme Klechkowski.
Diagramme des énergies
2- Utiliser l’ordre des orbitales pour tracer le diagramme des énergies.
Le diagramme présenté est valide pour les atomes polyélectrons où l’énergie est fonction des 2 premiers nombres quantiques.
Voir atomes hydrogénoïdes si un seul électron.
Répartition des électrons
3- appliquer le principe d’exclusion de Pauli,
Maximum 2 électrons par case quantique et les 2 électrons ont un spin opposé,
et la règle de Hund : Pour le remplissage du dernier niveau d’énergie, répartir les électrons avec le maximum de spins parallèles, puis compléter les cases quantiques de manière à obtenir des paires d’électrons (électrons de spins opposés).
Appliquer les exceptions : Inversion de couches 4s & 3d, métaux de transition chrome, cuivre, …
Electrons de valence
4- Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Page 2.
Rappels. Klechkowski

Sélectionner l’affirmation exacte :
1. [A] : n, nombre quantique principal, n = 1
2. [B] : L, nombre quantique secondaire, L = 3
3. [C] : Diagonale de même énergie
4. [D] : 3d
L’affirmation 4 est exacte.
Affirmation 1
Non.
Ordonner les n de bas en haut, dans le sens de progression de l’énergie.
[A] : n=7
Revoir chapitre « Atome quantique Nombre quantique »
Affirmation 2
Non.
[B] : L, nombre quantique secondaire, L = 2
(Ordonner L en abscisses à partir de 0).
L nombre quantique secondaire (azimutal) :
- participe (n+L) à la définition de l’énergie,
- lié au type d’orbitale : L = 1 = orbitale p, L= 2 = orbitale d, …
Affirmation 3
Non.
[C] : Diagonale de mêmes sommes n+L
Pour cette diagonale soulignée, n+L = 8
L’énergie sur cette diagonale progresse en même temps que n.
L’énergie des orbitales atomiques (OA), augmente lorsque n+l augmente.
Pour les valeurs de la somme (n+L) égales, l’énergie la plus basse correspond à la valeur n la plus basse.
Page 3.
Rappels. Orbitales

Sélectionner l’affirmation exacte :
1- L= 0 n’est possible que si n=1 (il n’y a d’OA sphérique que si n=1)
2- Pas d’électron avec les nombres quantiques n=2 et L=2
3- L=3 n’est possible que pour n=4
4- [A] : L=3, 6 valeurs de m : 6 orbitales
L’affirmation 2 est exacte.
Affirmation 1
Non.
L=0 : orbitale s, sphérique.
Le nombre quantique secondaire L est > 0 et inférieur à n-1
Exemple : n=5,
L=0, L=1, L=2, L=3
La couche
5 à donc les OA : s, p, d, et f
(Notations correctes : 5s,
5p, 5d, 5f)
Affirmation 2
Oui.
L entier < n-1
n=2, le nombre quantique secondaire L peut avoir les valeurs : 0 et 1
Pas d’électron avec n=2 et L=2
Conseil : pour répondre à ce genre de question, redessiner le diagramme de Klechkowski
Affirmation 3
Non.
Voir diagramme de Klechkowski
Affirmation 4
Non.
[A] :
L = 3 = orbitales f,
Voir figure [B] :
m= -3, -2, -1, 0, +1, +2, +3,
7 valeurs de m = 7 orbitales (ou 7 sous-couches)
Rappels :
OA : Orbitale atomique
Nombres
quantiques n & L
Le nombre
principal n :
n > 0, entiers
Les valeurs possibles du nombre quantique L découlent du nombre n :
L entiers
de 0 à <n-1
n=1 L=0
n=2
L=0, L=1
n=3 L=0, L=1,
L=2
n= … L=………
De même, les valeurs possibles du nombre quantique m sont égales à –L et +L
Orbitales
L=0 --->
orbitale s (sharp), (1 orbitale ;
sphérique)
L=1
---> orbitales p (3 orbitales ;
haltères x,y, z)
L=2 ---> orbitales d (5 orbitales
--à nombre quantique m=-2, -1, 0,
+1, +2)
L=3 ---> orbitales f (7 orbitales
--à m=-3, -2, -1, 0, +1, +2, +3)
Nombre maximal d’électrons
Le nombre d’électrons d’une couche n est limité à 2n2 électrons
Une couche est composée de sous-couche(s) appelées Orbitales.
Le nombre d’électrons par sous-couches est limité à 2 par sous-couche :
Couches S, Saturation : 2
électrons, (1 seule orbitale possible)
Couches p, Saturation : 6 électrons, (3 orbitales x,y,z)
Couches d, Saturation : 10 électrons, (5 orbitales)
Couches f, Saturation : 14 électrons, (7 orbitales)
Energies.
Cas général
Energies => n+ l
Pour les autres atomes, l’énergie dépend des nombres quantiques n et l.
Règle de Klechkovski :
[A] : Lorsque la somme n+l est identique pour deux OA, l’OA de plus basse énergie est celle de n le plus petit.
Nomenclature. Rappels
La nomenclature des orbitales « n l » est :
- Premier chiffre : nombre
quantique n,
- Deuxième lettre : associée à la valeur du nombre quantique l :
l=0 --à lettre associée s (sharp),
Une orbitale s par nombre quantique n
l=1 --à lettre associée p (principal),
Trois orbitales p par nombre quantique n
(3
valeurs de m possibles : -1, 0, +1)
l=2 --à lettre associée d (diffuse),
Cinq orbitales d par nombre quantique n
(5
valeurs de m possibles : -2, -1, 0, +1, +2)
l=3 --à lettre associée f (fundamental),
Sept orbitales f par nombre quantique n
(7 valeurs de m possibles)
Page 4.
Règle de Hund. Electrons de valence

Sélectionner l’affirmation exacte :
1- [A] : Configuration de plus grande stabilité électronique que
la configuration [B]
2- Silicium : la couche 3p est la couche de valence. 2 électrons de
valence
3- [C] : 4 électrons de cœur
4- [D] : Fluor 9F => 5 électrons 2p => 5 électrons de valence
L’affirmation 1 est exacte.
Affirmation 1
Oui.
La configuration de plus grande stabilité, [A], respecte la règle de Hund.
La règle de Hund demande à répartir les électrons sur le plus grand nombre d’orbitales dégénérées, et de mettre un même spin, pour obtenir l’état fondamental de plus grande stabilité.
Note :
Très souvent le rectangle de l’orbitale dégénérée n’est pas indiqué dans la représentation de Lewis.
Affirmation 2
Non.
Silicium : la couche n=3, n le plus élevée, est la couche de
valence.
Silicium : 4 électrons de valence.
(La représentation de Lewis est très explicite)
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Affirmation 3
Non.
[C] : n=3 couche la plus élevée. 4 électrons de valence.
Affirmation 4
Non.
[D] : n le plus élevé = 2
7 électrons de valence : 2 électrons 2s et 5 électrons 2p
Lacune électronique
[C] : Il y a lacune électronique si une des orbitales
dégénérées est sans électron.
Il est recommandé de représenter une lacune par un rectangle vide dans la
représentation de Lewis.
Page 5.
Ions

Sélectionner les deux affirmations exactes :
1- Un cation a plus d’électron(s) que l’atome correspondant
2- La perte d’un électron modifie le numéro atomique Z
3-
[A] : Z=17. Plus un électron : anion chlorure
4- [B] : Cation de cuivre
5- [B] : Représentation correcte de l’atome de cuivre (Non seulement Il faut inverser 4s et 3d, mais aussi un électron passe dans la couche 3d)
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
Un cation est attiré par une cathode : il a donc une charge globale positive. Charge positive : moins d’électrons que de protons
Affirmation 2
Non.
Le
numéro atomique est lié au nombre de protons de l’atome.
Le nombre de protons (et donc Z), ne change pas par perte ou gain d’électron(s)
Affirmation 3
Oui.
[A] : Z=17.
Anion :
- ion qui, ayant gagné un ou plusieurs électron(s),
- porte une ou plusieurs charge(s) électrique(s).
Affirmation 4
Non.
[B] : atome (non chargé) de cuivre.
Z = 29 = 18 + 10 + 1 = le nombre d’électrons = nombre de proton
Le cuivre est un métal de transition qui est une exception de stabilité.
Affirmation 5
Oui
[B]. Voir exception de stabilité
Rappels :
Ions : Anions, Cations, Zwitterions.
Les ions peuvent être :
- Monoatomiques (un seul atome),
- Polyatomiques.
Anion
Un anion est un ion chargé négativement par excès d’électron(s) par rapport à l’atome
Mnémotechnique : anion => ajout d’électron(s)
Exemple : Cl-
Lors d’une électrolyse, les anions sont attirés par l’anode, électrode positive (électrode + : attire les ions -).
Cation
Un cation
est un ion chargé positivement par perte d’électron(s) par rapport à l’atome
Exemple : Na+
Lors d’une électrolyse, les cations sont attirés par la cathode, électrode négative.
Zwitterions
Ions possédant des charges positives et négatives.
Exemple : Acides aminés.
Configuration électronique
1- Commencer par définir la configuration de l’atome,
2- Ajouter (Anions), ou retirer (cation), un ou plusieurs électron(s) en respectant
les règles de remplissage
Page 6.
OA Chlore

Sélectionner l’affirmation exacte :
1- [A] : Atome de chlore : 17 électrons de valence
2- [B] : après 4s, il y a 3d. d=>5 sous-couches
3- [C] : 7p => nombre quantique secondaire L=7
4- Les orbitales s ne sont présentes que si n = 1
L’affirmation 2 est exacte.
Affirmation 1
Non.
Les électrons de valence sont ceux :
- De la couche n la plus élevée, et ceux,
- Des orbitales de plus faibles énergies incomplètes.
Les électrons de valence sont les moins liés au noyau.
Chlore : n le plus élevé = 3
Orbitales concernée par les électrons de valence : 3s et 3d.
Affirmation 2
Oui.
[B] : après 4s, il y a 3d. d=>5 sous-couches
Revoir le chapitre Atome quantique
Affirmation 3
Non.
[B] : 7p : nombre quantique n=7, nombre quantique l = 1
Page 7.
Bohr. Electrons de valence

Sélectionner l’affirmation exacte :
1- [A] : Le modèle de Bohr ne peut pas être utilisé pour trouver les électrons de valence
2- [B] : Les électrons de l’orbitale 4s ont une énergie supérieure aux électrons de l’orbitale 4p
3- [C] : 2 électrons de valence
4- Le modèle de Bohr aurait pu être utilisé pour déterminer les électrons de valence
L’affirmation 3 est exacte.
Affirmation 1
Si.
Le modèle de Bohr peut être utilisé pour trouver les électrons de valence des atomes de nombre atomique Z inférieur à 19 (Trois premières périodes du tableau périodique des éléments.
[A] : modèle de Bohr. Couches 2 & 3 : placer d’abord un électron à midi, 3h, 6h, 9h, et continuer si nécessaire pour faire des paires d’électrons
Affirmation 2
Non.
4 s est moins énergétique que 4p : Voir diagramme d’énergies de la figure.
Affirmation 4
Non.
Le modèle de Bohr ne peut pas être utilisé pour les atomes de Z>18.
Calcium : Z=20
Page 8.
Hybridations sp

Sélectionner l’affirmation exacte :
1- [A] : 2 orbitales hybridées = Hybridation sp2
2- L’hybridation diminue le nombre d’électrons d’un atome
3- Hybridation sp3 : Combinaison d’une orbitale s avec 3 orbitales p. Résultat = 4 orbitales hybrides sp3
4- Le niveau d’énergie 2 du modèle quantique peut avoir plus de 4 orbitales
L’affirmation 3 est exacte.
Affirmation 1
Non.
[A] : 2 orbitales hybridées sp : Hybridation sp
(sp= 1s + 1p = 2 orbitales hybridées sp)
Affirmation 2
Non.
L’hybridation sp modifie les positions et les formes des orbitales d’un atome. Les orbitales, zones de présences probables des électrons, sont modifiées, mais pas le nombre d’électrons.
Les orbitales hybrides permettent d’expliquer la forme des orbitales moléculaires et des géométries moléculaires.
OA : orbitales atomiques
Orbitales hybridées
L’hybridation consiste à combiner les orbitales atomiques d’une même couche, pour obtenir des orbitales sp plus conformes à la réalité des atomes.
Types d’OA hybridées
Trois types d’hybridations : sp3, sp2, sp
Hybridation sp3 :
-
Combinaison d’une orbitale s et de 3 orbitales
p (d’où l’exposant 3).
- Résultat : quatre orbitales sp situées sur un même niveau d’énergie.
- Géométrie : tétraédrique.
- Angles entre OA sp3 : 109,5°
Hybridation sp2 :
- Combinaison d’une orbitale s et de 2 orbitales p.
- Résultat : trois orbitales sp et une OA p non hybridée,
Les orbitales sp et p sont situées sur un même niveau d’énergie.
- Géométrie : trigonale.
- Angles entre OA sp2 : 120°
Hybridation sp :
- Combinaison d’une orbitale s et d’une orbitale p.
- Résultat : deux orbitales sp et deux OA p non hybridées situées sur un même niveau d’énergie.
- Géométrie : linéaire.
- Angles entre OA sp : 180°
Page 9.
Exemples d’hybridations sp

Sélectionner les deux affirmations exactes :
1- Un atome de carbone excité est toujours hybridé sp3
2- [A] : Représentation de Lewis du méthane
3- Hybridation sp3 : combinaison d’une orbitale s avec 3 orbitales p pour donner 4 orbitales sp3
4- Atome de carbone : Le nombre d’électrons de valence dépend de la molécule ; Ne respecte pas toujours la règle de l’octet.
5- Les liaisons covalentes d’orbitales hybrides ne sont pas toujours axiales
Les affirmations 3 et 5 sont exactes.
Affirmation 2
Non.
Représentation de CRAM d’une molécule de méthane.
La représentation
CRAM permet de représenter la géométrie spatiale d’une molécule.
Hybridation sp3, géométrie tétraédrique.
Pointillés : atome H vers l’arrière.
Triangle gras : atome H vers l’avant.
Affirmation 4
Non.
Atome de carbone : Respect strict de la règle de l’octet.
(Couche de valence saturée à 8 électrons)
Affirmation 5
Oui.
Liaisons covalentes d’orbitales hybrides σ (sigma) : recouvrement axial.
Liaisons covalentes d’orbitales hybrides π. (pi) : recouvrement latéral.
Liaisons covalentes σ:
- recouvrement axial,
- une seule liaison axiale par atomes reliés
- plus fortes que les liaisons pi
(Le recouvrement axial est plus fort que le recouvrement latéral).
Page 10.
Orbitales moléculaires

2 atomes qui se rapprochent pour former une molécule, …
Sélectionner les deux affirmations exactes :
1- La méthode de combinaison linéaire d’orbitales atomiques (CLOA) permet d’obtenir le diagramme des orbitales d’une molécule
2- Les orbitales 1s et 2s forment des orbitales pi de recouvrement latéral
3- Les orbitales moléculaires 2p sont toujours des orbitales pi
4- [A] : 2 liaisons axiales sigma
5- Les orbitales se recouvrent toujours pour former des orbitales moléculaires
6- Les orbitales combinées obtenues sont toujours liantes
7- Indice de liaison = (Nb d’électrons dans les OM liantes – Nb d’électrons dans les OM antiliantes) / 2
Les affirmations 1 et 7 sont exactes.
Affirmation 1
Oui.
CLOA : Combinaison linéaire d’orbitales atomiques.
OA : Orbitale atomique.
OM : Orbitale moléculaire.
Pour obtenir le diagramme des orbitales d’une molécule :
1- déterminer le nombre d’électrons de chaque atome,
2- placer les électrons sur les axes d’énergies des orbitales atomiques des atomes respectif, figure (1) & (2),
3- combiner les OA par niveau pour obtenir les orbitales moléculaires.
Tenir compte de :
- pas de recouvrement d’OA si les différences d’énergies > 14eV (*)
- chaque couche donne une OM liante et une OA antiliante,
- répartir les électrons sur le diagramme des orbitales en respectant les diverses règles (Règle de KlechKowski, exclusion de Pauli, règle de Hund, …)
Note :
(*) La figure présente le cas de molécules homonucléaires où l’aspect différence énergétique n’a pas lieu d’être, les atomes étant identiques et leurs OA avec des énergies identiques.
Affirmation 2
Non.
Les orbitales 1s et 2s forment des orbitales sigma de recouvrement axial.
Affirmation 3
Non.
Les orbitales moléculaires 2p sont des orbitales :
- de recouvrement latéral, orbitales pi x et pi y,
- de recouvrement axial, orbitale sigma z.
Affirmation 4
Non.
[A] : 1 liaison axiale sigma 2pz, une liaison latérale pi 2px.
Rappel (Voir page précédente) :
Maximum 1 liaison axiale entre 2 atomes.
Affirmation 5
Non.
Les orbitales ne se combinent que s’il y a moins de 14 eV entre les OA concernées.
Molécules homonucléaires (mêmes atomes) : énergies des orbitales identiques, les orbitales se combinent.
Note :
C’est le cas du diagramme des orbitales moléculaires et des exemples présentés.
Molécules hétéronucléaires (exemple : HCl) :
- Faire des diagrammes atomiques avec des échelles d’énergies exactes.
- Tenir compte des différences d’énergies, >14 eV, pour combiner ou non les orbitales.
Note :
Voir les très nombreux exemples de diagrammes sur Internet.
Affirmation 6
Non.
Les orbitales se combinent entre elles pour former :
- 1 OM liante et
- 1 OM antiliante.
Si les deux types d’OM sont remplis par un doublet d’électrons, les OM s’opposent et il n’y a pas d’orbitale moléculaire hybridée résultante.
Affirmation 7
Oui.
Indice de liaison = (Nb d’électrons dans les OM liantes – Nb d’électrons dans les OM antiliantes) / 2
Indice de liaison positif, plus d’électrons dans les OM liantes : liaison entre atomes stable.
Indice négatif : liaison atomique instable.