Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Constituants d’un atome
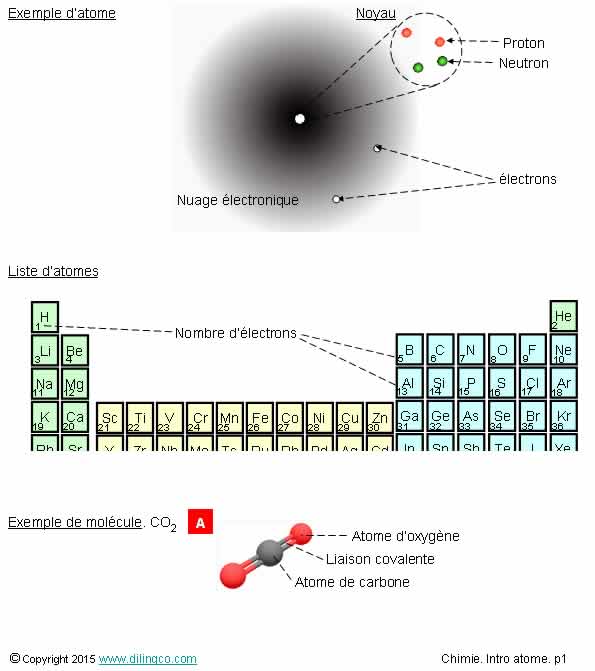
Dans un
atome, … sélectionner les deux affirmations
exactes :
1- Les
nombres de protons et d’électrons sont différents
2- Nombres
de neutrons = nombre de protons (Toujours)
3- Nombre
atomique de l’atome représenté = 2
4- Le
noyau a une charge électrique positive (les protons sont chargés positivement
et les neutrons n’ont pas de charge)
5- Un
électron d’un atome de Fer n’est pas identique à un électron d’un atome de cuivre
6- Les
noyaux sont identiques d’un atome à l’autre
Les affirmations
3 et 4 sont exactes.
Affirmation
1
Non.
Dans un atome :
nombre protons = nombre de neutrons
= nombre
atomique de l’atome
Note :
Ion =
atome, ou molécule, avec nombres d’électrons et de protons différents.
Affirmation
2
Non.
2 atomes
de même nombre de protons (de même nombre atomique) peuvent avoir des nombres de neutrons différents : ce sont des
isotopes.
Affirmation
3
Oui.
Le nombre
atomique d’un atome = nombre de protons = nombre d’électrons.
Un atome
a un même nombre de protons et d’électrons
(Nombres
différents : ions)
Affirmation
5
Si.
Les
électrons sont identiques d’un atome à l’autre.
Affirmation
6
Non.
Ne
serait-ce que par leur nombre de protons !
Rappels :
Atome
- Du Grec
« Atomos » : que l’ont ne peut diviser,
- Plus
petite partie d’un corps simple pouvant se
combiner chimiquement avec une autre pour donner une molécule,
- Les
atomes sont composés de particules élémentaires,
Protons, neutrons, électrons,
- Les atomes sont
listés dans un tableau périodique des
éléments,
- Une molécule est une combinaison
d’atomes.
Noyau
Le noyau
d’un atome est constitué de deux sortes de particules :
- Les protons, chargés positivement,
- Les neutrons, non chargés (d’où leur
nom).
Page 2.
Modèles atomiques
Sélectionner
l’affirmation exacte :
1- Les orbites électroniques circulaires, à diamètres constants, du modèle de
Bohr correspondent à la réalité
2- L’énergie
est la même d’une orbite de gravitation à l’autre
3- Modèle
de Schrödinger : applique la mécanique quantique à l’atome. Définit des
« orbitales », zones de probabilité de présence des électrons
4- La
forme des orbitales est identique d’un atome à l’autre
L’affirmation
3 est exacte.
Affirmation
1
Non.
Modèles atomiques : permettent de décrire les atomes et d’expliquer les lois qui les régissent.
Le modèle de Bohr ne correspond pas à la réalité atomique.
Dans la réalité, les électrons ne suivent pas des orbites circulaires mais des
chemins que l’on peut situer dans des zones probables définies par les lois de
la physique quantique.
Réalité
atomique : modèle quantique de Schrödinger.
Le modèle de Bohr est un moyen simple, pour les atomes à peu
d’électrons, de déterminer les électrons de la couche externe. Couche externe très importante
pour définir les réactions chimiques.
Suite aux
évolutions des connaissances, plusieurs modèles ont été définis :
1911.
Modèle de
Rutherford
Atome :
Un noyau et un ou des électron(s)
1913 : Modèle de Bohr
- Les
électron(s) décrivent des orbites circulaires
de rayons définis et constants
- Une orbite correspond à une énergie.
1926 : Modèle de Schrödinger
Modèle quantique de l’atome.
- La physique quantique est appliquée à
l’atome, l’électron devient une particule quantique.
- L’électron est une dualité onde-particule.
L’électron présente deux aspects, il peut se manifester tantôt comme un corpuscule, tantôt comme une onde, suivant le phénomène considéré.
- Il n’est pas possible de déterminer simultanément, et avec précision, la
position et la vitesse d’un électron.
- Plus
d’orbite circulaire mais notion d’orbitale
atomique (zone probable où se
trouve un électron).
- Les orbitales atomiques ont des formes diverses : sphériques, en formes d’haltères alignées
sur les axes x, y, z. etc.
Page 3.
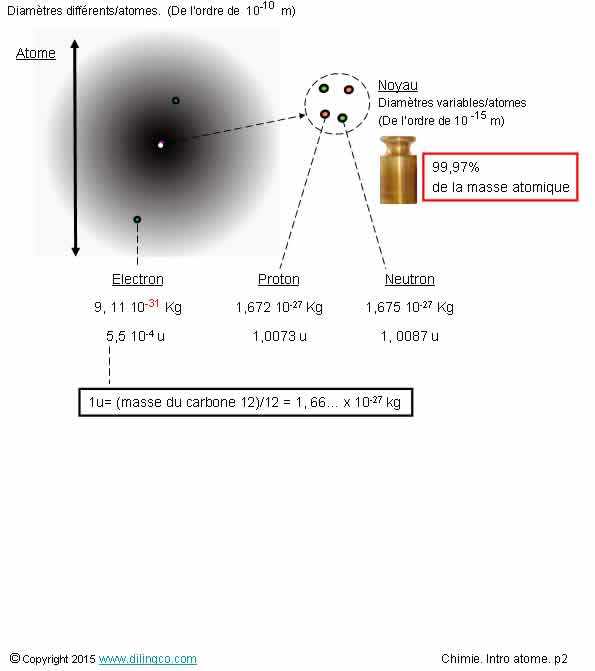
Tailles & masses
Sélectionner
l’affirmation exacte :
1- L’électron
est infiniment plus lourd que le noyau
2- Le
nuage atomique est environ 1000 fois plus grand que le noyau atomique
3- Masse
et quantité de matière = même chose
4- Les noyaux
dépendent des atomes considérés. Les électrons sont tous identiques
L’affirmation
4 est exacte.
Affirmation
1
Non,
c’est l’inverse.
Le noyau concentre l’essentiel de la masse de l’atome (99,97%).
La masse
d’un électron est négligeable comparée à celle du noyau.
Affirmation
2
Non.
L’atome
est infiniment plus grand que le noyau.
Le nuage
atomique est environ 100 000 (105) fois
plus grand que le noyau atomique.
Les noyaux et les nuages électroniques sont principalement
constitués de vide.
Volume de l’atome = 99,9999999999999% de vide.
Affirmation
3
Non.
Les très
grandes quantités d’éléments s’expriment en moles.
Exemple :
2 moles
d’atomes = 2 x (Na : nombre d’Avogadro)
= 2 x 6,023 x 1023
La masse
d’un élément s’exprime en Kg, ou, pour
les masses très petites, être comparée à la masse du carbone, en utilisant le
nombre de « u ».
Affirmation
4
Oui.
Les
électrons sont tous identiques : masse 9,1x10 -31 Kg.
Les
noyaux tous différents, de part leur nombre de protons, de neutrons, leur
diamètre.
Rappels :
Unité
de masse atomique
Unité de masse
unifiée
L’unité
de référence de la masse atomique, 1u, a été
choisie comme étant le douzième de la
masse d’un atome carbone 12
(Le carbone 12 est un isotope courant du carbone)
1u= 1/12
de la masse carbonne12 = 1, 66… x 10-27 kg
Une
unité = 1,66… x 10-27 kg
Exemples
de masse atomique :
La masse atomique du carbone12 est de 1 u.
La masse
atomique du fer est 55,845 u.
(Le fer est plus de 55 fois plus lourd que le carbone)
Le
Dalton
En
biochimie, le Dalton, symbole Da, est aussi utilisé.
1 Da = 1/12 de la masse d’un atome de carbone
1 Da = 1u
1 Da = approximativement la masse d’un atome d’hydrogène.
En
pratique, on utilise le Kilo Da.
La
mole
- La mole est une unité de comptage,
- Utilisée pour compter les nombres très importants d’éléments,
(Pour
éviter les « 10 puissances n »)
- Symbole
mol,
- 1 mol =
6,023 x 1023,
entités
6,023 x 1023 , est
appelé le nombre d’Avogadro.
La référence du nombre d’Avogadro est le nombre d’atomes contenu dans 12
grammes de carbone 12.
La quantité de matière n
d’un élément microscopique, exprimées en moles,
est donc le nombre d’éléments divisé par le nombre d’Avogadro:
n = N
/ Na
Voir aussi
Masse molaire
Système
international d’unités
La quantité de matière s’exprime en moles.
La masse s’exprime en kilogrammes.
La masse est fait aussi référence à l’énergie.
L’énergie s’exprime en Joules.
La charge électrique s’exprime
en Coulomb.
1 Coulomb= quantité d’électricité d’un courant de 1 ampère pendant 1 seconde =
6, 241… x 10-18 charges élémentaires.
La charge électrique d’un électron (ou d’un proton) :
e= 1,6. 10-19 Coulomb
La
constante de Faraday =
- charge
électrique globale d’une mole de charges élémentaires,
- Nombre
d’Avogadro x e
-
approximativement 9,65 104 C.mol-1.
(9,65 104
Coulomb par mole de charges élémentaires)
-
constante très utilisée en électromagnétisme et en électrochimie.
Page 4.
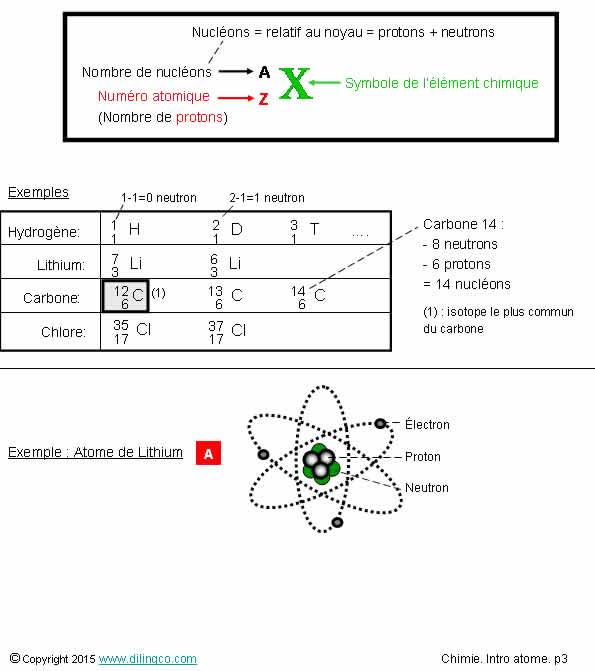
Numéro atomique. Isotopes
Sélectionner
les deux affirmations exactes :
1- Isotopes :
atomes d’un même élément chimique X, de même numéro atomique Z (même
nombre de protons), mais de nombres de neutrons différents
2- Numéro
atomique du lithium : 7
3- Atome d’hydrogène : 1 proton et 1 électron
4- Les
isotopes de l’hydrogène ont le même nom et les mêmes nombres de neutrons
5-
[A] : l’atome de lithium isotope 7
(3
protons, 3 électrons, noyau =7, 3 protons & 4 neutrons)
Les
affirmations 1 et 3 sont exactes.
Affirmation
1
Oui.
Exemple :
Le chlore a pour numéro atomique 17, 17 protons,
2
isotopes principaux :
- isotope 35 = 35 – 17 = 18 neutrons
- isotope 37 = 37 – 17 = 20 neutrons
Affirmation
2
Non.
Numéro
atomique du lithium : 3
Affirmation
3
Oui.
L’atome d’hydrogène a 1 proton et 1 électron.
Suivant
l’isotope, l’atome d’hydrogène a zéro, un, deux, …. n
neutrons.
Affirmation
4
Non.
Dans le
cas de l’hydrogène, les noms des isotopes changent :
L’isotope
1 de l’hydrogène est le plus commun
(Le noyau
est formé d’un proton, pas de neutron).
L’atome d’hydrogène isotope 2, un proton et un
neutron, est appelé Deutérium
L’atome
d’hydrogène isotope 3, un proton et deux neutrons, est appelé Tritium
Affirmation
7
Non.
D’après
le tableau périodique, le numéro atomique du fluor est 9 (9 protons).
Rappels :
Nucléon
Le
nucléon est :
- relatif
au noyau de l’atome,
- un
terme générique pour désigner un proton ou un
neutron.
Isotopes
On appelles atomes isotopes des atomes dont les
noyaux ont :
- le même
nombre de protons,
- des nombres différents de neutrons
Exemple :
Lithium 6 : 3 protons et 3 neutrons,
Lithium 7 : 3 protons et 4 neutrons.
Nom
des isotopes
Les
isotopes d’un même élément utilisent le même
symbole chimique.
Exemple :
C, pour les trois isotopes du carbone.
L’isotope
carbone 14 est radioactif. Il est utilisé pour la datation.
Exception :
Dans le
cas de l’hydrogène, les noms des isotopes changent :
L’isotope
1 de l’hydrogène est le plus commun
(Le noyau
est formé d’un proton, pas de neutron).
L’atome d’hydrogène isotope 2, un proton et un neutron, est appelé Deutérium
L’atome
d’hydrogène isotope 3, un proton et deux neutrons, est appelé Tritium
Page 5.
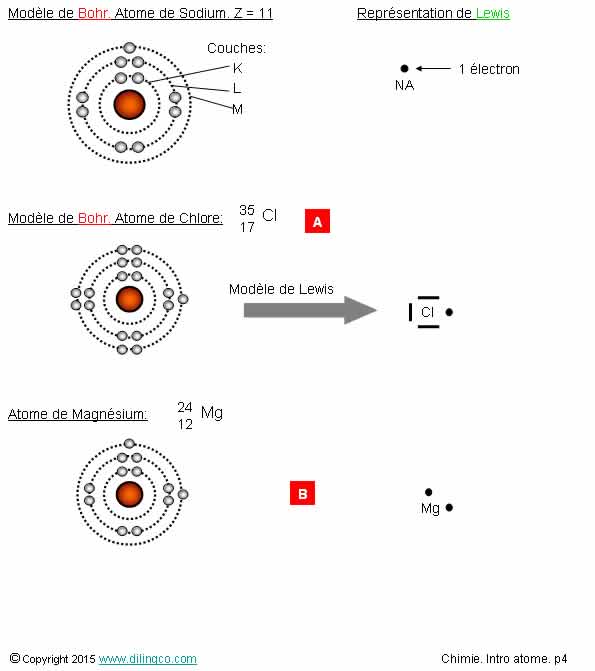
Modèle Bohr.
Représentation Lewis
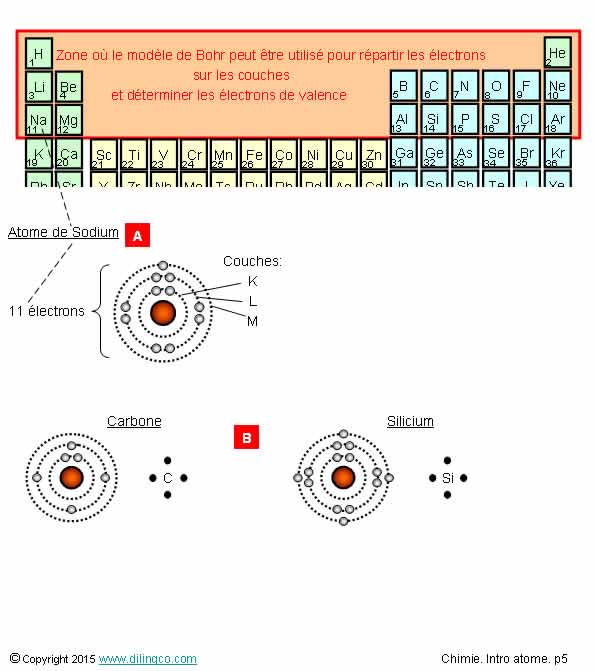
Sélectionner
l’affirmation exacte :
1- Modèle
de Bohr. Saturations électroniques : couche k=2 électrons, couche L=8
électrons, couche M=18 électrons, …
2- [A] :
L’atome de chlore a 35 électrons
3- [A] :
Dans le modèle de Lewis, huit barres et un point entourent le symbole Cl du
chlore
4- [B] : Atome de magnésium, représentations fausses
L’affirmation
1 est exacte.
Affirmation
1
Oui.
Chaque
couche peut contenir jusqu’à 2n2
électrons
Exemple : Couche P, n=6 = 72 électrons (2 x
36)
Les électrons se placent par priorité, et tant que la couche n’est pas saturée,
sur les couches les plus proches du noyau.
Remplir d’abord les couches basses.
Affirmation
2
Non.
L’atome de chlore a 17 électrons, numéro atomique 17
17 :
17 protons et 17 électrons.
35 :
isotope 35 du chlore = 35 – 17 = 18 neutrons
Affirmation
4
Non.
[B] : La répartition est correcte.
12 électrons :
- 2 électrons sur la couche 1,
- 8 électrons (4 paires) sur la couche 2,
- 1 électron à midi, 1
électron à 3h, sur la couche 3.
Rappels :
Modèle
de Bohr
Les
électrons se trouvent sur des couches électroniques sphériques autour du noyau.
Les couches sont numérotées de façon croissante à partir de la couche la plus
proche du noyau.
Elles
sont symbolisées par des lettres : K, L, M, …
(La couche k est la plus proche du noyau)
- Chaque
couche peut contenir jusqu’à un maximum de 2n2
électrons
K, n=1. Saturation : 2 électrons,
L, n=2. Saturation : 8 électrons, (8 = 2 x 4)
M, n=3. Saturation : 18
électrons, (18 = 2 x 9)
N, n=4. Saturation : 32
électrons,
O, n=5. Saturation : 50
électrons,
- Les
électrons se placent par priorité sur les couches les plus proches du noyau
jusqu'à saturation de la couche,
- Le
nombre de couches d’un atome dépend de son nombre d’électrons.
Note :
rechercher « Couche électronique » sur Google/Wikipédia
Règles de répartition des électrons
- Commencer par remplir les couches les plus proches du noyau,
- La
couche 1 ne peut recevoir que 2 électrons,
- Sur les
couches 2 et 3 on place d’abord un électron à midi, 3h, 6h, 9h avant
de faire des paires s’il reste des électrons à placer.
Attention :
La
répartition des électrons en utilisant les couches du modèle de Bohr donne un résultat correct pour les atomes de numéros atomiques inférieurs
à 19
(Les
atomes des trois premières lignes du tableau périodique des éléments).
Pour les atomes de numéros atomiques supérieurs utiliser le modèle quantique de
Schrödinger pour placer les électrons.
Représentation
de Lewis
Peut être
considéré comme une simplification du modèle de Bohr.
Seule la dernière couche est représentée.
Sur cette
dernière couche :
- Les paires d’électrons sont schématisées par une barre.
- Les électrons uniques
sont schématisés par un point.
Page 6.
Classification périodique
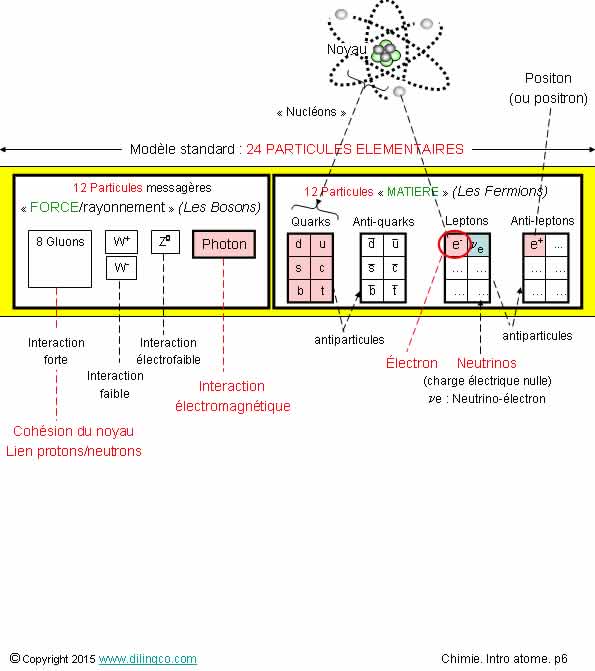
Sélectionner
les deux affirmations exactes :
1-
[A] : représentation de l’atome de magnésium dans le modèle de Bohr
2-
L’atome de lithium a les couches K et L saturées
3-
Tableau périodique : les éléments sont classés par numéro atomique
croissant
4- Les
électrons de cœur sont situés sur la couche de valence
5- Les colonnes
du tableau périodique ont des atomes de même nombre d’électrons de valence
6- [B].
Carbone et silicium : pas le même nombre d’électrons de valence, pas la
même représentation de Lewis, pas à la même colonne du tableau périodique
7-
Potassium, Z=19. Couche K=2 électrons, couche L=8 électrons, couche M=9
électrons
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
[A] :
11 électrons = représentation de
l’atome de sodium, Na, dans le modèle
de Bohr.
Affirmation
2
Non.
L’atome
de lithium, Z=3, 3 électrons, a la couche K saturée (2 électrons) et un
électron dans la deuxième couche (couche L)
Affirmation
3
Oui.
Tableau périodique : les éléments sont classés par numéro
atomique croissant.
Affirmation
4
Non.
Électrons de valence :
- sont
sur la dernière couche occupée (couche
de valence),
- sur les
sous-couches éventuellement non remplies.
Les
électrons de cœur sont les autres électrons ; non de valence.
Affirmation
6
Si.
[B] :
Le carbone et le silicium :
- même nombre d’électrons de valence,
- même
représentation de Lewis,
-
appartiennent à la même colonne du tableau
périodique.
- n’ont
pas le même nombre de couches occupées :
Si :
3 couches = 3ème ligne du tableau périodique.
Les lignes du tableau périodique correspondent aux couches
électroniques.
Affirmation
7
Non.
Ne pas utiliser le modèle de Bohr pour la répartition électronique des
atomes de Z>18
À partir de Z=19 Utiliser le modèle quantique
Voir
chapitre Répartition des électrons
Potassium.
Z=19. Répartition réelle des électrons :
Couche
K=2 électrons,
Couche
L=8 électrons,
Couche M=8 électrons, (Même si la couche M peut
contenir 18 électrons)
Couche N=1 électron.
Page 7.
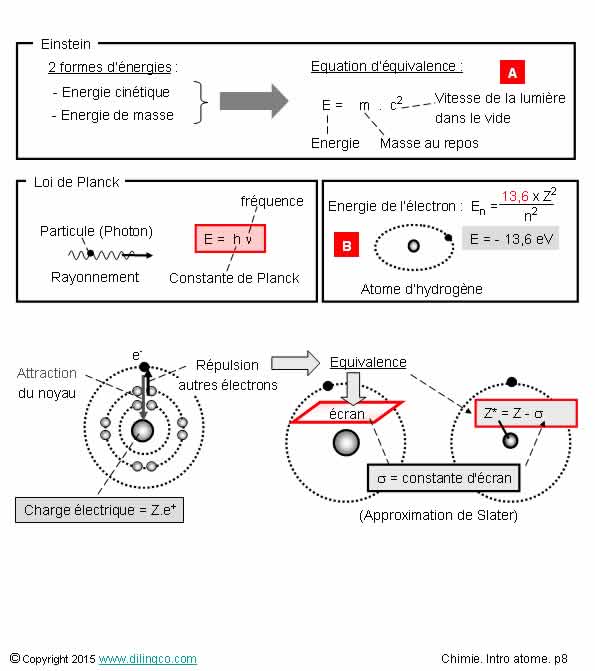
Orbites & énergies
Sélectionnez
les deux affirmations exactes :
1-
[A] : La charge électrique d’un électron dépend du niveau d’énergie
2- [B] :
L’électron arrive sur une orbite plus haute, il a moins d’énergie qu’au départ
3- Les
électrons des couches distantes sont moins attachés à l’atome que les électrons
des couches basses (électrons de cœur)
4-
[C] : Descendre d’un niveau = l’électron gagne de l’énergie
5-
[C] : La hauteur des marches (l’énergie, gagnée ou perdue, de passage d’un
niveau à l’autre), dépend de l’atome considéré
6-
[C] : Un électron peut rester entre deux niveaux d’énergie
Les affirmations
3 et 5 sont exactes.
Affirmation
1
Non.
[A] :
La charge électrique d’un électron est constante.
e= 1,6. 10-19 Coulomb
Affirmation
2
Non.
[B] :
Il faut fournir de l’énergie pour éloigner l’électron du
noyau : l’électron gagne de l’énergie.
Cette
énergie gagnée par l’électron « excité »
constitue une énergie potentielle.
L’énergie potentielle électronique peut être comparée à l’énergie gravitationnelle,
énergie d’autant plus élevée que la hauteur est grande.
Figure (1) :
L’énergie
cinétique d’un électron qui passe sur une orbite plus haute diminue moins
qu’augmente son énergie potentielle.
Total : l’énergie de l’électron augmente en
fonction du niveau de l’orbite.
Couches électroniques supérieures = énergies électroniques supérieures.
L’état fondamental d’un atome correspond à un atome sans
électron excité.
Les électrons sont sur les orbites d’énergies les plus faibles
possibles, fonction des lois de répartition électronique.
Affirmation
3
Oui.
L’attraction
entre charges électriques, e- et e+ des protons, est
inversement proportionnelle à la distance.
Affirmation
4
Non.
[C] :
Descendre d’un niveau = l’électron perd de l’énergie
L’énergie
perdue par l’électron est émise sous forme d’un photon.
Voir page suivante.
Affirmation
6
Non.
L’énergie
apportée à l’électron doit être au moins égale à la différence d’énergie des
deux orbites pour l’arracher du niveau inférieur et le faire passer au niveau
supérieur.
Page 8.
Emission d’énergie.
Photons
Sélectionner
l’affirmation exacte :
1-
[A] : L’absorption suffisante d’énergie fait passer l’électron à une
orbite inférieure
2- Atome
spécifique = niveaux d’énergie spécifiques = émission d’un spectre d’ondes
électromagnétiques spécifique lorsque ses électrons changent de niveaux
3- Un
photon est une onde d’énergie limitée à la lumière
4- Un
photon n’est pas aussi un grain d’énergie
L’affirmation
2 est exacte.
Affirmation
1
Non.
[A] :
passage à un niveau inférieur d’énergie = perte
d’énergie
=
émission d’un photon.
Affirmation
2
Oui.
Un atome
spécifique a un spectre d’émission d’ondes électromagnétiques spécifique.
Le spectre des ondes émises est une sorte de carte d’identité de
l’atome.
Par
comparaison de ces ondes à des spectres caractéristiques (de l’hydrogène, de
l’hélium, …) ont peut retrouver les composants présents dans un élément
observé.
Affirmation
3
Non.
La
lumière n’est que la partie visible du spectre d’un rayonnement
électromagnétique.
Affirmation
4
Si.
Dualité des rayons électromagnétiques :
- ils
sont des ondes, propagation d’un champ électrique
et d’un champ magnétique, perpendiculairement à l’axe célérité,
- ils sont
des flux de particules énergétiques, les Photons.
Un photon
est :
- une
particule énergétique,
- une
onde électromagnétique.
La
dualité onde-particule est un fondement de la mécanique quantique.
Photon
Un photon
est la particule élémentaire, un grain d’énergie,
associée à un rayonnement électromagnétique.
Voir chapitre Rappels rayonnements.
L’énergie d’un photon de rayonnement monochromatique (une seule longueur
d’onde) est donnée par une formule e=hv
h=
constante de Planck = 6,626068 × 10-34
v (nu) fréquence du rayonnement, en
Herz.
L’énergie d’un photon est une valeur,
« h » fois la fréquence de l’onde du rayonnement.
Rayonnements
en biologie
Les
rayonnements qui nous intéressent en biophysique :
- des rayonnements de particules, chargées ou non.
- des rayonnements d’ondes électromagnétiques.
Ondes électromagnétiques
Suivant
la fréquence des ondes électromagnétiques on obtient un spectre d’ondes électromagnétiques (Longueurs
d’ondes : de 0,01 nm pour les rayons gamma, à 1 Km pour les ondes radios
« grandes ondes ») :
- Rayons Gamma,
- Rayons X,
- Ultraviolets,
- Lumière visible,
- Infrarouges,
- Ondes, qualification
usuelle «électromagnétiques» : four à micro-ondes, électroaimants, radio,
télévisions etc.
Page 9.
Particules élémentaires
Sélectionner
l’affirmation exacte :
1- Quarks :
Particules élémentaires de matière constitutives des protons et des neutrons
2- Les
électrons sont des particules élémentaires sans masse
3- Le modèle standard de la physique des particules ne décrit que des
particules élémentaires de matière
4- Un
électron qui se combine avec un neutrino disparaît
L’affirmation
1 est exacte.
Affirmation
1
Oui.
La matière des atomes est constituée de particules élémentaires, les quarks et les leptons.
Les
quarks sont les composants matière des nucléons.
Nucléons :
désignation générique des composants du noyau, protons
& neutrons.
Affirmation
2
Non.
Les électrons sont des particules « matière » et ont une masse :
9.11 x 10-31
Kg
(La plus
faible masse de toutes les particules chargées)
Affirmation
3
Non.
Il y a aussi des particules messagères, vecteurs de transmission de forces.
Une
analogie :
Deux personnes, dans des barques, qui se transmettent un ballon.
La réception du ballon fait bouger la barque distante. Dans cette
analogie, le ballon est la particule de transmission de force. (Sauf que pour
que l’analogie soit parfaite, il faudrait que le ballon soit sans masse).
Affirmation
4
Non.
Un
électron est un lepton.
Un lepton se combine, s’annihile, avec son antiparticule
lepton (antimatière).
Un électron
se combine avec un positon pour disparaître.
Les
masses se transforment en énergies.
Photons :
énergie équivalente à la masse annihilée (2 photons de 511 keV).
Le
neutrino est, comme un électron, un lepton. Il se combine avec un antineutrino.
Affirmation
4
Non.
Fonction
de son énergie, un électron d’un atome d’hydrogène peut se trouver sur
différentes orbites.
L’atome d’hydrogène peut même perdre son unique électron et devenir en
conséquence un ion hydrogène H+
H+ = la charge
d’un cation hydrogène est positive.
(Dans un cation, ion attiré par une cathode, d’où le nom cation, il y a plus de
protons que d’électrons)
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Constituants d’un atome

Dans un atome, … sélectionner les deux affirmations exactes :
1- Les nombres de protons et d’électrons sont différents
2- Nombres de neutrons = nombre de protons (Toujours)
3- Nombre atomique de l’atome représenté = 2
4- Le noyau a une charge électrique positive (les protons sont chargés positivement et les neutrons n’ont pas de charge)
5- Un électron d’un atome de Fer n’est pas identique à un électron d’un atome de cuivre
6- Les noyaux sont identiques d’un atome à l’autre
Les affirmations 3 et 4 sont exactes.
Affirmation 1
Non.
Dans un atome :
nombre protons = nombre de neutrons
= nombre atomique de l’atome
Note :
Ion = atome, ou molécule, avec nombres d’électrons et de protons différents.
Affirmation 2
Non.
2 atomes de même nombre de protons (de même nombre atomique) peuvent avoir des nombres de neutrons différents : ce sont des isotopes.
Affirmation 3
Oui.
Le nombre atomique d’un atome = nombre de protons = nombre d’électrons.
Un atome a un même nombre de protons et d’électrons
(Nombres différents : ions)
Affirmation 5
Si.
Les électrons sont identiques d’un atome à l’autre.
Affirmation 6
Non.
Ne serait-ce que par leur nombre de protons !
Rappels :
Atome
- Du Grec « Atomos » : que l’ont ne peut diviser,
- Plus petite partie d’un corps simple pouvant se combiner chimiquement avec une autre pour donner une molécule,
- Les atomes sont composés de particules élémentaires,
Protons, neutrons, électrons,
- Les atomes sont
listés dans un tableau périodique des
éléments,
- Une molécule est une combinaison
d’atomes.
Noyau
Le noyau
d’un atome est constitué de deux sortes de particules :
- Les protons, chargés positivement,
- Les neutrons, non chargés (d’où leur
nom).
Page 2.
Modèles atomiques

Sélectionner l’affirmation exacte :
1- Les orbites électroniques circulaires, à diamètres constants, du modèle de
Bohr correspondent à la réalité
2- L’énergie est la même d’une orbite de gravitation à l’autre
3- Modèle de Schrödinger : applique la mécanique quantique à l’atome. Définit des « orbitales », zones de probabilité de présence des électrons
4- La forme des orbitales est identique d’un atome à l’autre
L’affirmation 3 est exacte.
Affirmation
1
Non.
Modèles atomiques : permettent de décrire les atomes et d’expliquer les lois qui les régissent.
Le modèle de Bohr ne correspond pas à la réalité atomique.
Dans la réalité, les électrons ne suivent pas des orbites circulaires mais des
chemins que l’on peut situer dans des zones probables définies par les lois de
la physique quantique.
Réalité atomique : modèle quantique de Schrödinger.
Le modèle de Bohr est un moyen simple, pour les atomes à peu d’électrons, de déterminer les électrons de la couche externe. Couche externe très importante pour définir les réactions chimiques.
Suite aux évolutions des connaissances, plusieurs modèles ont été définis :
1911.
Modèle de
Rutherford
Atome :
Un noyau et un ou des électron(s)
1913 : Modèle de Bohr
- Les
électron(s) décrivent des orbites circulaires
de rayons définis et constants
- Une orbite correspond à une énergie.
1926 : Modèle de Schrödinger
Modèle quantique de l’atome.
- La physique quantique est appliquée à
l’atome, l’électron devient une particule quantique.
- L’électron est une dualité onde-particule.
L’électron présente deux aspects, il peut se manifester tantôt comme un corpuscule, tantôt comme une onde, suivant le phénomène considéré.
- Il n’est pas possible de déterminer simultanément, et avec précision, la
position et la vitesse d’un électron.
- Plus
d’orbite circulaire mais notion d’orbitale
atomique (zone probable où se
trouve un électron).
- Les orbitales atomiques ont des formes diverses : sphériques, en formes d’haltères alignées
sur les axes x, y, z. etc.
Page 3.
Tailles & masses

Sélectionner l’affirmation exacte :
1- L’électron est infiniment plus lourd que le noyau
2- Le nuage atomique est environ 1000 fois plus grand que le noyau atomique
3- Masse et quantité de matière = même chose
4- Les noyaux dépendent des atomes considérés. Les électrons sont tous identiques
L’affirmation 4 est exacte.
Affirmation 1
Non, c’est l’inverse.
Le noyau concentre l’essentiel de la masse de l’atome (99,97%).
La masse d’un électron est négligeable comparée à celle du noyau.
Affirmation 2
Non.
L’atome est infiniment plus grand que le noyau.
Le nuage atomique est environ 100 000 (105) fois plus grand que le noyau atomique.
Les noyaux et les nuages électroniques sont principalement constitués de vide. Volume de l’atome = 99,9999999999999% de vide.
Affirmation 3
Non.
Les très grandes quantités d’éléments s’expriment en moles.
Exemple :
2 moles d’atomes = 2 x (Na : nombre d’Avogadro)
= 2 x 6,023 x 1023
La masse d’un élément s’exprime en Kg, ou, pour les masses très petites, être comparée à la masse du carbone, en utilisant le nombre de « u ».
Affirmation 4
Oui.
Les électrons sont tous identiques : masse 9,1x10 -31 Kg.
Les noyaux tous différents, de part leur nombre de protons, de neutrons, leur diamètre.
Rappels :
Unité
de masse atomique
Unité de masse
unifiée
L’unité de référence de la masse atomique, 1u, a été choisie comme étant le douzième de la masse d’un atome carbone 12
(Le carbone 12 est un isotope courant du carbone)
1u= 1/12 de la masse carbonne12 = 1, 66… x 10-27 kg
Une unité = 1,66… x 10-27 kg
Exemples
de masse atomique :
La masse atomique du carbone12 est de 1 u.
La masse atomique du fer est 55,845 u.
(Le fer est plus de 55 fois plus lourd que le carbone)
Le Dalton
En biochimie, le Dalton, symbole Da, est aussi utilisé.
1 Da = 1/12 de la masse d’un atome de carbone
1 Da = 1u
1 Da = approximativement la masse d’un atome d’hydrogène.
En pratique, on utilise le Kilo Da.
La
mole
- La mole est une unité de comptage,
- Utilisée pour compter les nombres très importants d’éléments,
(Pour éviter les « 10 puissances n »)
- Symbole mol,
- 1 mol = 6,023 x 1023, entités
6,023 x 1023 , est
appelé le nombre d’Avogadro.
La référence du nombre d’Avogadro est le nombre d’atomes contenu dans 12
grammes de carbone 12.
La quantité de matière n d’un élément microscopique, exprimées en moles, est donc le nombre d’éléments divisé par le nombre d’Avogadro:
n = N / Na
Voir aussi Masse molaire
Système international d’unités
La quantité de matière s’exprime en moles.
La masse s’exprime en kilogrammes.
La masse est fait aussi référence à l’énergie.
L’énergie s’exprime en Joules.
La charge électrique s’exprime
en Coulomb.
1 Coulomb= quantité d’électricité d’un courant de 1 ampère pendant 1 seconde =
6, 241… x 10-18 charges élémentaires.
La charge électrique d’un électron (ou d’un proton) :
e= 1,6. 10-19 Coulomb
La constante de Faraday =
- charge électrique globale d’une mole de charges élémentaires,
- Nombre d’Avogadro x e
- approximativement 9,65 104 C.mol-1.
(9,65 104 Coulomb par mole de charges élémentaires)
- constante très utilisée en électromagnétisme et en électrochimie.
Page 4.
Numéro atomique. Isotopes

Sélectionner les deux affirmations exactes :
1- Isotopes : atomes d’un même élément chimique X, de même numéro atomique Z (même nombre de protons), mais de nombres de neutrons différents
2- Numéro atomique du lithium : 7
3- Atome d’hydrogène : 1 proton et 1 électron
4- Les isotopes de l’hydrogène ont le même nom et les mêmes nombres de neutrons
5- [A] : l’atome de lithium isotope 7
(3 protons, 3 électrons, noyau =7, 3 protons & 4 neutrons)
Les affirmations 1 et 3 sont exactes.
Affirmation 1
Oui.
Exemple :
Le chlore a pour numéro atomique 17, 17 protons,
2 isotopes principaux :
- isotope 35 = 35 – 17 = 18 neutrons
- isotope 37 = 37 – 17 = 20 neutrons
Affirmation 2
Non.
Numéro atomique du lithium : 3
Affirmation 3
Oui.
L’atome d’hydrogène a 1 proton et 1 électron.
Suivant l’isotope, l’atome d’hydrogène a zéro, un, deux, …. n neutrons.
Affirmation 4
Non.
Dans le cas de l’hydrogène, les noms des isotopes changent :
L’isotope 1 de l’hydrogène est le plus commun
(Le noyau
est formé d’un proton, pas de neutron).
L’atome d’hydrogène isotope 2, un proton et un
neutron, est appelé Deutérium
L’atome
d’hydrogène isotope 3, un proton et deux neutrons, est appelé Tritium
Affirmation 7
Non.
D’après le tableau périodique, le numéro atomique du fluor est 9 (9 protons).
Rappels :
Nucléon
Le nucléon est :
- relatif au noyau de l’atome,
- un terme générique pour désigner un proton ou un neutron.
Isotopes
On appelles atomes isotopes des atomes dont les
noyaux ont :
- le même
nombre de protons,
- des nombres différents de neutrons
Exemple :
Lithium 6 : 3 protons et 3 neutrons,
Lithium 7 : 3 protons et 4 neutrons.
Nom des isotopes
Les
isotopes d’un même élément utilisent le même
symbole chimique.
Exemple :
C, pour les trois isotopes du carbone.
L’isotope carbone 14 est radioactif. Il est utilisé pour la datation.
Exception :
Dans le cas de l’hydrogène, les noms des isotopes changent :
L’isotope 1 de l’hydrogène est le plus commun
(Le noyau
est formé d’un proton, pas de neutron).
L’atome d’hydrogène isotope 2, un proton et un neutron, est appelé Deutérium
L’atome
d’hydrogène isotope 3, un proton et deux neutrons, est appelé Tritium
Page 5.
Modèle Bohr. Représentation Lewis

Sélectionner l’affirmation exacte :
1- Modèle de Bohr. Saturations électroniques : couche k=2 électrons, couche L=8 électrons, couche M=18 électrons, …
2- [A] : L’atome de chlore a 35 électrons
3- [A] :
Dans le modèle de Lewis, huit barres et un point entourent le symbole Cl du
chlore
4- [B] : Atome de magnésium, représentations fausses
L’affirmation 1 est exacte.
Affirmation 1
Oui.
Chaque
couche peut contenir jusqu’à 2n2
électrons
Exemple : Couche P, n=6 = 72 électrons (2 x
36)
Les électrons se placent par priorité, et tant que la couche n’est pas saturée,
sur les couches les plus proches du noyau.
Remplir d’abord les couches basses.
Affirmation 2
Non.
L’atome de chlore a 17 électrons, numéro atomique 17
17 : 17 protons et 17 électrons.
35 : isotope 35 du chlore = 35 – 17 = 18 neutrons
Affirmation 4
Non.
[B] : La répartition est correcte.
12 électrons :
- 2 électrons sur la couche 1,
- 8 électrons (4 paires) sur la couche 2,
- 1 électron à midi, 1 électron à 3h, sur la couche 3.
Rappels :
Modèle de Bohr
Les
électrons se trouvent sur des couches électroniques sphériques autour du noyau.
Les couches sont numérotées de façon croissante à partir de la couche la plus
proche du noyau.
Elles
sont symbolisées par des lettres : K, L, M, …
(La couche k est la plus proche du noyau)
- Chaque
couche peut contenir jusqu’à un maximum de 2n2
électrons
K, n=1. Saturation : 2 électrons,
L, n=2. Saturation : 8 électrons, (8 = 2 x 4)
M, n=3. Saturation : 18
électrons, (18 = 2 x 9)
N, n=4. Saturation : 32
électrons,
O, n=5. Saturation : 50
électrons,
- Les électrons se placent par priorité sur les couches les plus proches du noyau jusqu'à saturation de la couche,
- Le nombre de couches d’un atome dépend de son nombre d’électrons.
Note : rechercher « Couche électronique » sur Google/Wikipédia
Règles de répartition des électrons
- Commencer par remplir les couches les plus proches du noyau,
- La couche 1 ne peut recevoir que 2 électrons,
- Sur les couches 2 et 3 on place d’abord un électron à midi, 3h, 6h, 9h avant de faire des paires s’il reste des électrons à placer.
Attention :
La répartition des électrons en utilisant les couches du modèle de Bohr donne un résultat correct pour les atomes de numéros atomiques inférieurs à 19
(Les
atomes des trois premières lignes du tableau périodique des éléments).
Pour les atomes de numéros atomiques supérieurs utiliser le modèle quantique de
Schrödinger pour placer les électrons.
Représentation de Lewis
Peut être considéré comme une simplification du modèle de Bohr.
Seule la dernière couche est représentée.
Sur cette
dernière couche :
- Les paires d’électrons sont schématisées par une barre.
- Les électrons uniques sont schématisés par un point.
Page 6.
Classification périodique

Sélectionner les deux affirmations exactes :
1- [A] : représentation de l’atome de magnésium dans le modèle de Bohr
2- L’atome de lithium a les couches K et L saturées
3- Tableau périodique : les éléments sont classés par numéro atomique croissant
4- Les électrons de cœur sont situés sur la couche de valence
5- Les colonnes du tableau périodique ont des atomes de même nombre d’électrons de valence
6- [B]. Carbone et silicium : pas le même nombre d’électrons de valence, pas la même représentation de Lewis, pas à la même colonne du tableau périodique
7- Potassium, Z=19. Couche K=2 électrons, couche L=8 électrons, couche M=9 électrons
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
[A] : 11 électrons = représentation de l’atome de sodium, Na, dans le modèle de Bohr.
Affirmation 2
Non.
L’atome de lithium, Z=3, 3 électrons, a la couche K saturée (2 électrons) et un électron dans la deuxième couche (couche L)
Affirmation 3
Oui.
Tableau périodique : les éléments sont classés par numéro atomique croissant.
Affirmation 4
Non.
Électrons de valence :
- sont sur la dernière couche occupée (couche de valence),
- sur les sous-couches éventuellement non remplies.
Les électrons de cœur sont les autres électrons ; non de valence.
Affirmation 6
Si.
[B] : Le carbone et le silicium :
- même nombre d’électrons de valence,
- même représentation de Lewis,
- appartiennent à la même colonne du tableau périodique.
- n’ont pas le même nombre de couches occupées :
Si : 3 couches = 3ème ligne du tableau périodique.
Les lignes du tableau périodique correspondent aux couches électroniques.
Affirmation 7
Non.
Ne pas utiliser le modèle de Bohr pour la répartition électronique des atomes de Z>18
À partir de Z=19 Utiliser le modèle quantique
Voir chapitre Répartition des électrons
Potassium. Z=19. Répartition réelle des électrons :
Couche K=2 électrons,
Couche L=8 électrons,
Couche M=8 électrons, (Même si la couche M peut contenir 18 électrons)
Couche N=1 électron.
Page 7.
Orbites & énergies

Sélectionnez les deux affirmations exactes :
1- [A] : La charge électrique d’un électron dépend du niveau d’énergie
2- [B] : L’électron arrive sur une orbite plus haute, il a moins d’énergie qu’au départ
3- Les électrons des couches distantes sont moins attachés à l’atome que les électrons des couches basses (électrons de cœur)
4- [C] : Descendre d’un niveau = l’électron gagne de l’énergie
5- [C] : La hauteur des marches (l’énergie, gagnée ou perdue, de passage d’un niveau à l’autre), dépend de l’atome considéré
6- [C] : Un électron peut rester entre deux niveaux d’énergie
Les affirmations 3 et 5 sont exactes.
Affirmation 1
Non.
[A] : La charge électrique d’un électron est constante.
e= 1,6. 10-19 Coulomb
Affirmation 2
Non.
[B] :
Il faut fournir de l’énergie pour éloigner l’électron du noyau : l’électron gagne de l’énergie.
Cette
énergie gagnée par l’électron « excité »
constitue une énergie potentielle.
L’énergie potentielle électronique peut être comparée à l’énergie gravitationnelle,
énergie d’autant plus élevée que la hauteur est grande.
Figure (1) :
L’énergie
cinétique d’un électron qui passe sur une orbite plus haute diminue moins
qu’augmente son énergie potentielle.
Total : l’énergie de l’électron augmente en
fonction du niveau de l’orbite.
Couches électroniques supérieures = énergies électroniques supérieures.
L’état fondamental d’un atome correspond à un atome sans électron excité.
Les électrons sont sur les orbites d’énergies les plus faibles possibles, fonction des lois de répartition électronique.
Affirmation 3
Oui.
L’attraction entre charges électriques, e- et e+ des protons, est inversement proportionnelle à la distance.
Affirmation 4
Non.
[C] : Descendre d’un niveau = l’électron perd de l’énergie
L’énergie perdue par l’électron est émise sous forme d’un photon.
Voir page suivante.
Affirmation 6
Non.
L’énergie apportée à l’électron doit être au moins égale à la différence d’énergie des deux orbites pour l’arracher du niveau inférieur et le faire passer au niveau supérieur.
Page 8.
Emission d’énergie. Photons

Sélectionner l’affirmation exacte :
1- [A] : L’absorption suffisante d’énergie fait passer l’électron à une orbite inférieure
2- Atome spécifique = niveaux d’énergie spécifiques = émission d’un spectre d’ondes électromagnétiques spécifique lorsque ses électrons changent de niveaux
3- Un photon est une onde d’énergie limitée à la lumière
4- Un photon n’est pas aussi un grain d’énergie
L’affirmation 2 est exacte.
Affirmation 1
Non.
[A] : passage à un niveau inférieur d’énergie = perte d’énergie
= émission d’un photon.
Affirmation 2
Oui.
Un atome spécifique a un spectre d’émission d’ondes électromagnétiques spécifique.
Le spectre des ondes émises est une sorte de carte d’identité de l’atome.
Par comparaison de ces ondes à des spectres caractéristiques (de l’hydrogène, de l’hélium, …) ont peut retrouver les composants présents dans un élément observé.
Affirmation 3
Non.
La lumière n’est que la partie visible du spectre d’un rayonnement électromagnétique.
Affirmation 4
Si.
Dualité des rayons électromagnétiques :
- ils sont des ondes, propagation d’un champ électrique et d’un champ magnétique, perpendiculairement à l’axe célérité,
- ils sont des flux de particules énergétiques, les Photons.
Un photon est :
- une particule énergétique,
- une onde électromagnétique.
La dualité onde-particule est un fondement de la mécanique quantique.
Photon
Un photon est la particule élémentaire, un grain d’énergie, associée à un rayonnement électromagnétique.
Voir chapitre Rappels rayonnements.
L’énergie d’un photon de rayonnement monochromatique (une seule longueur d’onde) est donnée par une formule e=hv
h= constante de Planck = 6,626068 × 10-34
v (nu) fréquence du rayonnement, en
Herz.
L’énergie d’un photon est une valeur,
« h » fois la fréquence de l’onde du rayonnement.
Rayonnements en biologie
Les rayonnements qui nous intéressent en biophysique :
- des rayonnements de particules, chargées ou non.
- des rayonnements d’ondes électromagnétiques.
Ondes électromagnétiques
Suivant la fréquence des ondes électromagnétiques on obtient un spectre d’ondes électromagnétiques (Longueurs d’ondes : de 0,01 nm pour les rayons gamma, à 1 Km pour les ondes radios « grandes ondes ») :
- Rayons Gamma,
- Rayons X,
- Ultraviolets,
- Lumière visible,
- Infrarouges,
- Ondes, qualification usuelle «électromagnétiques» : four à micro-ondes, électroaimants, radio, télévisions etc.
Page 9.
Particules élémentaires

Sélectionner l’affirmation exacte :
1- Quarks : Particules élémentaires de matière constitutives des protons et des neutrons
2- Les
électrons sont des particules élémentaires sans masse
3- Le modèle standard de la physique des particules ne décrit que des
particules élémentaires de matière
4- Un électron qui se combine avec un neutrino disparaît
L’affirmation 1 est exacte.
Affirmation 1
Oui.
La matière des atomes est constituée de particules élémentaires, les quarks et les leptons.
Les quarks sont les composants matière des nucléons.
Nucléons : désignation générique des composants du noyau, protons & neutrons.
Affirmation 2
Non.
Les électrons sont des particules « matière » et ont une masse :
9.11 x 10-31 Kg
(La plus faible masse de toutes les particules chargées)
Affirmation 3
Non.
Il y a aussi des particules messagères, vecteurs de transmission de forces.
Une analogie :
Deux personnes, dans des barques, qui se transmettent un ballon.
La réception du ballon fait bouger la barque distante. Dans cette analogie, le ballon est la particule de transmission de force. (Sauf que pour que l’analogie soit parfaite, il faudrait que le ballon soit sans masse).
Affirmation 4
Non.
Un électron est un lepton.
Un lepton se combine, s’annihile, avec son antiparticule lepton (antimatière).
Un électron se combine avec un positon pour disparaître.
Les masses se transforment en énergies.
Photons : énergie équivalente à la masse annihilée (2 photons de 511 keV).
Le neutrino est, comme un électron, un lepton. Il se combine avec un antineutrino.
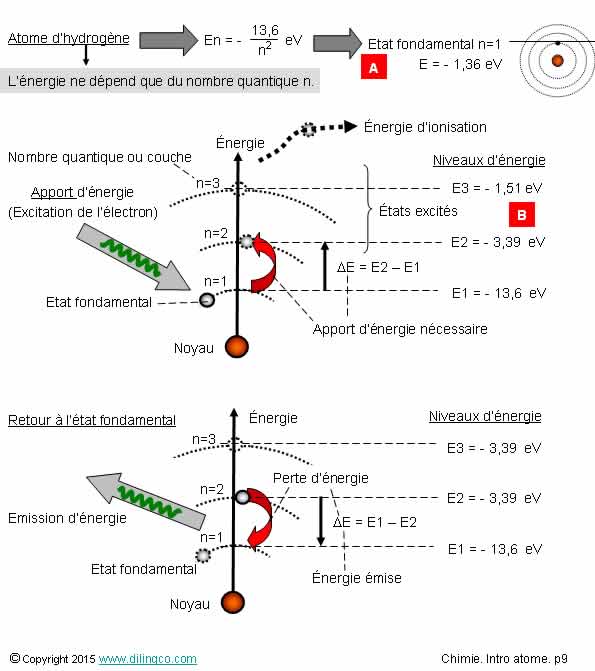
Affirmation 4
Non.
Fonction
de son énergie, un électron d’un atome d’hydrogène peut se trouver sur
différentes orbites.
L’atome d’hydrogène peut même perdre son unique électron et devenir en
conséquence un ion hydrogène H+
H+ = la charge
d’un cation hydrogène est positive.
(Dans un cation, ion attiré par une cathode, d’où le nom cation, il y a plus de
protons que d’électrons)