Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page
1.
Acides aminés et
protéines
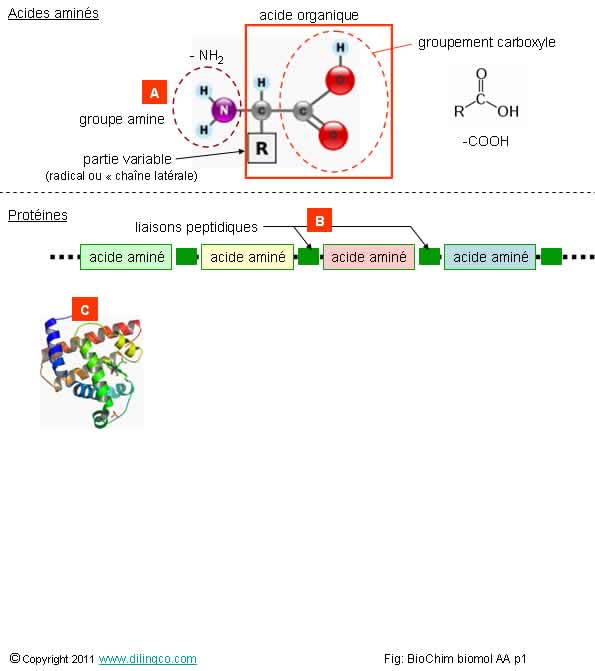
Sélectionner l’affirmation exacte :
1- Les acides aminés sont des acides organiques contenant un
groupement amine
2- [A] : groupement carboxyle
3- [B] : groupement amine
4- [C] : structure spatiale d’une protéine : tous les AA
aminés sont dans un même plant. Le nombre total d’acides aminés (à partir des
20 AA de base), est limité
L’affirmation 1 est exacte.
Affirmation 1
Oui.
Les acides organiques (ou acides carboxyliques), sont formés d’un groupement
carboxylique (-COOH) et d’un radical quelconque.
Exemple :
Acide formique : H-COOH
Acide acétique : CH3–COOH (dans le vinaigre ; antiseptique et
désinfectant)
Acide oxalique : CHOOH-CHOOH
Rappels :
Acides
aminés
Les acides aminés (ou aminoacides), ont 2 groupes
fonctionnels :
- un groupement carboxyle –COOH
- un groupement amine –NH2.
Protéines
Les
protéines sont des polymères d’acides aminés.
Toutes
les protéines de notre organisme sont construites
à partir de 20 acides aminés de base.
Les
acides aminés sont reliés entre eux par des liaisons
peptidiques pour former une chaîne plus
ou moins longue.
Le nombre
et la chronologie des acides aminés d’une chaîne sont spécifiques à la
protéine.
Note :
Un enzyme est une protéine avec un pouvoir catalytique.
Page 2.
L - acides alpha aminés
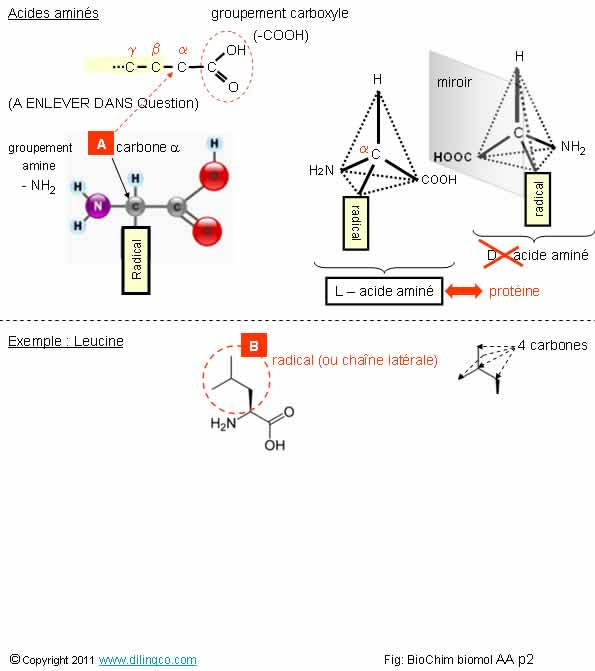
Sélectionner
l’affirmation exacte :
1-
[A] : les groupements amine, carboxyle, l’hydrogène, le radical (appelé
« chaîne latérale »), sont connectés sur le carbone bêta de la chaîne
aliphatique
2-
[B] : la chaîne latérale aliphatique composée de 3 carbones
3- Les acides aminés les plus communs sont les acides alpha
aminés ; Les acides alpha aminés les plus communs sont ceux de la série L
4- L’atome de carbone a un total de 4 électrons
L’affirmation 3 est exacte.
Affirmation 3
Oui.
Ces acides aminés sont les briques de base des protéines.
Exceptions :
- Les membranes bactériennes contiennent des D-alanine et des D-glutamine : acide
aminés de la série D.
- Des acides aminés modifiés, qui découlent des acides aminés de base,
sont dans le collagène.
Affirmation 4
Non.
Numéro atomique du carbone : 6C
- 2 électrons de cœur,
- 4 électrons de valence.
Rappels :
Aliphatique
Du grec aleiphar,
-atos : graisse
(Terme
initialement utilisés pour décrire les acides gras à chaîne linéaire))
Composé carboné acyclique ou cyclique, saturé ou insaturé, à l'exclusion des composés aromatiques,
Les
carbones de la chaîne aliphatique sont numérotés par les lettres de l’alphabet
Grec (le premier : carbone alpha).
Page 3.
Liste et codages des AA
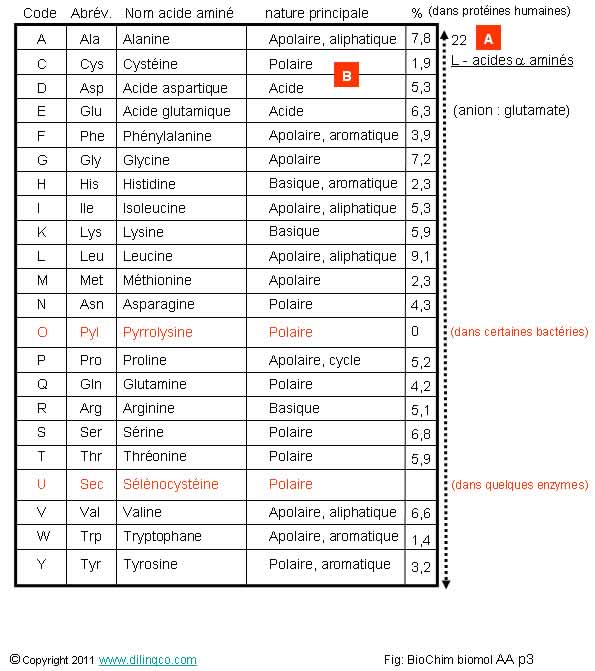
Sélectionner
l’affirmation exacte :
1- [A] :
21 des 22 acides aminés de base sont utilisés pour constituer les protéines (Un enzyme est une protéine avec un pouvoir catalytique)
2- [A] : liste des acides bêta aminés de la série D, briques
de base des protéines
3- [B] :
Un acide aminé ne peut pas être de plusieurs natures
4-
L’alanine est l’acide aminé le plus souvent rencontré dans les protéines
L’affirmation
1 est exacte.
Affirmation
1
Oui.
Des acides aminés modifiés, qui découlent des acides aminés de base,
peuvent se rencontrer.
Exemples :
- dans le collagène,
- lors des processus métaboliques.
(homo-cystéine, méthyl-histidine, etc.)
Affirmation
3
Si.
Les
acides aminés apolaires, aliphatiques, hydrophobes,
tendent à occuper le cœur des protéines.
Les
acides aminés polaires (hydrophiles),
tendent à occuper la surface des protéines.
Affirmation
4
Non.
La leucine est l’acide aminé qui a la plus forte occurrence dans les protéines.
Rappels :
AA : Acides Aminés
2 Codes
Pour
faciliter la lecture des AA des composant les protéines, deux codes
internationaux existent :
- un code à une lettre
(La
première lettre du nom ou, en cas de redondance, une autre lettre)
Le code à
une lettre est très utilisé pour le stockage des séquences protéiniques dans
les banques de données.
- un code à trois lettres
(Généralement
les trois premières lettres du nom de l’acide aminé).
Page 4.
G, A, I, L, V. Chaîne
aliphatique
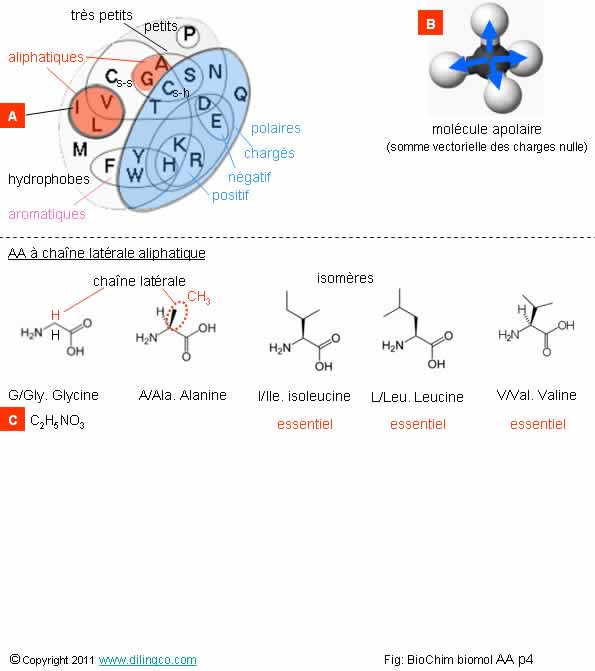
Sélectionner
les deux affirmations exactes :
1- Les AA
aliphatiques sont apolaires et hydrophobes.
2- La
glycine a un radical/chaîne latérale composée d’un seul H, pas de carbone
asymétrique et pas de molécule chirale/énantiomère
3-
[A] : I = isomére
4- [B] :
exemple de molécule polaire
5- Alanine :
pas de chaîne latérale
6- [C] :
C2H3O2
7-
L’isoleucine et la leucine ne sont pas des molécules isomères
Les
affirmations 1 et 2 sont exactes.
Affirmation
2
Oui.
Classée
dans les AA aliphatique par défaut.
Énantiomères : molécules isomères images l’une de l’autre dans un miroir
et non superposables.
Chirales : deux molécules énantiomères.
Isomères : molécules de même formule brute mais de formules
semi-développées ou développées différentes.
Affirmation
3
Non.
I =
Isoleucine suivant le codage une lettre des AA
(« Ile »
suivant le codage à 3 lettres)
Affirmation
5
Si.
Un
carbone ; une chaîne latérale méthyle.
Rappels :
AA
essentiels
Les éléments chimiques essentiels ne peuvent pas être
synthétisés par l’homme mais lui sont essentiels
pour son métabolisme.
Les éléments
chimiques essentiels proviennent donc de l’alimentation.
Certains
acides gras, certains acides aminés, entrent dans ce cas, et sont donc dits
« essentiels ».
Page 5.
AA Hydroxylés, soufrés, amides
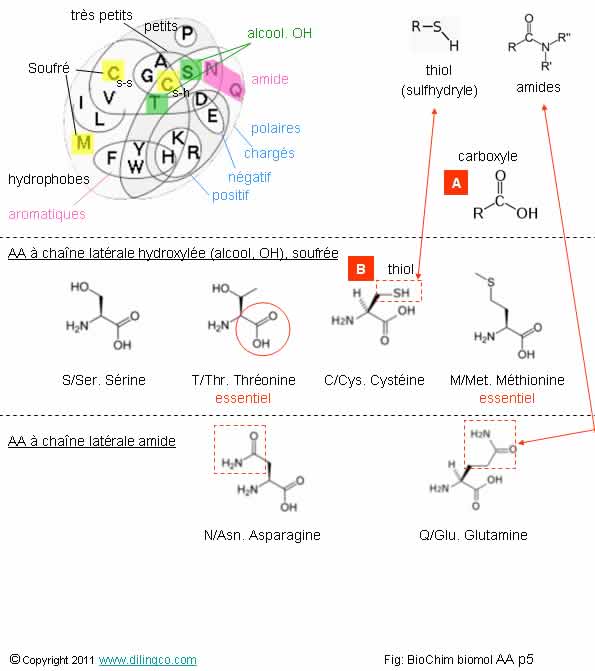
Sélectionner
l’affirmation exacte :
1- [A] :
groupement thiol (groupement sulfhydryle)
2-
[B] : groupement thiol (groupement sulfhydryle)
3- Lettre
«A » : Asparagine
4- Les
acides aminés soufrés et amides se différentient par la présence ou non d’un
groupe carboxyle
L’affirmation
2 est exacte.
Affirmation
3
Non.
A =
Alanine
(Asparagine
= N ou ASN)
Affirmation
4
Non.
Le groupe
carboxyle (–C(O)OH) est présent dans tous
les cas
(C’est même, avec la présence d’un groupe amine (-NH2),
une constante pour un acide aminé !).
Un groupe carboxyle est un groupe fonctionnel
composé d'un carbone, lié par une double liaison à un
oxygène et lié par une liaison simple à un groupe hydroxyle OH.
Rappels :
Les
acides aminés hydroxylés, soufrés, amides sont les suivants :
- S, SER, Sérine. Groupement hydroxyle (alcool).
Site de
phosphorylation dans beaucoup de protéines.
- T, THR, Thréonine. Groupement hydroxyle (alcool).
2 carbones asymétriques.
Site de phosphorylation dans beaucoup de protéines.
AA essentiel.
- C, Sys, Cystéine. Groupement sulfhydryle (Thiol).
Permet
des réactions d’oxydoréduction et de ponts
disulfures.
Métalloproptéine ;
impliquée dans la coordination des métaux.
- M, Met, Méthionine. Groupement thioéther.
Premier AA (Nt) dans la synthèse
protéique.
- N, ASN, Asparagine. Groupement amide.
- Q, GLN, Glutamine. Groupement amide.
AA le plus abondant dans le sang.
Page 6.
Chaîne latérale cyclisée aromatique
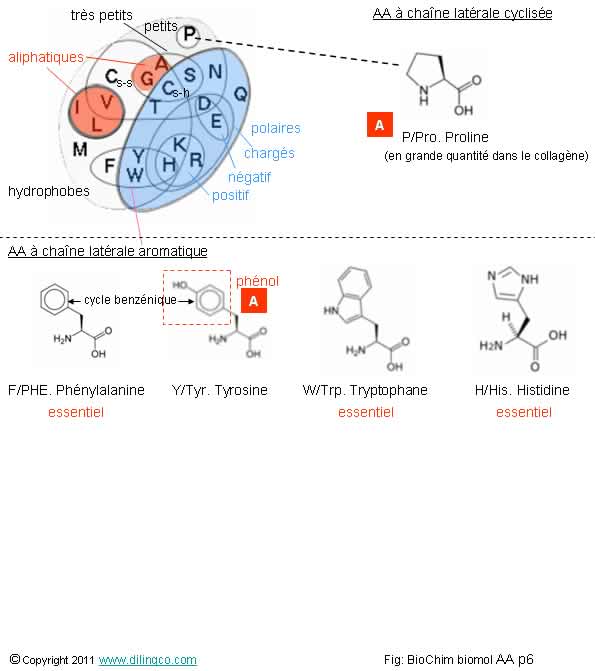
Sélectionner
l’affirmation exacte :
1- H,
histidine, est un AA à chaîne latérale
2-
[A] : Proline : cycle benzénique azoté
3- [B] :
Un phénol = groupe hydroxyle (OH) relié à un cycle benzénique
4- T est
le tryptophane, la plus grosse masse molaire des acides aminés
L’affirmation
3 est exacte.
Affirmation
4
Non.
Tryptophane =
T
Mais oui,
le Tryptophane a la plus grosse masse moléculaire des 20 acides aminés de base.
Rappels :
Acide
aminé à chaîne latérale cyclique :
P, PRO, Proline.
L’hydroxyproline
est très présente dans le collagène.
Acides
amines à chaîne latérales aromatiques :
- F, PHE, Phénylalanine. Chaîne latérale
aromatique (Phényl).
Très
hydrophobe.
AA essentiel.
- Y, TYR, Tyrosine. Chaîne latérale aromatique (Phénol).
Site de phosphorylation pour de
nombreuses protéines.
- W, TRP, Tryptohane. Chaîne latérale aromatique (Indol).
Précurseur de la sérotonine.
AA essentiel.
Page 7.
Chaîne latérale chargée +
ou -
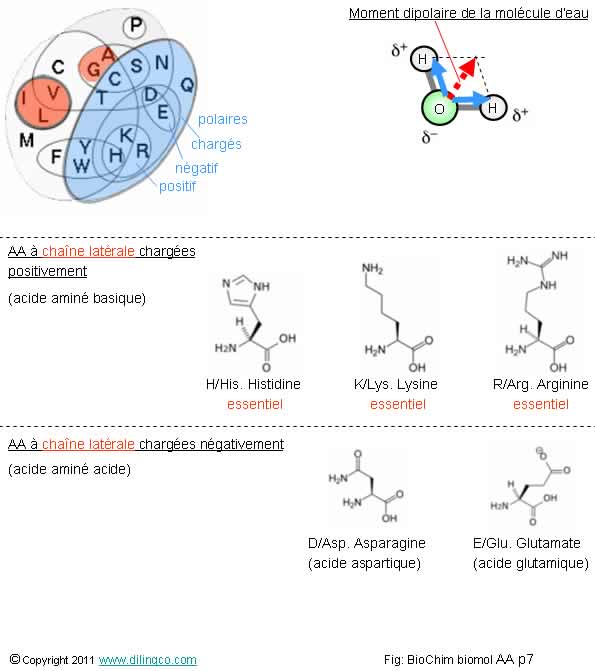
Sélectionner
les deux affirmations exactes :
1- Une
molécule diatomique ne peut pas être polaire
2- Un
acide faible en solution se dissocie en partie. En plus des molécules d’origines
non dissociées, il y a formation de cations (ions +) et d’anions (ions -)
3- Toutes
les solutions aqueuses sont des solutions ioniques
4- Les
composés moléculaires apolaires sont majoritairement solubles dans l’eau
5- Parmi
les acides aminés polaire (hydrophiles), certains sont acides, d’autres
basiques, d’autres neutres
6- Une « molécule
polaire » à la même signification qu’une « molécule chargée »
Les
affirmations 2 et 5 sont exactes.
Affirmation
1
Si.
Si les
deux atomes ont des charges électriques très différentes, le moment dipolaire
résultant est non nul et la molécule est chargée électriquement.
Affirmation
2
Oui.
Un acide
fort se dissocie entièrement en solution aqueuse.
Note :
Le sang est une solution aqueuse (le sang est constitué à 79%
d’eau).
Affirmation
3
Non.
De très
nombreux composés (exemples : sucre, éthanol), solubles dans l’eau ne
s’ionisent pas.
Électrolyte
fort :
Un
électrolyte fort se décompose entièrement en ions
dans une solution aqueuse.
Exemple :
HCL + H2O
à H3O+ (aq) + CL- (aq)
(aq) :
en solution aqueuse.
Électrolyte faible :
Un
électrolyte faible, en solution aqueuse, donne en partie des ions et reste
aussi en partie moléculaire (polaire ou apolaire).
Affirmation
4
Non.
Bien que
certains composés moléculaires apolaires (I2, N2, etc.) soient très légèrement
solubles.
Affirmations
5
Oui.
Les AA polaires sont généralement situés à la
surface des protéines, en contact avec le milieu
aqueux.
Les AA
apolaires sont, en général, à l’intérieur des protéines.
Affirmations
6
Non.
Une
« molécule polaire » à une charge résultante découlant du moment
dipolaire non nul (topologie ou présence de doublet non liant).
Exemple (voir figure) : molécule d’eau (polaire), qui a tendance à attirer
les AA polaires.
Une
« molécule chargée » réfère à une charge électrique nette due à un
surplus ou à un manque d’électron(s) : un ion.
Rappels :
AA à
chaînes latérales chargées positivement :
- H, HIS, Histidine
AA
essentiel.
- K, LYS, Lysine. Chaîne latérale aminée, ionisable ç pH acide.
AA essentiel.
- R, ARG, Arginine.
Impliquée dans le cycle de l’urée.
AA essentiel.
AA à
chaînes latérales chargées négativement :
- D, ASP, Acide aspartique.
- E, GLU, Acide glutamique.
Les
chaînes latérales
On peut
distinguer les chaînes latérales suivant leur polarité et leur charge
électrique à pH physiologique :
- chargées positivement à pH 7 (l'acide
aminé est dit basique),
- chargées négativement à pH 7 (l'acide
aminé est dit acide),
- non
chargées à pH 7 mais polaire
(Hydrophiles ;
la polarité les rend attirantes),
- non chargées à pH 7 mais apolaire
(hydrophobes).
Les
acides aminés polaire (hydrophiles), tendent à occuper la
surface des protéines.
Polaire/apolaire.
Moment dipolaire
Le moment dipolaire
électrique d’une molécule est en première approximation la somme vectorielle des moments de chaque liaison
atomique.
Par
convention des chimistes, un moment dipolaire est représenté de la charge – à
la charge +.
Deux
atomes :
L’intensité
du moment dipolaire d’une liaison atomique est liée à la différence de charges
des deux atomes liés (à leurs différences d’électronégativitées)
Molécules
tétraédriques :
Une
molécule tétraédrique avec des doublets d’électrons non liants, qui modifie
l’équilibre nette des charges, présente une somme vectorielle non nulle et
donne une molécule polaire.
Page 8.
AA basiques et acides
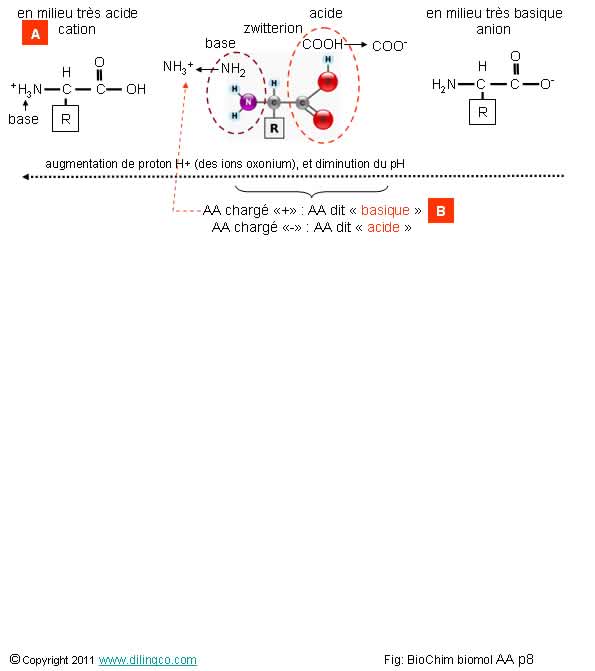
Sélectionner
l’affirmation exacte :
1-
[A] : En solution très acide (beaucoup de protons), l’acide aminé existe
essentiellement sous forme d’anion (charge nette de la molécule négative)
2- [B] : Un acide aminé chargé positivement est dit « acide »
3- Les acides aminés ne
sont pas des molécules amphotères
4- Le pH de passage d’une molécule d’un état acide à un état basique est appelé
son pH isoélectrique (pHi)
L’affirmation
4 est exacte.
Affirmations
1
Non.
En milieu
très acide, l’acide aminé existe essentiellement sous forme de cation
En milieu
très basique, l’acide aminé existe essentiellement sous forme de l’anion
(charge nette de la molécule négative)
Note :
L’acide
aminé est présent dans la solution sous ses différentes ionisations (anion, zwitterion, cation), mais à des pourcentages
variables suivant le pH.
Rappels :
Acide
/ base
L’acide
(souvent noté «AH»), est un élément
chimique qui se dissocie en solution aqueuse pour donner
une base (A-) et un proton H+
Un acide est un donneur de protons.
AH + H2O
<-> A- + H3O+
(L’acide
AH a donné son proton H pour former une base et l’ion oxonium)
Une base est un accepteur de protons.
A- + H3O+ <-> AH + H2O
(La base
A a accepté un proton H pour former un acide AH et de l’eau)
Note :
revoir le thème Chimie, couple acide base.
pH
d’une solution
pH : Potentiel Hydrogène
Le pH mesure l’acidité, ou la basicité (alcanité), d’une solution
aqueuse.
La concentration des ions oxonium/hydronium, H3O+,
détermine l’acidité d’une solution
aqueuse.
Augmentation
du pH (vers une solution alcaline ; basique ; pH :14) =
diminutions des protons H+ (H3O+) de la
solution.
Acide
aminé
- Les
acides aminés sont amphotères ; ils peuvent agir comme des acides ou des
bases suivant les conditions,
- Les AA
comportent au moins 2 proton H dissociables,
- La
charge des acides aminés varie en fonction du pH de la solution,
- chargé positivement à pH 7 (l'acide aminé est
dit basique),
- chargé négativement à pH 7 (l'acide
aminé est dit acide),
Comportement
acido-basique
A cause
des deux groupements :
- amide (-NH2 basique,
qui accepte un proton) et
- carboxylique (-COOH, acide,
qui donne un proton),
les
acides aminés sont amphotères ; ils peuvent agir comme des acides ou des
bases suivant le pH de la solution.
Solution
à pH très acide :
Le groupe
acide –COOH n’est pratiquement pas ionisé :
R-COOH + H2O <--- R-COO-
+ H3O+
(Équilibre déplacé vers la gauche)
Le groupe
amine -NH2est presque entièrement protoné :
R’-NH2 + H3O+
--- > R’-NH3+
+ H2O
(Équilibre
déplacé vers la droite)
La
molécule a une charge nette positive.
Solution
à pH neutre :
Le groupe
acide –COOH cède son proton et le groupe amine -NH2 le capte.
Un zwitterion est une forme neutre avec autant de
charges positives que de charges négatives.
La
molécule à une charge neutre.
Solution
à pH très basique :
Le groupe
amine -NH2 n’est pratiquement pas ionisé.
Le groupe
acide –COOH perd son proton
R-COOH
+ HO- ---- > R-COO-
+ H2O
(Équilibre
déplacé vers la droite)
La
molécule a une charge nette négative.
Page 9.
pKA & titrage
Sélectionner
les deux affirmations exactes :
1- Quand
le pH augmente, COOH et NH3+ ont tendance à céder leur H+ au milieu, en
commençant par le COOH, qui va devenir COO-
2-
L’environnement (exemple : le pH physiologique), n’a pas d’impact sur les
propriétés d’un acide aminé
3- L’état
d’ionisation des AA dépend des conditions de pH. Le pH physiologique (pH 7,4)
est à considérer pour déterminer l’état d’ionisation de l’AA qui prévaut
4- Le pKa
de la chaîne latérale n’a pas d’influence sur l’équilibre d’un acide aminé
Les
affirmations 1 et 3 sont exactes.
Affirmation
2 et 3
Si.
Exemple :
L'histidine dont le pHi est proche du pH physiologique, voit sa charge varier fortement
dans cette zone en fonction du pH de l’environnement : ceci est utilisé au
niveau du site actif de certaines enzymes.
Rappels :
Rappels Ka,
pKa, pH :
Voir
« Chimie, Réactions chimiques, Couple acide
base ».
pH,
potentiel Hydrogène
Le pH mesure l’acidité, ou la basicité (alcanité), d’une solution aqueuse.
pH = - Log [H3O+]
Constante
d’acidité Ka & pKa
Pour un
acide faible, et quelle que soit sa concentration, on peut définir une constante d’équilibre
qui caractérise la concentration base/acide
de la solution à l’équilibre.
Ka = [A-].[H3O+] / [HA]
Généralement
le pKa est utilisé, plutôt que le Ka, pour déterminer la force d’un acide.
pKa = -Log Ka
Note :
Ka fort =
acide < = > pKa faible = acide
Titrage
d’un acide aminé
La figure
représente la courbe de titrage d’un acide aminé :
- ne
présentant pas de groupement ionisable sur sa chaîne latérale,
- comme
un acide aminé est un ampholyte, deux pKA existent :
.
pKa 1 est lié à la fonction acide (COOH),
(2
= valeur moyenne du pKa de la fonction carboxyle)
.
pKa 2 est lié à la fonction base (NH3) de l’acide aminé,
(9
= valeur moyenne du pKa de la fonction amine)
- Les
zones où le pH varie peu (zones où le mélange acide et base conjuguée
stabilisent momentanément le pH), sont appelées
zones tampons
- Le pH
de passage d’une molécule d’un état acide à un état basique (et ne présentant
donc une charge électrique nette neutre) est appelé son pH isoélectrique (pHi)
Si la
chaîne latérale :
- n’est
pas ionisable : le pHi est la moyenne de pKa
1 et pka 2,
- ionisable :
le pHi est la moyenne des divers pKa.
Page 10.
Acide Aminés essentiels
Sélectionner
l’affirmation exacte :
1- Un
acide aminé est dit essentiel s’il ne peut pas être synthétisé par
l’organisme : Son apport est obligatoirement exogène
2- [A] :
La Tyrosine est l’acide aminé précurseur de la phénylalanine
3- Les
acides aminés ne sont pas présents dans les aliments contenant des protéines
4- W,
n’est pas un acide aminé essentiel
L’affirmation
1 est exacte.
Affirmation
2
Non.
Le précurseur
est l’élément chimique source de l’élément synthétisé.
La
phénylalanine est le précurseur de la tyrosine.
Affirmation
3
Si.
Mais dans
des proportions variables suivant l’aliment.
Affirmation
4
Si.
Les codes
à une lettre sont difficiles à retenir.
Ainsi :
-
D : acide aspartique
-
E : acide glutamique
-
K : lysine
-
N : asparagine
-
O : pyrrolysine
-
Q : glutamine
- …
et :
W : Trp,
Tryptophane (qui est bien un acide aminé essentiel).
Rappels :
8 Acides Aminés essentiels pour les humains.
Mnémotechnique
Pour
retenir les 8 acides aminés essentiels, plusieurs phrases existent.
Exemple :
Mets le dans la valise, il fait trop d’his-toires d’argent.
Met :
méthionine
Leu :
leucine
Val : valine
Lys :
lysine
Ile :
isoleucine
Phe :
phénylalanine
Trp :
tryptophane
His :
histidine (semi-essentiel)
Thr
: thréonine
Arg
: arginine (semi-essentiel)
Page
11.
Glc. Lipide. Protéine.
Nucléique
Sélectionnez
les trois affirmations exactes :
1- Les
acides gras sont les composants de base des glucides
2- Les
acides aminés sont les composants de base des lipides
3- Les
lipides sont des polymères de nucléotides
4- Les
acides aminés ont un groupement carboxyle et un groupement amine
5- Un
acide gras est un acide carboxylique à chaîne aromatique
6- Un
acide gras est un acide carboxylique à chaîne aliphatique
7- Un
glucide à un groupe carbonyle (aldéhyde ou cétone) et plusieurs groupements
hydroxyle (-OH)
Les
affirmations 4, 6 et 7 sont exactes.
Affirmation
1
Non.
Les acides gras sont les composants de base des lipides simples et complexes.
Affirmation
2
Non.
Les acides aminés sont les composants de base des protéines.
Affirmation
3
Non.
Les nucléotides sont les monomères des acides nucléiques.
(Ou :
Les acides nucléiques
sont des polymères de nucléotides)
Affirmation
6
Oui.
Un acide gras = acide carboxylique à chaîne aliphatique.
Aliphatique : composé carboné acyclique
ou cyclique, linéaire ou branché, saturé ou insaturé, à l'exclusion des composés aromatiques.
Rappels :
Biomolécules
Une
biomolécule est une molécule qui participe au métabolisme des organismes
vivants.
Principales
biomolécules :
- glucides,
- acides gras, lipides,
- acides aminés, protéines,
- acides nucléiques,
- l’eau.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Acides aminés et protéines

Sélectionner l’affirmation exacte :
1- Les acides aminés sont des acides organiques contenant un groupement amine
2- [A] : groupement carboxyle
3- [B] : groupement amine
4- [C] : structure spatiale d’une protéine : tous les AA aminés sont dans un même plant. Le nombre total d’acides aminés (à partir des 20 AA de base), est limité
L’affirmation 1 est exacte.
Affirmation 1
Oui.
Les acides organiques (ou acides carboxyliques), sont formés d’un groupement carboxylique (-COOH) et d’un radical quelconque.
Exemple :
Acide formique : H-COOH
Acide acétique : CH3–COOH (dans le vinaigre ; antiseptique et désinfectant)
Acide oxalique : CHOOH-CHOOH
Rappels :
Acides aminés
Les acides aminés (ou aminoacides), ont 2 groupes fonctionnels :
- un groupement carboxyle –COOH
- un groupement amine –NH2.
Protéines
Les protéines sont des polymères d’acides aminés.
Toutes les protéines de notre organisme sont construites à partir de 20 acides aminés de base.
Les acides aminés sont reliés entre eux par des liaisons peptidiques pour former une chaîne plus ou moins longue.
Le nombre et la chronologie des acides aminés d’une chaîne sont spécifiques à la protéine.
Note :
Un enzyme est une protéine avec un pouvoir catalytique.
Page 2.
L - acides alpha aminés

Sélectionner l’affirmation exacte :
1- [A] : les groupements amine, carboxyle, l’hydrogène, le radical (appelé « chaîne latérale »), sont connectés sur le carbone bêta de la chaîne aliphatique
2- [B] : la chaîne latérale aliphatique composée de 3 carbones
3- Les acides aminés les plus communs sont les acides alpha aminés ; Les acides alpha aminés les plus communs sont ceux de la série L
4- L’atome de carbone a un total de 4 électrons
L’affirmation 3 est exacte.
Affirmation 3
Oui.
Ces acides aminés sont les briques de base des protéines.
Exceptions :
- Les membranes bactériennes contiennent des D-alanine et des D-glutamine : acide aminés de la série D.
- Des acides aminés modifiés, qui découlent des acides aminés de base, sont dans le collagène.
Affirmation 4
Non.
Numéro atomique du carbone : 6C
- 2 électrons de cœur,
- 4 électrons de valence.
Rappels :
Aliphatique
Du grec aleiphar, -atos : graisse
(Terme initialement utilisés pour décrire les acides gras à chaîne linéaire))
Composé carboné acyclique ou cyclique, saturé ou insaturé, à l'exclusion des composés aromatiques,
Les carbones de la chaîne aliphatique sont numérotés par les lettres de l’alphabet Grec (le premier : carbone alpha).
Page 3.
Liste et codages des AA

Sélectionner l’affirmation exacte :
1- [A] : 21 des 22 acides aminés de base sont utilisés pour constituer les protéines (Un enzyme est une protéine avec un pouvoir catalytique)
2- [A] : liste des acides bêta aminés de la série D, briques de base des protéines
3- [B] : Un acide aminé ne peut pas être de plusieurs natures
4- L’alanine est l’acide aminé le plus souvent rencontré dans les protéines
L’affirmation 1 est exacte.
Affirmation 1
Oui.
Des acides aminés modifiés, qui découlent des acides aminés de base, peuvent se rencontrer.
Exemples :
- dans le collagène,
- lors des processus métaboliques.
(homo-cystéine, méthyl-histidine, etc.)
Affirmation 3
Si.
Les acides aminés apolaires, aliphatiques, hydrophobes, tendent à occuper le cœur des protéines.
Les acides aminés polaires (hydrophiles), tendent à occuper la surface des protéines.
Affirmation 4
Non.
La leucine est l’acide aminé qui a la plus forte occurrence dans les protéines.
Rappels :
AA : Acides Aminés
2 Codes
Pour faciliter la lecture des AA des composant les protéines, deux codes internationaux existent :
- un code à une lettre
(La première lettre du nom ou, en cas de redondance, une autre lettre)
Le code à une lettre est très utilisé pour le stockage des séquences protéiniques dans les banques de données.
- un code à trois lettres
(Généralement les trois premières lettres du nom de l’acide aminé).
Page 4.
G, A, I, L, V. Chaîne aliphatique

Sélectionner les deux affirmations exactes :
1- Les AA aliphatiques sont apolaires et hydrophobes.
2- La glycine a un radical/chaîne latérale composée d’un seul H, pas de carbone asymétrique et pas de molécule chirale/énantiomère
3- [A] : I = isomére
4- [B] : exemple de molécule polaire
5- Alanine : pas de chaîne latérale
6- [C] : C2H3O2
7- L’isoleucine et la leucine ne sont pas des molécules isomères
Les affirmations 1 et 2 sont exactes.
Affirmation 2
Oui.
Classée dans les AA aliphatique par défaut.
Énantiomères : molécules isomères images l’une de l’autre dans un miroir et non superposables.
Chirales : deux molécules énantiomères.
Isomères : molécules de même formule brute mais de formules semi-développées ou développées différentes.
Affirmation 3
Non.
I = Isoleucine suivant le codage une lettre des AA
(« Ile » suivant le codage à 3 lettres)
Affirmation 5
Si.
Un carbone ; une chaîne latérale méthyle.
Rappels :
AA essentiels
Les éléments chimiques essentiels ne peuvent pas être synthétisés par l’homme mais lui sont essentiels pour son métabolisme.
Les éléments chimiques essentiels proviennent donc de l’alimentation.
Certains acides gras, certains acides aminés, entrent dans ce cas, et sont donc dits « essentiels ».
Page 5.
AA Hydroxylés, soufrés, amides

Sélectionner l’affirmation exacte :
1- [A] : groupement thiol (groupement sulfhydryle)
2- [B] : groupement thiol (groupement sulfhydryle)
3- Lettre «A » : Asparagine
4- Les acides aminés soufrés et amides se différentient par la présence ou non d’un groupe carboxyle
L’affirmation 2 est exacte.
Affirmation 3
Non.
A = Alanine
(Asparagine = N ou ASN)
Affirmation 4
Non.
Le groupe carboxyle (–C(O)OH) est présent dans tous les cas
(C’est même, avec la présence d’un groupe amine (-NH2), une constante pour un acide aminé !).
Un groupe carboxyle est un groupe fonctionnel composé d'un carbone, lié par une double liaison à un oxygène et lié par une liaison simple à un groupe hydroxyle OH.
Rappels :
Les acides aminés hydroxylés, soufrés, amides sont les suivants :
- S, SER, Sérine. Groupement hydroxyle (alcool).
Site de phosphorylation dans beaucoup de protéines.
- T, THR, Thréonine. Groupement hydroxyle (alcool).
2 carbones asymétriques.
Site de phosphorylation dans beaucoup de protéines.
AA essentiel.
- C, Sys, Cystéine. Groupement sulfhydryle (Thiol).
Permet des réactions d’oxydoréduction et de ponts disulfures.
Métalloproptéine ; impliquée dans la coordination des métaux.
- M, Met, Méthionine. Groupement thioéther.
Premier AA (Nt) dans la synthèse
protéique.
- N, ASN, Asparagine. Groupement amide.
- Q, GLN, Glutamine. Groupement amide.
AA le plus abondant dans le sang.
Page 6.
Chaîne latérale cyclisée aromatique

Sélectionner l’affirmation exacte :
1- H, histidine, est un AA à chaîne latérale
2- [A] : Proline : cycle benzénique azoté
3- [B] : Un phénol = groupe hydroxyle (OH) relié à un cycle benzénique
4- T est le tryptophane, la plus grosse masse molaire des acides aminés
L’affirmation 3 est exacte.
Affirmation 4
Non.
Tryptophane = T
Mais oui, le Tryptophane a la plus grosse masse moléculaire des 20 acides aminés de base.
Rappels :
Acide aminé à chaîne latérale cyclique :
P, PRO, Proline.
L’hydroxyproline est très présente dans le collagène.
Acides amines à chaîne latérales aromatiques :
- F, PHE, Phénylalanine. Chaîne latérale aromatique (Phényl).
Très
hydrophobe.
AA essentiel.
- Y, TYR, Tyrosine. Chaîne latérale aromatique (Phénol).
Site de phosphorylation pour de
nombreuses protéines.
- W, TRP, Tryptohane. Chaîne latérale aromatique (Indol).
Précurseur de la sérotonine.
AA essentiel.
Page 7.
Chaîne latérale chargée + ou -

Sélectionner les deux affirmations exactes :
1- Une molécule diatomique ne peut pas être polaire
2- Un acide faible en solution se dissocie en partie. En plus des molécules d’origines non dissociées, il y a formation de cations (ions +) et d’anions (ions -)
3- Toutes les solutions aqueuses sont des solutions ioniques
4- Les composés moléculaires apolaires sont majoritairement solubles dans l’eau
5- Parmi les acides aminés polaire (hydrophiles), certains sont acides, d’autres basiques, d’autres neutres
6- Une « molécule polaire » à la même signification qu’une « molécule chargée »
Les affirmations 2 et 5 sont exactes.
Affirmation 1
Si.
Si les deux atomes ont des charges électriques très différentes, le moment dipolaire résultant est non nul et la molécule est chargée électriquement.
Affirmation 2
Oui.
Un acide fort se dissocie entièrement en solution aqueuse.
Note :
Le sang est une solution aqueuse (le sang est constitué à 79% d’eau).
Affirmation 3
Non.
De très nombreux composés (exemples : sucre, éthanol), solubles dans l’eau ne s’ionisent pas.
Électrolyte fort :
Un électrolyte fort se décompose entièrement en ions dans une solution aqueuse.
Exemple :
HCL + H2O à H3O+ (aq) + CL- (aq)
(aq) :
en solution aqueuse.
Électrolyte faible :
Un électrolyte faible, en solution aqueuse, donne en partie des ions et reste aussi en partie moléculaire (polaire ou apolaire).
Affirmation 4
Non.
Bien que certains composés moléculaires apolaires (I2, N2, etc.) soient très légèrement solubles.
Affirmations 5
Oui.
Les AA polaires sont généralement situés à la surface des protéines, en contact avec le milieu aqueux.
Les AA apolaires sont, en général, à l’intérieur des protéines.
Affirmations 6
Non.
Une
« molécule polaire » à une charge résultante découlant du moment
dipolaire non nul (topologie ou présence de doublet non liant).
Exemple (voir figure) : molécule d’eau (polaire), qui a tendance à attirer
les AA polaires.
Une « molécule chargée » réfère à une charge électrique nette due à un surplus ou à un manque d’électron(s) : un ion.
Rappels :
AA à chaînes latérales chargées positivement :
- H, HIS, Histidine
AA essentiel.
- K, LYS, Lysine. Chaîne latérale aminée, ionisable ç pH acide.
AA essentiel.
- R, ARG, Arginine.
Impliquée dans le cycle de l’urée.
AA essentiel.
AA à chaînes latérales chargées négativement :
- D, ASP, Acide aspartique.
- E, GLU, Acide glutamique.
Les chaînes latérales
On peut
distinguer les chaînes latérales suivant leur polarité et leur charge
électrique à pH physiologique :
- chargées positivement à pH 7 (l'acide
aminé est dit basique),
- chargées négativement à pH 7 (l'acide
aminé est dit acide),
- non chargées à pH 7 mais polaire
(Hydrophiles ;
la polarité les rend attirantes),
- non chargées à pH 7 mais apolaire
(hydrophobes).
Les acides aminés polaire (hydrophiles), tendent à occuper la surface des protéines.
Polaire/apolaire. Moment dipolaire
Le moment dipolaire électrique d’une molécule est en première approximation la somme vectorielle des moments de chaque liaison atomique.
Par convention des chimistes, un moment dipolaire est représenté de la charge – à la charge +.
Deux atomes :
L’intensité du moment dipolaire d’une liaison atomique est liée à la différence de charges des deux atomes liés (à leurs différences d’électronégativitées)
Molécules tétraédriques :
Une molécule tétraédrique avec des doublets d’électrons non liants, qui modifie l’équilibre nette des charges, présente une somme vectorielle non nulle et donne une molécule polaire.
Page 8.
AA basiques et acides

Sélectionner l’affirmation exacte :
1-
[A] : En solution très acide (beaucoup de protons), l’acide aminé existe
essentiellement sous forme d’anion (charge nette de la molécule négative)
2- [B] : Un acide aminé chargé positivement est dit « acide »
3- Les acides aminés ne
sont pas des molécules amphotères
4- Le pH de passage d’une molécule d’un état acide à un état basique est appelé
son pH isoélectrique (pHi)
L’affirmation 4 est exacte.
Affirmations 1
Non.
En milieu très acide, l’acide aminé existe essentiellement sous forme de cation
En milieu
très basique, l’acide aminé existe essentiellement sous forme de l’anion
(charge nette de la molécule négative)
Note :
L’acide aminé est présent dans la solution sous ses différentes ionisations (anion, zwitterion, cation), mais à des pourcentages variables suivant le pH.
Rappels :
Acide / base
L’acide (souvent noté «AH»), est un élément chimique qui se dissocie en solution aqueuse pour donner une base (A-) et un proton H+
Un acide est un donneur de protons.
AH + H2O <-> A- + H3O+
(L’acide AH a donné son proton H pour former une base et l’ion oxonium)
Une base est un accepteur de protons.
A- + H3O+ <-> AH + H2O
(La base A a accepté un proton H pour former un acide AH et de l’eau)
Note : revoir le thème Chimie, couple acide base.
pH
d’une solution
pH : Potentiel Hydrogène
Le pH mesure l’acidité, ou la basicité (alcanité), d’une solution aqueuse.
La concentration des ions oxonium/hydronium, H3O+, détermine l’acidité d’une solution aqueuse.
Augmentation du pH (vers une solution alcaline ; basique ; pH :14) = diminutions des protons H+ (H3O+) de la solution.
Acide aminé
- Les acides aminés sont amphotères ; ils peuvent agir comme des acides ou des bases suivant les conditions,
- Les AA comportent au moins 2 proton H dissociables,
- La charge des acides aminés varie en fonction du pH de la solution,
- chargé positivement à pH 7 (l'acide aminé est
dit basique),
- chargé négativement à pH 7 (l'acide
aminé est dit acide),
Comportement acido-basique
A cause des deux groupements :
- amide (-NH2 basique, qui accepte un proton) et
- carboxylique (-COOH, acide, qui donne un proton),
les acides aminés sont amphotères ; ils peuvent agir comme des acides ou des bases suivant le pH de la solution.
Solution à pH très acide :
Le groupe acide –COOH n’est pratiquement pas ionisé :
R-COOH + H2O <--- R-COO-
+ H3O+
(Équilibre déplacé vers la gauche)
Le groupe
amine -NH2est presque entièrement protoné :
R’-NH2 + H3O+
--- > R’-NH3+
+ H2O
(Équilibre déplacé vers la droite)
La molécule a une charge nette positive.
Solution à pH neutre :
Le groupe acide –COOH cède son proton et le groupe amine -NH2 le capte.
Un zwitterion est une forme neutre avec autant de charges positives que de charges négatives.
La molécule à une charge neutre.
Solution à pH très basique :
Le groupe amine -NH2 n’est pratiquement pas ionisé.
Le groupe acide –COOH perd son proton
R-COOH + HO- ---- > R-COO- + H2O
(Équilibre déplacé vers la droite)
La molécule a une charge nette négative.
Page 9.
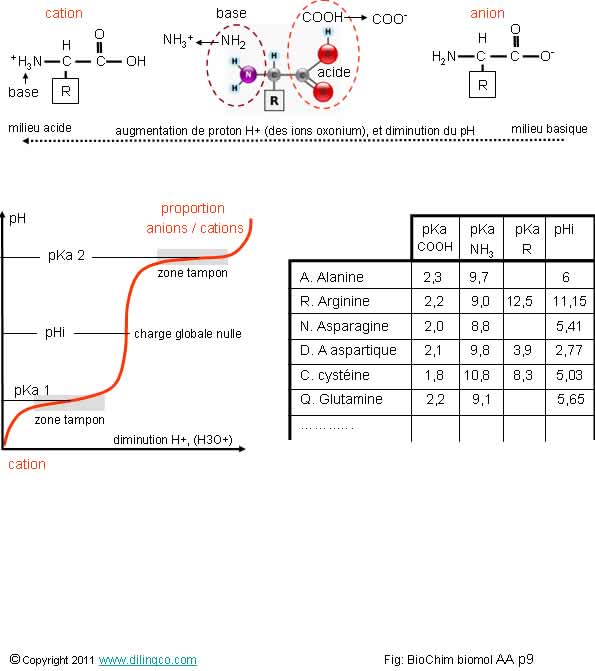
pKA & titrage

Sélectionner les deux affirmations exactes :
1- Quand le pH augmente, COOH et NH3+ ont tendance à céder leur H+ au milieu, en commençant par le COOH, qui va devenir COO-
2- L’environnement (exemple : le pH physiologique), n’a pas d’impact sur les propriétés d’un acide aminé
3- L’état d’ionisation des AA dépend des conditions de pH. Le pH physiologique (pH 7,4) est à considérer pour déterminer l’état d’ionisation de l’AA qui prévaut
4- Le pKa de la chaîne latérale n’a pas d’influence sur l’équilibre d’un acide aminé
Les affirmations 1 et 3 sont exactes.
Affirmation 2 et 3
Si.
Exemple :
L'histidine dont le pHi est proche du pH physiologique, voit sa charge varier fortement dans cette zone en fonction du pH de l’environnement : ceci est utilisé au niveau du site actif de certaines enzymes.
Rappels :
Rappels Ka, pKa, pH :
Voir « Chimie, Réactions chimiques, Couple acide base ».
pH, potentiel Hydrogène
Le pH mesure l’acidité, ou la basicité (alcanité), d’une solution aqueuse.
pH = - Log [H3O+]
Constante d’acidité Ka & pKa
Pour un acide faible, et quelle que soit sa concentration, on peut définir une constante d’équilibre qui caractérise la concentration base/acide de la solution à l’équilibre.
Ka = [A-].[H3O+] / [HA]
Généralement
le pKa est utilisé, plutôt que le Ka, pour déterminer la force d’un acide.
pKa = -Log Ka
Note :
Ka fort = acide < = > pKa faible = acide
Titrage d’un acide aminé
La figure représente la courbe de titrage d’un acide aminé :
- ne présentant pas de groupement ionisable sur sa chaîne latérale,
- comme un acide aminé est un ampholyte, deux pKA existent :
. pKa 1 est lié à la fonction acide (COOH),
(2 = valeur moyenne du pKa de la fonction carboxyle)
. pKa 2 est lié à la fonction base (NH3) de l’acide aminé,
(9 = valeur moyenne du pKa de la fonction amine)
- Les zones où le pH varie peu (zones où le mélange acide et base conjuguée stabilisent momentanément le pH), sont appelées zones tampons
- Le pH de passage d’une molécule d’un état acide à un état basique (et ne présentant donc une charge électrique nette neutre) est appelé son pH isoélectrique (pHi)
Si la chaîne latérale :
- n’est pas ionisable : le pHi est la moyenne de pKa 1 et pka 2,
- ionisable : le pHi est la moyenne des divers pKa.
Page 10.
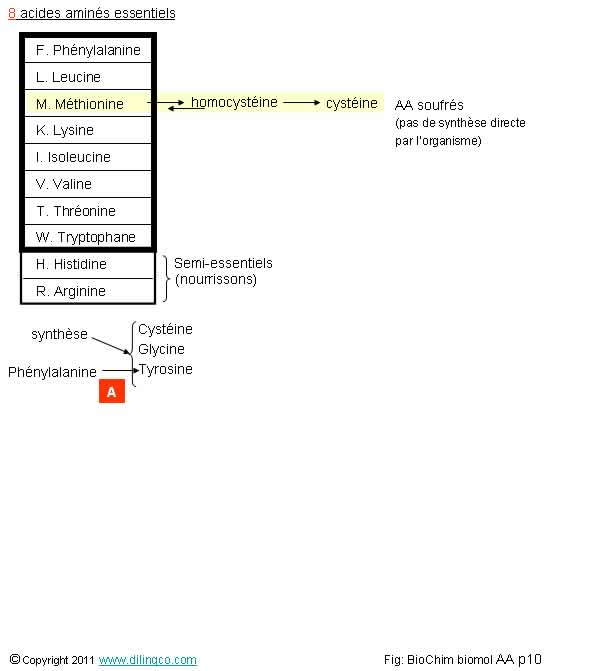
Acide Aminés essentiels

Sélectionner l’affirmation exacte :
1- Un acide aminé est dit essentiel s’il ne peut pas être synthétisé par l’organisme : Son apport est obligatoirement exogène
2- [A] : La Tyrosine est l’acide aminé précurseur de la phénylalanine
3- Les acides aminés ne sont pas présents dans les aliments contenant des protéines
4- W, n’est pas un acide aminé essentiel
L’affirmation 1 est exacte.
Affirmation 2
Non.
Le précurseur est l’élément chimique source de l’élément synthétisé.
La phénylalanine est le précurseur de la tyrosine.
Affirmation 3
Si.
Mais dans des proportions variables suivant l’aliment.
Affirmation 4
Si.
Les codes à une lettre sont difficiles à retenir.
Ainsi :
- D : acide aspartique
- E : acide glutamique
- K : lysine
- N : asparagine
- O : pyrrolysine
- Q : glutamine
- …
et :
W : Trp, Tryptophane (qui est bien un acide aminé essentiel).
Rappels :
8 Acides Aminés essentiels pour les humains.
Mnémotechnique
Pour retenir les 8 acides aminés essentiels, plusieurs phrases existent.
Exemple :
Mets le dans la valise, il fait trop d’his-toires d’argent.
Met : méthionine
Leu : leucine
Val : valine
Lys : lysine
Ile : isoleucine
Phe : phénylalanine
Trp : tryptophane
His : histidine (semi-essentiel)
Thr : thréonine
Arg : arginine (semi-essentiel)
Page 11.
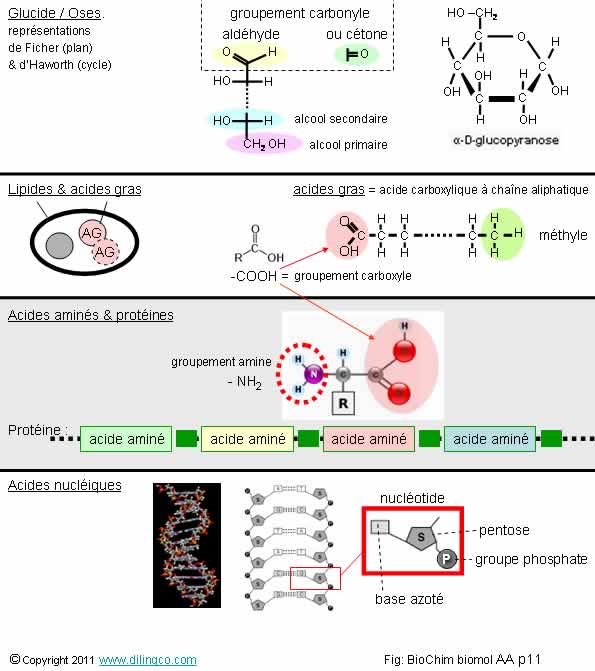
Glc. Lipide. Protéine. Nucléique

Sélectionnez les trois affirmations exactes :
1- Les acides gras sont les composants de base des glucides
2- Les acides aminés sont les composants de base des lipides
3- Les lipides sont des polymères de nucléotides
4- Les acides aminés ont un groupement carboxyle et un groupement amine
5- Un acide gras est un acide carboxylique à chaîne aromatique
6- Un acide gras est un acide carboxylique à chaîne aliphatique
7- Un glucide à un groupe carbonyle (aldéhyde ou cétone) et plusieurs groupements hydroxyle (-OH)
Les affirmations 4, 6 et 7 sont exactes.
Affirmation 1
Non.
Les acides gras sont les composants de base des lipides simples et complexes.
Affirmation 2
Non.
Les acides aminés sont les composants de base des protéines.
Affirmation 3
Non.
Les nucléotides sont les monomères des acides nucléiques.
(Ou : Les acides nucléiques sont des polymères de nucléotides)
Affirmation 6
Oui.
Un acide gras = acide carboxylique à chaîne aliphatique.
Aliphatique : composé carboné acyclique ou cyclique, linéaire ou branché, saturé ou insaturé, à l'exclusion des composés aromatiques.
Rappels :
Biomolécules
Une biomolécule est une molécule qui participe au métabolisme des organismes vivants.
Principales biomolécules :
- glucides,
- acides gras, lipides,
- acides aminés, protéines,
- acides nucléiques,
- l’eau.