Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Réaction enzymatique
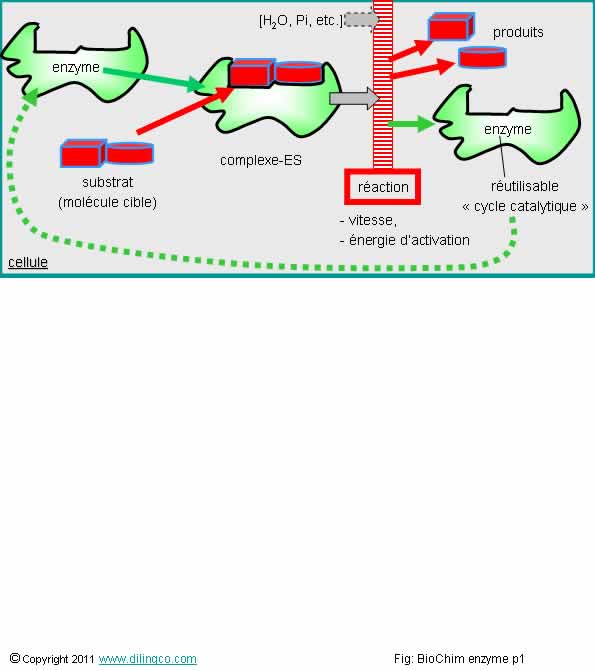
Sélectionner
l’affirmation exacte :
1- Un
enzyme est une macromolécule capable de catalyser une réaction biochimique
2- L’enzyme
se transforme ou se consume en cours de réaction et n’est plus réutilisable en
fin de réaction
3- Un
enzyme ne modifie pas la vitesse d’une réaction mais en modifie les conditions
d’équilibre
4- Le
regroupement d’une enzyme et d’une molécule cible s’appelle le
« substrat »
L’affirmation
1 est exacte
Affirmation
2
Non.
Une
enzyme est un catalyseur : en fin de
réaction, elle se retrouve telle qu’au départ (structure,
concentration, etc.). L’utilisation d’une enzyme est cyclique.
Affirmation
3
C’est
l’inverse.
La constante d’équilibre de la réaction n’est pas modifiée mais la présence de
l’enzyme dans le complexe enzyme/substrat diminue
l’énergie d’activation de la réaction et accroît
énormément la vitesse de réaction.
Affirmation
4
Non.
La molécule cible de l’enzyme s’appelle le substrat.
Le
regroupement substrat/enzyme est le complexe-E/S ;
Complexe
enzyme/substrat.
Rappels :
Une réaction enzymatique est
une réaction biologique catalysée par une enzyme.
Elle se
déroule en trois étapes :
- Fixation du substrat (cellule cible) à l’enzyme,
-
Réaction,
-
Libération du/des produits et de l’enzyme
L’enzyme libérée peut être réutilisé dans un nouveau cycle catalytique.
Page
2.
Couple enzyme/substrat
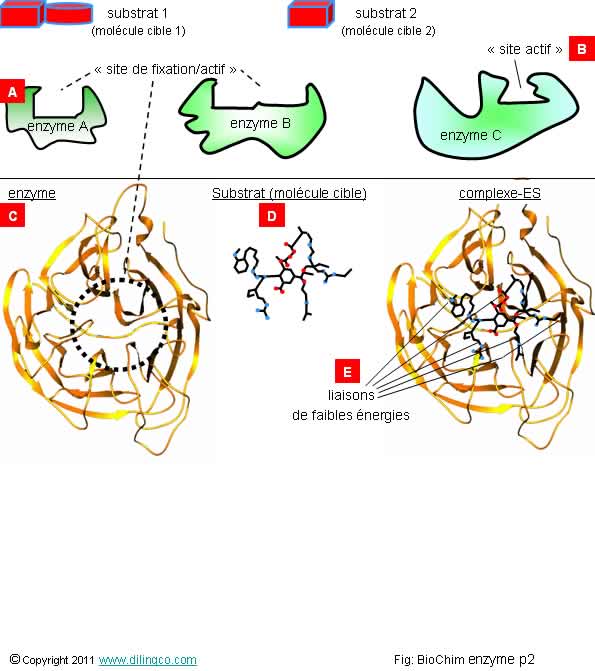
Sélectionner
les trois affirmations exactes :
1-
[A] : l’enzyme A est adapté au substrat 1
2-
[B] : site réactif
3-
[C] : Les enzymes sont des protéines constituées de milliers d’acides
aminés. Exception : Les
ribozymes
4-
[D] : substrat (molécule cible)
5- L’enzyme
intestinale qui sépare le saccharose en glucose et fructose ne peut pas aussi
séparer le lactose en glucose et galactose
6- [E] :
Les liaisons substrat/enzyme sont regroupées au même endroit de la chaîne
peptidique et se situent dans un même plan spatial
Les
affirmations 3, 4 et 5 sont exactes.
Affirmation
2
Non.
Site
actif.
Affirmation
3
Oui.
Il existe
plus de deux mille enzymes différentes
dans l’organisme.
Les ribozymes, contraction de acide RIBOnucléique et enZYMES
sont des enzymes qui ne sont pas constituées de protéines mais d'ARN.
Affirmation
5
Correct.
Les
multiples enzymes de l’organisme sont spécialisées par substrats, par réactions
biochimiques à obtenir.
Affirmation
6
Non.
Les
acides aminés de l’enzyme qui participent aux liaisons avec le substrat ne sont
pas regroupés au même endroit de la chaîne peptidique.
Ils ne se situent pas non plus dans un même plan spatial.
Rappels :
Il y a des milliers de substrats, d’enzymes et de réactions possibles dans les
cellules l’organisme.
Une enzyme donnée est spécialisée une réaction chimique bien
précise.
Site de
fixation
Le site de fixation désigne la zone du catalyseur
(de l’enzyme) dans laquelle le substrat va se
fixer en établissant des liaisons de faibles énergies.
La
conformité du site permet à l’enzyme de reconnaître, le ou les substrat(s) sur
lequel elle peut se fixer.
La
complémentarité substrat, site de fixation de l’enzyme peut se comparer à une
complémentarité de type clé-serrure.
Site
actif
Le
substrat peut parfois ajuster légèrement la conformité de l’enzyme pour
permettre la formation du complexe-es indispensable à la réaction enzymatique.
Le site
de connexion passe alors de son état fondamental en état « actif »
(D’où le nom généralisé
« site actif » de la zone d’attachement).
Liaisons
de faibles énergies
Exemples (voir
thème chimie/interactions moléculaires):
- Liaison
hydrogène,
- de Van der Waals,
- électrostatique,
- liaisons covalentes transitoires.
Page
3.
Chiralité et site de
fixation
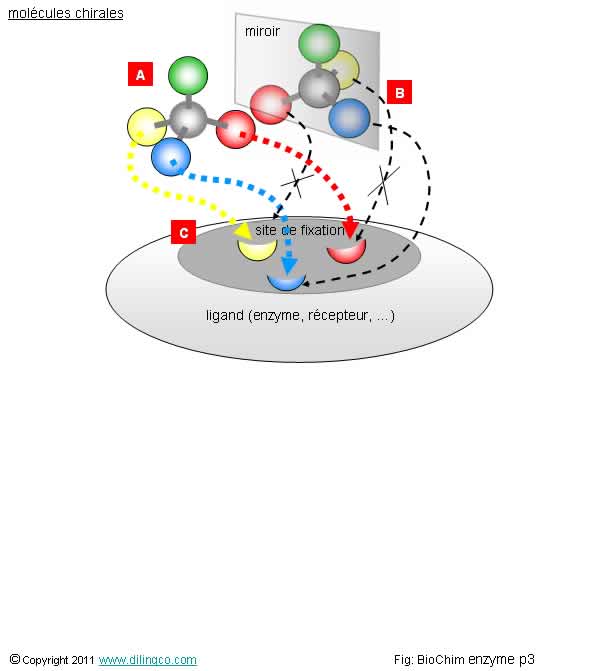
Sélectionner
les trois affirmations exactes :
1- Des
molécules isomères ont la même formule chimique mais des géométries spatiales
différentes
2- [A] et
[B] : Des molécules chirales sont superposables
3- [A] et
[B] : Des molécules chirales sont symétriques
4- La
configuration spatiale du substrat [A] permet sa fixation sur l’enzyme [C] et
la constitution d’un complexe ES
5- La
configuration spatiale du substrat [B] permet sa fixation sur l’enzyme [C] et
la constitution d’un complexe ES
Les
affirmations 1, 3 et 4 sont exactes.
Rappels :
Les
propriétés pharmacologiques et biologiques de deux énantiomères peuvent être
différentes et dépendre de leurs configurations spatiales.
Exemple :
Dans le
traitement de la maladie de Parkinson, seule la L-Dopa est active.
La D-Dopa
est même toxique pour les neurones !
Molécules
chirales/énantiomères
Deux
molécules chirales (aussi appelées énantiomères), ont la même formule chimique, sont symétriques dans un
miroir, et ne peuvent pas être superposées.
Page 4.
Classement des enzymes
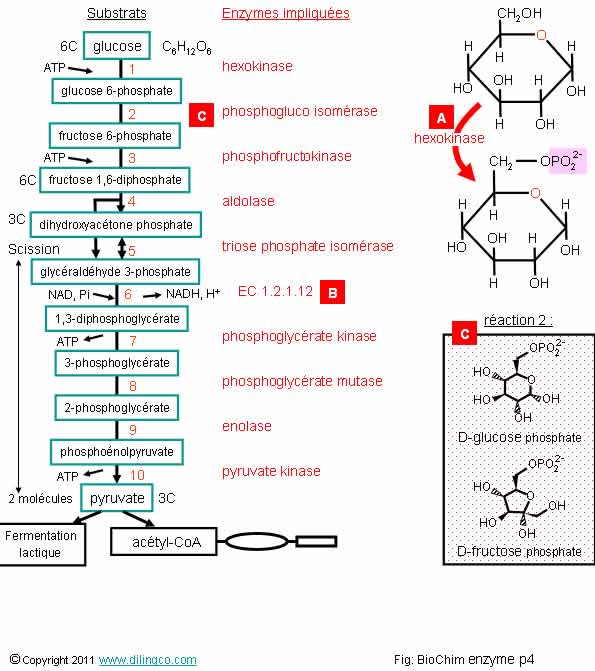
Sélectionner
les quatre affirmations exactes :
1- Nom d’enzyme :
un radical, rappelant le substrat ou le produit, suivi du suffixe –ase
2- Code international
Enzyme Commission : EC suivi de quatre nombres qui définissent les
caractéristiques de l’enzyme (le premier nombre est le numéro de classe)
3- [A] :
hexokinase. Réaction endothermique (besoin d’énergie : ATP) qui rajoute
un ion phosphate à la molécule. Le phosphate provient de l’ATP
4- [B] :
enzyme du groupe ligases (synthétases)
5- [B] :
ce n’est pas une oxydoréduction car il n’y a pas d’oxygène impliqué
6- [C] :
réaction 2 : le nom de l’enzyme impliquée indique une hydrolyse de la
molécule
7- [C] :
réaction 2 : le nom du substrat et de l’enzyme impliquée indiquent une
isomérisation du glucose en fructose
Les affirmations
1, 2, 3 et 7 sont exactes.
Affirmation
6
Si.
Une oxydoréduction (au sens large) n’implique pas forcément de l’oxygène.
Oxydation
(d’un atome ou une molécule) = perte
d’électron(s).
L’électron
perdu provient souvent de la perte d’un hydrogène
Hydrogène
= proton H+ plus électron e-
Perte d’un hydrogène = perte d’un électron = oxydation.
L’inverse :
une molécule qui gagne des hydrogènes se « réduit ».
Rappels :
Les
enzymes sont classées en 6 classes principales (EC1 à EC6), fonction
du type de réaction catalysée.
Les
classes sont elles mêmes divisées en plus ou moins de sous-classes.
E.C.1
oxydo-réductases,
catalysent
des réactions d'oxydoréduction en
transférant les ions H+ et des
électrons.
A- + B -> A + B-
Exemple :
EC
1.2.1.12 glycéraldéhyde-3-phosphate déshydrogénase
(Abrégée :
GAPDH)
E.C.2
transférases,
catalysent
des réactions de transfert d’un groupe fonctionnel
d’une molécule à une autre.
A-Grp +
B < = > A + B-Grp
Exemples :
Kinases,
EC 2.7, transfert d’un ion phosphate à
la molécule cible
Aspartate
aminotransférase, abrégé : AAT
E.C.3
hydrolases,
catalysent
des réactions d’hydrolyse de molécules
R-R’ + H2O < = > R-OH +R’-H
E.C.4 lyases,
catalysent
des réactions de rupture autrement que par l’hydrolyse ou l’oxydation pour former une autre liaison double ou un autre cycle.
Exemple :
Aldolase.
EC 4.1.2.13 scission du fructose-1,6-diphosphate
E.C.5 isomérases,
catalysent
des réactions d’isomérie de la
molécule.
Exemple :
Glucose-6-phosphate
isomérase, EC 5.3.1.9
E.C.6 ligases ou synthétases,
catalysent
des réactions de ligament de deux molécules par de
nouvelles liaisons covalentes.
Exemples
d’abrégés « DH »
G3PDH : glycéraldéhyde 3-phosphate déshydrogénase
MDH : malate déshydrogénase
Figure
La figure
liste les 10 réactions de la glycolyse avec les substrats et les enzymes
impliquées.
Page 5.
Catalyseur biologique
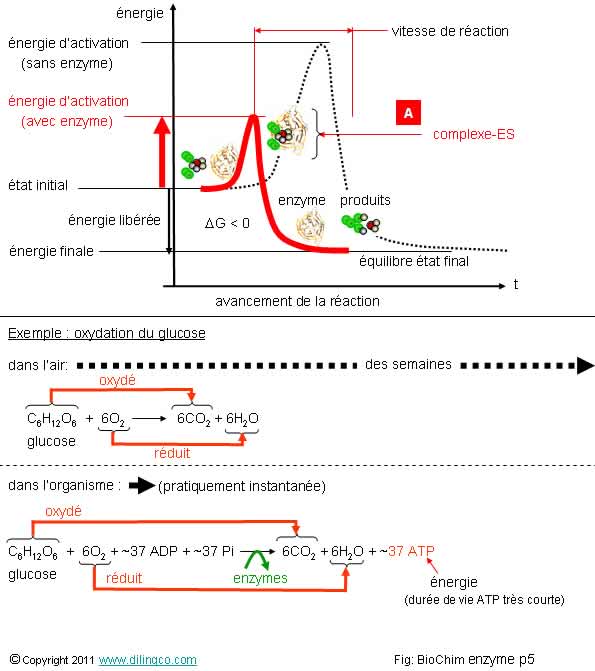
Sélectionner
les deux affirmations exactes :
1- [A] :
substrat
2- La
présence d’enzyme rend possible et accélère la réaction
3-
L’équilibre final est modifié par l’enzyme
4- Il y a
plus d’atomes au total en fin de réaction qu’en début de réaction
5- Les
enzymes, en abaissant l’énergie d’activation pour les réactifs concernés,
permettent de déclencher sélectivement des réactions
6- En
plus des enzymes, il faut aussi que les températures soient modifiées pour que
les réactions biochimiques se fassent
Les affirmations
2 et 5 sont exactes.
Affirmation
2
Oui.
L’accélération de
la réaction par une enzyme peut être très
importante, x 1010, par
exemple.
Affirmation
3
Non.
Le DG et la constante
d’équilibre ne sont pas modifiées.
Affirmation
4
Non.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
« Rien
ne se perd, rien ne se crée » => atomes
« Tout
se transforme » => molécules
(Voir
thème « Chimie / réactions chimiques / introduction »)
Affirmations
5 & 6
Il est à
souligner :
- S’il
n’y avait pas d’énergie d’activation, les réactions de catabolisme, exergoniques,
se feraient constamment : dégradation permanente des sucres et graisses
(un rêve ?!) et perte constante d’énergie,
- Les réactions biochimiques se déroulent à la température
corporelle ; la température ne peut pas être un critère pour
lancer les très nombreuses, et variées, réactions dont l’organisme a constamment
besoin.
Rappels :
Energie
d’activation
L’énergie d’activation DGA est l’énergie qui doit
être absorbée par les réactifs pour que les liens soient brisés et que la réaction se fasse.
Note :
Même pour une réaction exergonique (DG<0), il est nécessaire d’atteindre l’énergie d’activation pour que la
réaction se fasse.
Oxydation du glucose
Cet exemple montre la différence de vitesse entre :
- Une réaction non catalysée
(L’oxydation du glucose dans l’air ou dans l’eau)
- Une réaction catalysée par enzymes.
(Les étapes principales, glycolyse, cycle de l’acide citrique, chaîne de
respiration et chimiosmose, sont détaillées dans plusieurs chapitres)
Note :
Une
oxydoréduction (au sens large) n’implique pas forcément de l’oxygène.
Oxydation
(d’un atome ou une molécule) = perte
d’électron(s).
L’électron
perdu provient souvent de la perte d’un hydrogène
Hydrogène
= proton H+ plus un électron e-
Perte d’un hydrogène = perte d’un électron = oxydation.
L’inverse :
une molécule qui gagne des hydrogènes se « réduit ».
Page 6.
Contrôle des voies métaboliques
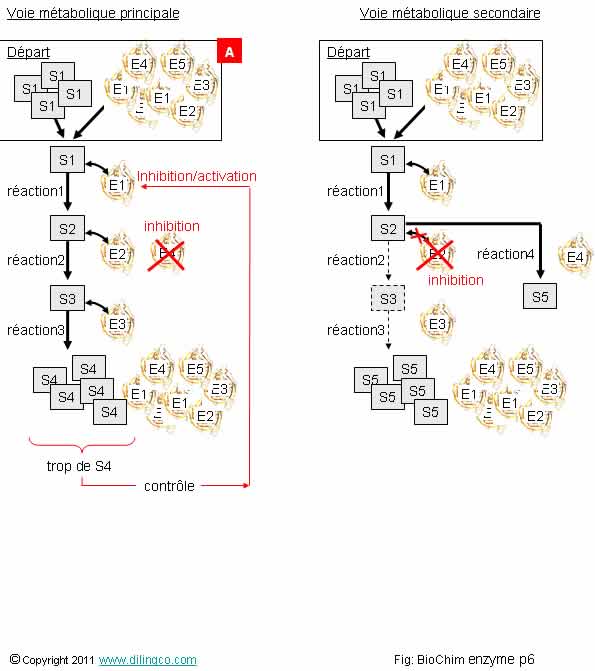
Sélectionner
l’affirmation fausse :
1- La
régulation de l’activité enzymatique se fait par action directe ou indirecte
sur les sites de fixation
2- L’action
sur les enzymes permet le contrôle ou la sélection des voies enzymatiques
3-
[A] : Il n’y a que des substrats S1 (et des substrats S4 si on considère
que le cycle catalytique a déjà eu lieu), et des enzymes E1
4-
[A] : Il n’y a que les substrats S1 (et des substrats S4 si on considère
que le cycle catalytique a déjà eu lieu), mais toutes les enzymes sont
présentes
L’affirmation
3 est fausse.
Page 7.
Inhibiteurs enzymatiques
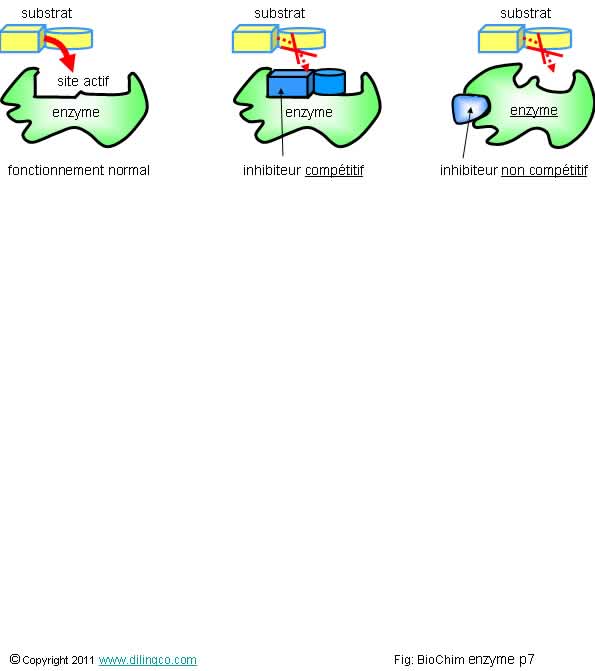
Sélectionner
l’affirmation fausse :
1- Un inhibiteur
compétitif ressemble à un enzyme (puisqu’il se fixe dans le même site), mais l’inhibiteur
n’entraîne pas de réaction enzymatique
2- Beaucoup
de médicaments ou de pesticides sont des inhibiteurs enzymatiques
3- Les
inhibiteurs enzymatiques sont tous irréversibles
L’affirmation
3 est fausse.
Affirmation
3
Non.
Les inhibiteurs irréversibles réagissent
chimiquement avec l’enzyme ; liaisons covalentes, modification des acides
aminés de la protéine enzymatique.
Les inhibiteurs réversibles n’établissent pas de
liaisons covalentes mais établissent des liaisons
de faibles énergies avec l’enzyme ou le complexe ES.
Rappels :
Les inhibiteurs enzymatiques sont des substances qui
inhibent l’action des enzymes en empêchant que le
substrat se fixe à l’enzyme.
L’accès
au site de fixation est bloqué :
- Il est déjà occupé par un inhibiteur
compétitif,
- Il a
été déformé et les caractéristiques
d’accueil ne sont plus acceptables par le substrat (inhibiteur
non compétitif).
Page 8.
Cofacteurs / Coenzymes / Apoenzymes

Sélectionner
les trois affirmations exactes :
1- [A] :
Une apoenzyme est une enzyme qui nécessite un cofacteur (ion métallique ou
coenzyme) pour être active
2- Une
coenzyme est un cofacteur organique
3- Une
coenzyme peut entraîner seule une réaction enzymatique avec un substrat
4- La
plupart des vitamines ne sont pas des coenzymes
5- L’ion
magnésium est un cofacteur
Les affirmations
1, 2 et 5 sont exactes.
Affirmation
4
Si.
La
plupart des vitamines sont des coenzymes ou sont
utilisées pour produire des coenzymes
Affirmation
5
Oui.
Le magnésium est le
cofacteur de très nombreuses enzymes.
Ces apoenzymes interviennent dans de nombreuse réactions biologiques :
phosphorylations oxydatives, la glycolyse, la transcription de l’ADN, la
synthèse protéique.
Page 9.
Complexe enzymatique
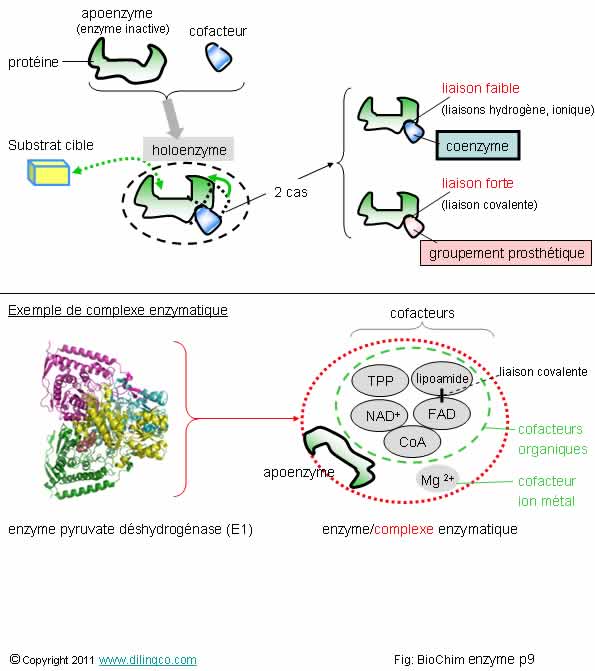
Sélectionner
les deux affirmations exactes :
1- Une
holoenzyme est une enzyme activée par un cofacteur(s)
2- Une
coenzyme est une forme d’enzyme
3- Un
complexe enzymatique n’a pas le comportement d’une enzyme
4- Un
cofacteur enzymatique peut être une protéine
5- Une enzyme est une
protéine (à laquelle peut être raccordé un cofacteur), qui a dans la cellule
une fonction de catalyseur
Les affirmations
1 et 5 sont exactes.
Affirmation
2
Non.
Une enzyme est une protéine intervenant en
catalyseur dans une réaction biochimique.
Une coenzyme est un cofacteur, une molécule
organique (mais pas une protéine), ou un ion métal, faiblement liée à une
enzyme et qui rend l’enzyme active.
Affirmation
3
Si.
Un
complexe enzymatique est une « enzyme complexe » dans la mesure où plusieurs
cofacteurs s’allient à l’apoenzyme de départ.
Le
complexe enzymatique se comporte comme une enzyme, il est le catalyseur d’une
réaction biochimique.
Affirmation
4
Non.
- Cofacteurs
ions métalliques,
-
Cofacteurs organiques (molécules non protéiques)
Page 10.
Vitesses de réaction
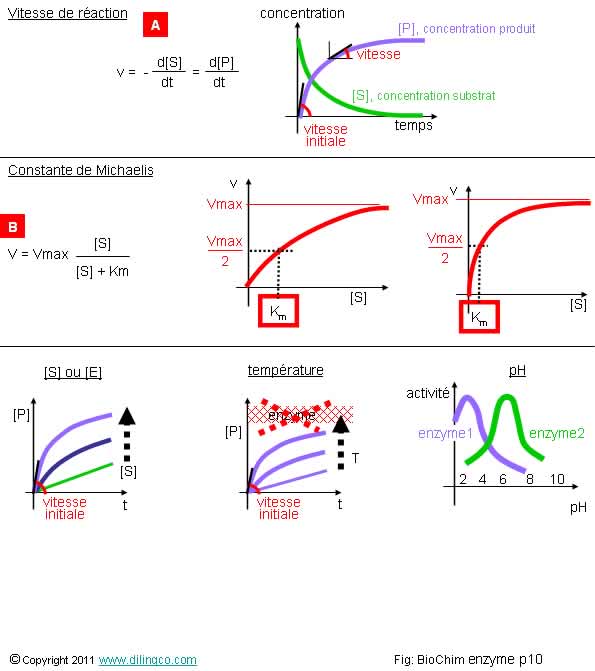
Sélectionner
les quatre affirmations exactes :
1- La
variation d’enthalpie libre définie la vitesse d’une réaction enzymatique
2- La
vitesse de réaction = variation des concentrations par unité de temps. (Moles/seconde)
3- [A] :
La vitesse de réaction des produits atteint un maximum avec le temps
4- [B] :
Si la concentration en substrats [S] est >> à Km, la vitesse de la
réaction est maximale
5- [B] :
Km est inversement proportionnelle à l’affinité du substrat pour son enzyme
(Plus Km est petit, moins il faut de substrat pour avoir v=vmax/2)
6- Km,
constante de Michaelis. Concentration en substrat pour avoir vitesse de
réaction = 1/2 vitesse de réaction maximale
7- La
température ou le pH ne modifient pas la vitesse des réactions enzymatiques
Les
affirmations 2, 4, 5 et 6 sont exactes.
Affirmation
1
Non.
La
variation d’enthalpie libre DG ne donne pas d’indication sur la
vitesse d’une réaction.
DG < 0 : sens de réaction : réactifs =>
produits
DG > 0 : sens de réaction : produits =>
réactifs
Affirmation
2
Oui.
[B] :
Il est à noter que les vitesses de réactions maximales (Vmax) n’ont pas les
mêmes valeurs d’une réaction enzymatique à l’autre
Affirmation
3
Non.
[A] :
Les vitesses correspondent à la pente des tangentes aux courbes (et non aux
ordonnées !).
La vitesse (la pente) est maximum en début de réaction.
La
vitesse de réaction devient nulle avec le temps (il ne reste plus de substrats
à convertir en produits)
Affirmation
5
Oui.
[B] :
[S] << Km -> V = Vmax [S]/Km
[S] = Km
-> V = Vmax /2
[S] >> Km -> V = Vmax
La
deuxième courbe représente une affinité plus grande du substrat pour son
enzyme. (Km à une valeur plus petite : Il faut moins de substrat pour
atteindre une vitesse ½ de Vmax).
Il est à
noter que les vitesses de réactions maximales (Vmax) n’ont pas les mêmes
valeurs d’une réaction enzymatique à l’autre.
Affirmation
6
Oui.
[S] = Km
v=Vmax/2
Affirmation
7
Si.
Rappels :
[A] :
Vitesse de réaction =
- variation de concentration produit / unité de
temps
Ou
(l’inverse) :
-
variation de concentration substrat / unité de temps
Influences
Selon la
réaction enzymatique, des facteurs peuvent influencer la vitesse de la
réaction.
Exemples :
- Les concentrations en enzyme et en substrat,
(Voir
figure)
- La température,
En
général, les conditions optimales avoisinent 37°/38°.
Au dessus
de 60°, l’enzyme est dénaturée par rupture des liaisons hydrogènes de la
protéine.
En
dessous de 5°, l’enzyme perd de sa réactivité par perte d’agitation
moléculaire.
Il existe
des enzymes thermostables.
Exemple :
ADN polymérase.
- Le pH,
La
réactivité enzymatique dépend de la réaction considérée :
Exemples :
- pH
acide environ 2 pour la pepsine,
- pH
basique 8 pour la trypsine. Etc.
Pour des
pH extrêmes, 13-14 : l’enzyme est dénaturée.
- Les inhibiteurs et cofacteurs (ions métalliques, coenzynes).
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Réaction enzymatique

Sélectionner l’affirmation exacte :
1- Un enzyme est une macromolécule capable de catalyser une réaction biochimique
2- L’enzyme se transforme ou se consume en cours de réaction et n’est plus réutilisable en fin de réaction
3- Un enzyme ne modifie pas la vitesse d’une réaction mais en modifie les conditions d’équilibre
4- Le regroupement d’une enzyme et d’une molécule cible s’appelle le « substrat »
L’affirmation 1 est exacte
Affirmation 2
Non.
Une enzyme est un catalyseur : en fin de réaction, elle se retrouve telle qu’au départ (structure, concentration, etc.). L’utilisation d’une enzyme est cyclique.
Affirmation 3
C’est
l’inverse.
La constante d’équilibre de la réaction n’est pas modifiée mais la présence de
l’enzyme dans le complexe enzyme/substrat diminue
l’énergie d’activation de la réaction et accroît
énormément la vitesse de réaction.
Affirmation 4
Non.
La molécule cible de l’enzyme s’appelle le substrat.
Le regroupement substrat/enzyme est le complexe-E/S ;
Complexe enzyme/substrat.
Rappels :
Une réaction enzymatique est une réaction biologique catalysée par une enzyme.
Elle se déroule en trois étapes :
- Fixation du substrat (cellule cible) à l’enzyme,
- Réaction,
-
Libération du/des produits et de l’enzyme
L’enzyme libérée peut être réutilisé dans un nouveau cycle catalytique.
Page 2.
Couple enzyme/substrat

Sélectionner les trois affirmations exactes :
1- [A] : l’enzyme A est adapté au substrat 1
2- [B] : site réactif
3- [C] : Les enzymes sont des protéines constituées de milliers d’acides aminés. Exception : Les ribozymes
4- [D] : substrat (molécule cible)
5- L’enzyme intestinale qui sépare le saccharose en glucose et fructose ne peut pas aussi séparer le lactose en glucose et galactose
6- [E] : Les liaisons substrat/enzyme sont regroupées au même endroit de la chaîne peptidique et se situent dans un même plan spatial
Les affirmations 3, 4 et 5 sont exactes.
Affirmation 2
Non.
Site actif.
Affirmation 3
Oui.
Il existe plus de deux mille enzymes différentes dans l’organisme.
Les ribozymes, contraction de acide RIBOnucléique et enZYMES sont des enzymes qui ne sont pas constituées de protéines mais d'ARN.
Affirmation 5
Correct.
Les multiples enzymes de l’organisme sont spécialisées par substrats, par réactions biochimiques à obtenir.
Affirmation 6
Non.
Les
acides aminés de l’enzyme qui participent aux liaisons avec le substrat ne sont
pas regroupés au même endroit de la chaîne peptidique.
Ils ne se situent pas non plus dans un même plan spatial.
Rappels :
Il y a des milliers de substrats, d’enzymes et de réactions possibles dans les cellules l’organisme.
Une enzyme donnée est spécialisée une réaction chimique bien précise.
Site de fixation
Le site de fixation désigne la zone du catalyseur (de l’enzyme) dans laquelle le substrat va se fixer en établissant des liaisons de faibles énergies.
La conformité du site permet à l’enzyme de reconnaître, le ou les substrat(s) sur lequel elle peut se fixer.
La complémentarité substrat, site de fixation de l’enzyme peut se comparer à une complémentarité de type clé-serrure.
Site actif
Le substrat peut parfois ajuster légèrement la conformité de l’enzyme pour permettre la formation du complexe-es indispensable à la réaction enzymatique.
Le site de connexion passe alors de son état fondamental en état « actif »
(D’où le nom généralisé « site actif » de la zone d’attachement).
Liaisons de faibles énergies
Exemples (voir thème chimie/interactions moléculaires):
- Liaison hydrogène,
- de Van der Waals,
- électrostatique,
- liaisons covalentes transitoires.
Page 3.
Chiralité et site de fixation

Sélectionner les trois affirmations exactes :
1- Des molécules isomères ont la même formule chimique mais des géométries spatiales différentes
2- [A] et [B] : Des molécules chirales sont superposables
3- [A] et [B] : Des molécules chirales sont symétriques
4- La configuration spatiale du substrat [A] permet sa fixation sur l’enzyme [C] et la constitution d’un complexe ES
5- La configuration spatiale du substrat [B] permet sa fixation sur l’enzyme [C] et la constitution d’un complexe ES
Les affirmations 1, 3 et 4 sont exactes.
Rappels :
Les propriétés pharmacologiques et biologiques de deux énantiomères peuvent être différentes et dépendre de leurs configurations spatiales.
Exemple :
Dans le traitement de la maladie de Parkinson, seule la L-Dopa est active.
La D-Dopa est même toxique pour les neurones !
Molécules chirales/énantiomères
Deux molécules chirales (aussi appelées énantiomères), ont la même formule chimique, sont symétriques dans un miroir, et ne peuvent pas être superposées.
Page 4.
Classement des enzymes

Sélectionner les quatre affirmations exactes :
1- Nom d’enzyme : un radical, rappelant le substrat ou le produit, suivi du suffixe –ase
2- Code international Enzyme Commission : EC suivi de quatre nombres qui définissent les caractéristiques de l’enzyme (le premier nombre est le numéro de classe)
3- [A] : hexokinase. Réaction endothermique (besoin d’énergie : ATP) qui rajoute un ion phosphate à la molécule. Le phosphate provient de l’ATP
4- [B] : enzyme du groupe ligases (synthétases)
5- [B] : ce n’est pas une oxydoréduction car il n’y a pas d’oxygène impliqué
6- [C] : réaction 2 : le nom de l’enzyme impliquée indique une hydrolyse de la molécule
7- [C] : réaction 2 : le nom du substrat et de l’enzyme impliquée indiquent une isomérisation du glucose en fructose
Les affirmations 1, 2, 3 et 7 sont exactes.
Affirmation 6
Si.
Une oxydoréduction (au sens large) n’implique pas forcément de l’oxygène.
Oxydation (d’un atome ou une molécule) = perte d’électron(s).
L’électron perdu provient souvent de la perte d’un hydrogène
Hydrogène = proton H+ plus électron e-
Perte d’un hydrogène = perte d’un électron = oxydation.
L’inverse : une molécule qui gagne des hydrogènes se « réduit ».
Rappels :
Les enzymes sont classées en 6 classes principales (EC1 à EC6), fonction du type de réaction catalysée.
Les classes sont elles mêmes divisées en plus ou moins de sous-classes.
E.C.1 oxydo-réductases,
catalysent des réactions d'oxydoréduction en transférant les ions H+ et des électrons.
A- + B -> A + B-
Exemple :
EC 1.2.1.12 glycéraldéhyde-3-phosphate déshydrogénase
(Abrégée : GAPDH)
E.C.2 transférases,
catalysent des réactions de transfert d’un groupe fonctionnel d’une molécule à une autre.
A-Grp + B < = > A + B-Grp
Exemples :
Kinases, EC 2.7, transfert d’un ion phosphate à la molécule cible
Aspartate aminotransférase, abrégé : AAT
E.C.3 hydrolases,
catalysent des réactions d’hydrolyse de molécules
R-R’ + H2O < = > R-OH +R’-H
E.C.4 lyases,
catalysent des réactions de rupture autrement que par l’hydrolyse ou l’oxydation pour former une autre liaison double ou un autre cycle.
Exemple :
Aldolase.
EC 4.1.2.13 scission du fructose-1,6-diphosphate
E.C.5 isomérases,
catalysent des réactions d’isomérie de la molécule.
Exemple :
Glucose-6-phosphate
isomérase, EC 5.3.1.9
E.C.6 ligases ou synthétases,
catalysent des réactions de ligament de deux molécules par de nouvelles liaisons covalentes.
Exemples d’abrégés « DH »
G3PDH : glycéraldéhyde 3-phosphate déshydrogénase
MDH : malate déshydrogénase
Figure
La figure liste les 10 réactions de la glycolyse avec les substrats et les enzymes impliquées.
Page 5.
Catalyseur biologique

Sélectionner les deux affirmations exactes :
1- [A] : substrat
2- La présence d’enzyme rend possible et accélère la réaction
3- L’équilibre final est modifié par l’enzyme
4- Il y a plus d’atomes au total en fin de réaction qu’en début de réaction
5- Les enzymes, en abaissant l’énergie d’activation pour les réactifs concernés, permettent de déclencher sélectivement des réactions
6- En plus des enzymes, il faut aussi que les températures soient modifiées pour que les réactions biochimiques se fassent
Les affirmations 2 et 5 sont exactes.
Affirmation 2
Oui.
L’accélération de la réaction par une enzyme peut être très importante, x 1010, par exemple.
Affirmation 3
Non.
Le DG et la constante
d’équilibre ne sont pas modifiées.
Affirmation 4
Non.
Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
« Rien ne se perd, rien ne se crée » => atomes
« Tout se transforme » => molécules
(Voir thème « Chimie / réactions chimiques / introduction »)
Affirmations 5 & 6
Il est à souligner :
- S’il n’y avait pas d’énergie d’activation, les réactions de catabolisme, exergoniques, se feraient constamment : dégradation permanente des sucres et graisses (un rêve ?!) et perte constante d’énergie,
- Les réactions biochimiques se déroulent à la température corporelle ; la température ne peut pas être un critère pour lancer les très nombreuses, et variées, réactions dont l’organisme a constamment besoin.
Rappels :
Energie d’activation
L’énergie d’activation DGA est l’énergie qui doit être absorbée par les réactifs pour que les liens soient brisés et que la réaction se fasse.
Note :
Même pour une réaction exergonique (DG<0), il est nécessaire d’atteindre l’énergie d’activation pour que la réaction se fasse.
Oxydation du glucose
Cet exemple montre la différence de vitesse entre :
- Une réaction non catalysée
(L’oxydation du glucose dans l’air ou dans l’eau)
- Une réaction catalysée par enzymes.
(Les étapes principales, glycolyse, cycle de l’acide citrique, chaîne de
respiration et chimiosmose, sont détaillées dans plusieurs chapitres)
Note :
Une oxydoréduction (au sens large) n’implique pas forcément de l’oxygène.
Oxydation (d’un atome ou une molécule) = perte d’électron(s).
L’électron perdu provient souvent de la perte d’un hydrogène
Hydrogène = proton H+ plus un électron e-
Perte d’un hydrogène = perte d’un électron = oxydation.
L’inverse : une molécule qui gagne des hydrogènes se « réduit ».
Page 6.
Contrôle des voies métaboliques

Sélectionner l’affirmation fausse :
1- La régulation de l’activité enzymatique se fait par action directe ou indirecte sur les sites de fixation
2- L’action sur les enzymes permet le contrôle ou la sélection des voies enzymatiques
3- [A] : Il n’y a que des substrats S1 (et des substrats S4 si on considère que le cycle catalytique a déjà eu lieu), et des enzymes E1
4- [A] : Il n’y a que les substrats S1 (et des substrats S4 si on considère que le cycle catalytique a déjà eu lieu), mais toutes les enzymes sont présentes
L’affirmation 3 est fausse.
Page 7.
Inhibiteurs enzymatiques

Sélectionner l’affirmation fausse :
1- Un inhibiteur compétitif ressemble à un enzyme (puisqu’il se fixe dans le même site), mais l’inhibiteur n’entraîne pas de réaction enzymatique
2- Beaucoup de médicaments ou de pesticides sont des inhibiteurs enzymatiques
3- Les inhibiteurs enzymatiques sont tous irréversibles
L’affirmation 3 est fausse.
Affirmation 3
Non.
Les inhibiteurs irréversibles réagissent chimiquement avec l’enzyme ; liaisons covalentes, modification des acides aminés de la protéine enzymatique.
Les inhibiteurs réversibles n’établissent pas de liaisons covalentes mais établissent des liaisons de faibles énergies avec l’enzyme ou le complexe ES.
Rappels :
Les inhibiteurs enzymatiques sont des substances qui inhibent l’action des enzymes en empêchant que le substrat se fixe à l’enzyme.
L’accès au site de fixation est bloqué :
- Il est déjà occupé par un inhibiteur compétitif,
- Il a été déformé et les caractéristiques d’accueil ne sont plus acceptables par le substrat (inhibiteur non compétitif).
Page 8.
Cofacteurs / Coenzymes / Apoenzymes

Sélectionner les trois affirmations exactes :
1- [A] : Une apoenzyme est une enzyme qui nécessite un cofacteur (ion métallique ou coenzyme) pour être active
2- Une coenzyme est un cofacteur organique
3- Une coenzyme peut entraîner seule une réaction enzymatique avec un substrat
4- La plupart des vitamines ne sont pas des coenzymes
5- L’ion magnésium est un cofacteur
Les affirmations 1, 2 et 5 sont exactes.
Affirmation 4
Si.
La plupart des vitamines sont des coenzymes ou sont utilisées pour produire des coenzymes
Affirmation 5
Oui.
Le magnésium est le
cofacteur de très nombreuses enzymes.
Ces apoenzymes interviennent dans de nombreuse réactions biologiques :
phosphorylations oxydatives, la glycolyse, la transcription de l’ADN, la
synthèse protéique.
Page 9.
Complexe enzymatique

Sélectionner les deux affirmations exactes :
1- Une holoenzyme est une enzyme activée par un cofacteur(s)
2- Une coenzyme est une forme d’enzyme
3- Un complexe enzymatique n’a pas le comportement d’une enzyme
4- Un cofacteur enzymatique peut être une protéine
5- Une enzyme est une protéine (à laquelle peut être raccordé un cofacteur), qui a dans la cellule une fonction de catalyseur
Les affirmations 1 et 5 sont exactes.
Affirmation 2
Non.
Une enzyme est une protéine intervenant en catalyseur dans une réaction biochimique.
Une coenzyme est un cofacteur, une molécule organique (mais pas une protéine), ou un ion métal, faiblement liée à une enzyme et qui rend l’enzyme active.
Affirmation 3
Si.
Un complexe enzymatique est une « enzyme complexe » dans la mesure où plusieurs cofacteurs s’allient à l’apoenzyme de départ.
Le complexe enzymatique se comporte comme une enzyme, il est le catalyseur d’une réaction biochimique.
Affirmation 4
Non.
- Cofacteurs ions métalliques,
- Cofacteurs organiques (molécules non protéiques)
Page 10.
Vitesses de réaction

Sélectionner les quatre affirmations exactes :
1- La variation d’enthalpie libre définie la vitesse d’une réaction enzymatique
2- La vitesse de réaction = variation des concentrations par unité de temps. (Moles/seconde)
3- [A] : La vitesse de réaction des produits atteint un maximum avec le temps
4- [B] : Si la concentration en substrats [S] est >> à Km, la vitesse de la réaction est maximale
5- [B] : Km est inversement proportionnelle à l’affinité du substrat pour son enzyme (Plus Km est petit, moins il faut de substrat pour avoir v=vmax/2)
6- Km, constante de Michaelis. Concentration en substrat pour avoir vitesse de réaction = 1/2 vitesse de réaction maximale
7- La température ou le pH ne modifient pas la vitesse des réactions enzymatiques
Les affirmations 2, 4, 5 et 6 sont exactes.
Affirmation 1
Non.
La variation d’enthalpie libre DG ne donne pas d’indication sur la vitesse d’une réaction.
DG < 0 : sens de réaction : réactifs => produits
DG > 0 : sens de réaction : produits => réactifs
Affirmation 2
Oui.
[B] : Il est à noter que les vitesses de réactions maximales (Vmax) n’ont pas les mêmes valeurs d’une réaction enzymatique à l’autre
Affirmation 3
Non.
[A] :
Les vitesses correspondent à la pente des tangentes aux courbes (et non aux
ordonnées !).
La vitesse (la pente) est maximum en début de réaction.
La vitesse de réaction devient nulle avec le temps (il ne reste plus de substrats à convertir en produits)
Affirmation 5
Oui.
[B] :
[S] << Km -> V = Vmax [S]/Km
[S] = Km -> V = Vmax /2
[S] >> Km -> V = Vmax
La deuxième courbe représente une affinité plus grande du substrat pour son enzyme. (Km à une valeur plus petite : Il faut moins de substrat pour atteindre une vitesse ½ de Vmax).
Il est à noter que les vitesses de réactions maximales (Vmax) n’ont pas les mêmes valeurs d’une réaction enzymatique à l’autre.
Affirmation 6
Oui.
[S] = Km v=Vmax/2
Affirmation 7
Si.
Rappels :
[A] : Vitesse de réaction =
- variation de concentration produit / unité de temps
Ou (l’inverse) :
- variation de concentration substrat / unité de temps
Influences
Selon la réaction enzymatique, des facteurs peuvent influencer la vitesse de la réaction.
Exemples :
- Les concentrations en enzyme et en substrat,
(Voir figure)
- La température,
En général, les conditions optimales avoisinent 37°/38°.
Au dessus de 60°, l’enzyme est dénaturée par rupture des liaisons hydrogènes de la protéine.
En dessous de 5°, l’enzyme perd de sa réactivité par perte d’agitation moléculaire.
Il existe des enzymes thermostables.
Exemple : ADN polymérase.
- Le pH,
La réactivité enzymatique dépend de la réaction considérée :
Exemples :
- pH acide environ 2 pour la pepsine,
- pH basique 8 pour la trypsine. Etc.
Pour des pH extrêmes, 13-14 : l’enzyme est dénaturée.
- Les inhibiteurs et cofacteurs (ions métalliques, coenzynes).