Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Systèmes ouverts, fermés,
isolés
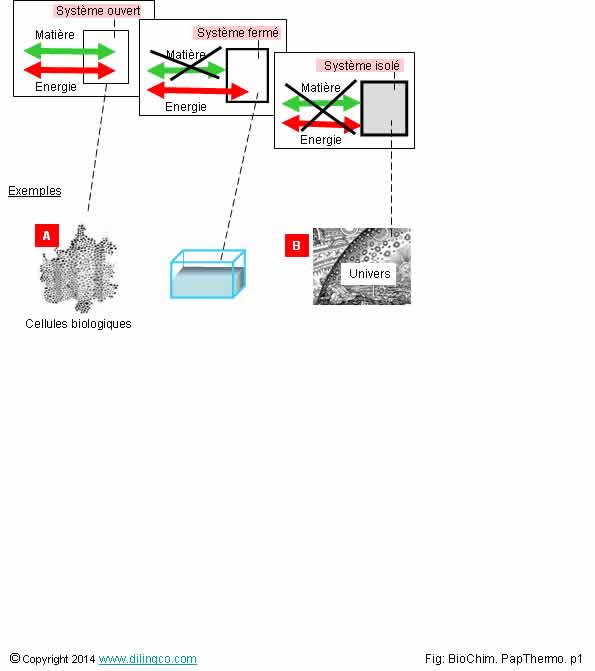
Sélectionner
l’affirmation exacte :
1-
Bouteille en plastique fermée : exemple de système thermodynamique isolé
2- [A].
En anatomie, une cellule est un système thermodynamique fermé
3- [B].
L’univers est un exemple de système thermodynamique isolé
4- Une
pile électrique est un exemple de système ouvert
L’affirmation
3 est exacte.
Cette page provient de Physique/Thermodynamique
Principes
de thermodynamique
Affirmation
1
Non.
Bouteille
en plastique fermée : Système thermodynamique
fermé.
Un
système thermodynamique fermé peut échanger :
- un
travail avec le milieu extérieur (la paroi est déformable),
- de la
chaleur avec le milieu extérieur.
Un système fermé ne peut pas d’échange de matière avec le milieu
extérieur.
Exemple
de système isolé (aucun échange avec le milieu
extérieur) :
Bouteille
thermos fermée idéale ; pas d’échange de matière, pas d’échange d’énergie
sous forme de chaleur, d’électricité, de travail (parois indéformables) etc.
Affirmation
2
Non.
Il y a
des échanges d’énergie et de matière entre la cellule et son environnement :
la cellule biologique est un système ouvert.
Les
éléments qui composent les êtres vivants sont des systèmes ouverts.
Affirmation
3
Oui.
L’univers
est, par principe, un système thermodynamique isolé
(Il n’y a
pas de milieu extérieur).
Thermodynamique :
l’énergie et la matière d’un système isolé se conservent.
Nota :
e=mc2
L’énergie et la masse sont liées
(À la
célérité de la lumière près).
Affirmation
4
Non.
Une pile
électrique est un exemple de système fermé.
Système fermé :
- échange d’énergie avec le milieu extérieur,
- pas d’échange de matière avec le milieu
extérieur.
Thermodynamique
La
thermodynamique est l’étude des phénomènes énergétiques
(température, chaleur, transformations, évolutions,
etc.), des systèmes.
Thermodynamique
& vivant
La
thermodynamique appliquée au vivant = biologie
et biochimie vues sous le prisme de l’énergie.
Exemples :
- Une cellule a besoin d’extraire de l’énergie de son
environnement pour réaliser certaines de ses fonctions.
- Comment et jusqu'à quel point une réaction
biochimique peut se faire.
Système
thermodynamique
Un
système thermodynamique est une portion définie,
de manière arbitraire ou non, d’un ensemble plus
vaste en interaction avec lui.
Exemples :
Un être
humain, un muscle, une bulle de gaz, une machine thermique, etc.
Notions
de base
Les
notions théoriques de base de la thermodynamique sont :
- La chaleur et la température,
- L’énergie, ses formes et ses transformations,
- L’entropie et l’enthalpie,
- L’évolution d’un état thermique dans le temps, l’équilibre, la réversibilité
ou l’irréversibilité.
Exemple
d’utilité de la thermodynamique :
Faut-il
chauffer pour optimiser une réaction chimique ?
Page 2.
4 Principes de la
thermodynamique
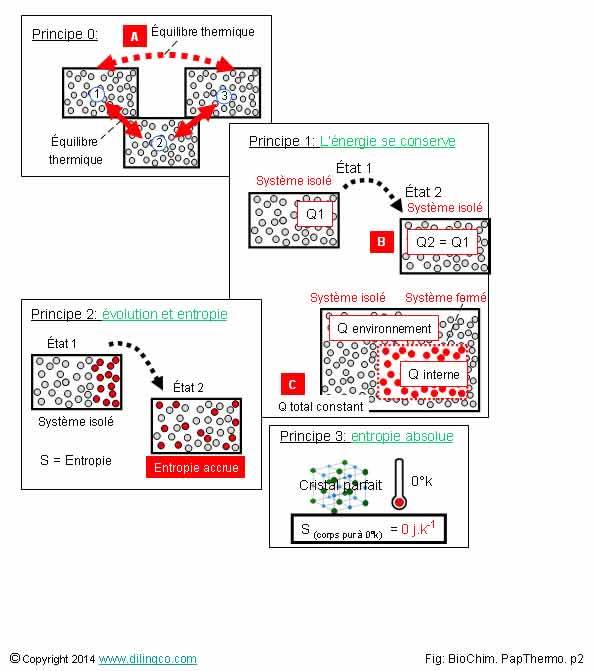
Sélectionner
les deux affirmations exactes :
1- [A]. 1
et 2 en équilibre thermique, 2 et 3 en équilibre thermique = Les trois systèmes
sont en équilibre thermique entre eux
2- [B]. Q2=Q1. L’énergie se conserve mais peut prendre des formes différentes
3-
L’évolution d’une réaction dans un système isolé n’est jamais prédictible,
jamais irréversible, et ne dépend pas de considérations thermodynamiques
4- La thermodynamique s’intéresse aux processus de réactions chimiques, à la
vitesse de réaction, aux fonctions et durées d’évolutions
5- [C].
L’énergie d’un système fermé baisse : l’énergie du système isolé global
qui le contient baisse aussi
Les
affirmations 1 et 2 sont exactes.
Cette page provient de Physique/Thermodynamique
Principes
de thermodynamique
Affirmation
1
Oui.
Principe
0 de la thermodynamique : Equilibre thermique.
Deux systèmes en équilibre thermique avec un troisième sont aussi
en équilibre thermique entre eux.
Affirmation
2
Oui
Principe
1 : L’énergie
se conserve.
L’énergie peut prendre des formes différentes : agitation thermique
moléculaire, travail mécanique, etc.
Pour un système isolé :
Somme des
différentes formes d’énergies en Q2 = somme des formes d’énergies en Q1.
Affirmation
3
Si.
Deuxième principe : principe d’évolution & d’entropie.
L’énergie
passe irréversiblement de formes concentrées
et potentielles, à des formes diffuses, désordonnées, et cinétiques.
Le
deuxième principe introduit la notion d’entropie.
L’entropie S est la mesure du désordre.
Dans un
système isolé, l’entropie (le désordre) augmente
de manière irréversible.
En
thermodynamique classique, l’unité de l’entropie, quantité de chaleur échangée
par un système, à température T, est le joule par
kelvin.
Affirmation
5
Non.
L’énergie globale, celle du système isolé qui contient le système fermé, reste
constante.
Principe 1 : L’énergie se conserve.
Une perte en énergie du système interne va entraîner une augmentation d’énergie
dans son milieu extérieur pour rester conforme, globalement, au principe de la
thermodynamique.
Q interne baisse => Q environnement augmente
(L’énergie
diffusée augmente l’énergie environnementale)
Q total =
Q interne + Q environnement => augmente ou reste constante
- Reste
constante si le système global est en équilibre ou ‘idéalement’ proche de
l’équilibre,
- Q ne
peut pas diminuer : principe de la conservation de l’énergie d’un système
isolé.
Note :
Système fermé = permissible à l’énergie.
Principes
de la thermodynamique
Quatre principes régissent la thermodynamique.
Le premier et le deuxième principe sont les plus
importants.
- Principe 0 : équilibre thermique
- Premier principe : principe de conservation
de l’énergie.
L’énergie d’un système isolé est constante ; Les formes de l’énergie peuvent varier (l’énergie
se transforme)
- Deuxième principe : principe d’évolution de l’énergie & entropie.
L’énergie passe irréversiblement de formes : Concentrées et
potentielles, à
des formes, diffuses, désordonnées, et cinétiques.
Le
deuxième principe introduit la notion « d’entropie ».
L’entropie
est la mesure du désordre d’un
système.
Le
deuxième principe permet de prévoir le sens d’une
réaction chimique et l’équilibre
chimique d’une réaction.
- Troisième principe : un système qui descend vers son état quantique fondamental
voit sa température s’approcher du zéro absolu
(O°
Kelvin= - 273,15° C)
Page 3
Concept d’entropie
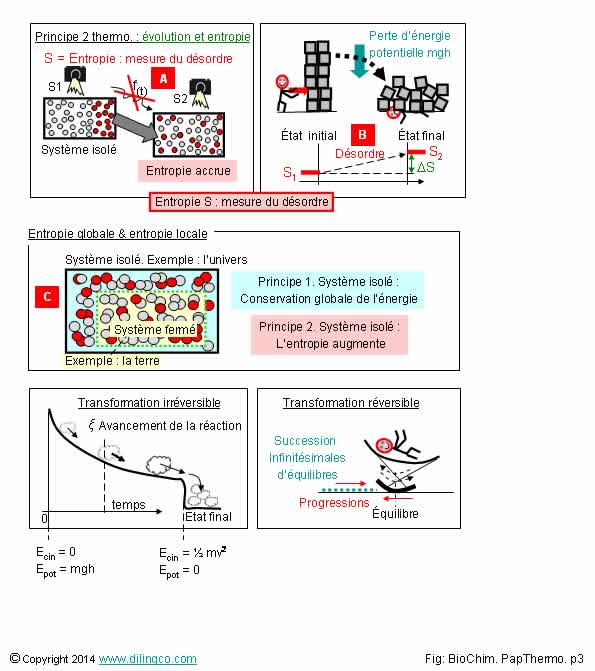
Sélectionner les deux affirmations exactes :
1- [A]. Entropie S : Variable d’état caractérisant le
désordre des éléments d’un système à des instants t1, t2, ….
2- [A]. Entropie S est une fonction spécifique (et complexe),
liée au temps, S = f(t)
3- [B]. La variation de l’entropie entre les deux états d’entropie
a été négative
4- L’entropie d’un système isolé, le désordre de ses éléments,
logiquement et statistiquement, augmente
5- [C]. L’entropie du système fermé suit la même évolution que
l’entropie du système isolé dans lequel il est contenu
6- [C]. La variation d’entropie du système fermé ne peut pas être
nulle si la variation d’entropie du système isolé qui le contient augmente
Les affirmations 1 et 4 sont exactes.
L’entropie est traitée dans le chapitre Physique/Thermodynamique
Evolution & équilibre.
Affirmation 2
Non.
[A]. Une variable d’état est une variable, pour un état du système à un
instant donnée.
Par définition, elle ne dépend pas du chemin suivi entre les deux
états.
Elle ne peut pas être une fonction, même la plus compliquée possible, définie
pour une évolution.
Affirmation 3
Non.
[B]. à l’instant initial :
S = constante caractérisant le désordre = constante.
À l’instant final, le désordre est plus important.
S2 à une valeur plus importante que celle de S1.
On a *D S > 0.
Note :
*D :
variation globale de S entre 2 états distincts.
d : petite variation, pas forcément à un rythme constant, sur un court
instant, entre deux points proches.
Affirmation 4
Oui.
L’entropie d’un système isolé, le désordre de ses éléments,
logiquement et statistiquement, augmente.
Exemple de système isolé : l’univers.
Les éléments qui le forment, les planètes, les hommes, les
molécules, les … varient constamment dans leurs nombres, leurs positions, leurs
constitutions … : le « désordre » ne peut que logiquement
s’accroître.
La probabilité d’un arrangement, ou même d’une stabilisation des éléments, sont
d’après les probabilités nulles.
L’entropie d’un système isolé ne peut qu’augmenter.
Notes :
-
L’univers est, par principe, un système thermodynamique isolé
(Il n’y a
pas de milieu extérieur).
Thermodynamique :
l’énergie et la matière d’un système isolé se conservent.
- L’énergie et la masse sont liées. e=mc2
(À la
célérité de la lumière près).
- Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
Informations complémentaires : rechercher sur Internet
« entropie mort de l’univers »
Affirmation 5
Non.
[C]. L’entropie d’un système fermé, la variation du désordre
interne de ses éléments, n’a statistiquement aucune raison de suivre les mêmes variations
des éléments du système isolé qui le contient.
Affirmation 6
Si.
[C]. Exemple : imaginer un système fermé « mort », dont
les composants sont figés (pas de variation d’entropie), contenu dans un
système « vivant ».
Note :
La variation d’entropie d’un système fermé peut être négative, dS<0, si l’entropie du
milieu extérieur qui le contient augmente en conséquence.
Page 4.
Enthalpie
& Chaleur
Sélectionner
les deux affirmations exactes :
1-
Pression et volume sont des grandeurs intensives
2- La
variation d’enthalpie au cours d’une réaction ne peut pas être mesurée
3- La
variation d’enthalpie lors d’une réaction ne dépend pas des conditions
extérieures
4- Lors
d’une réaction, une diminution de l’énergie du système = réaction exothermique
5-
Variation d’enthalpie à pression constante = chaleur échangée => premier
principe de la thermodynamique
6- Il
faut apporter de la chaleur pour qu’une réaction exothermique (diminution de
l’enthalpie) se fasse
Les
affirmations 4 et 5 sont exactes.
L’enthalpie traitée dans le chapitre Physique/Thermodynamique
Energie/Enthalpie
Affirmation
1
Non
pV dépend du volume occupé par le
système, c’est une grandeur extensive.
pV
représente le travail que le système doit fournir contre la pression extérieure
pour garder son volume.
Voir Variables d’état. Extensives.
Intensives
Affirmation
2
Si.
La variation d’enthalpie (zone soulignée en noir dans la figure) correspond aux
variations de chaleur Q fournie, ou reçue,
lors d’une réaction.
Mesurer
la quantité de chaleur échangée lors de la réaction revient à mesurer
l’enthalpie.
Affirmation
3
Si.
*DH
dépend des conditions extérieures, de la pression ou de la température, par
exemples.
Affirmation
4
Oui.
Exothermique : La réaction fournie de la chaleur.
Endothermique : La réaction reçoit de la chaleur.
Athermique
: pas d’échange de chaleur
Isochore :
à volume constant.
Isobare :
à pression constante.
Isotherme : à température constante.
Affirmation
5
Oui.
*DH = Qp
Variation d’enthalpie = chaleur échangée (à pression constante)
Premier principe de la thermodynamique : L’énergie se conserve.
Affirmation
6
Non.
Il faut
apporter de la chaleur pour qu’une réaction endothermique,
qui consomme de l’énergie (variation d’enthalpie positive) se fasse.
Note :
Ceci
illustre une des utilités de la thermodynamique : calculer l’enthalpie d’une réaction, permet de savoir s’il
faut chauffer ou non pour qu’une réaction chimique se fasse.
A se
rappeler
Enthalpie, du grec « chaleur interne » :
chaleur (énergie) interne + travail de maintient de volume. H = U + pV.
U :
énergie interne emmagasinée par le système.
pV : travail pour maintenir le volume occupé par le système.
À pv
constant, variation
d’enthalpie = chaleur échangée.
L’enthalpie
= énergie = dimension d’une énergie.
Unité : joule
Note :
La connaissance de l’enthalpie (liée à la chaleur), permet,
par exemples, de choisir le gaz le mieux approprié pour chauffer un mélange,
chauffer ou refroidir pour augmenter le rendement d’une réaction chimique, etc.
Page 5.
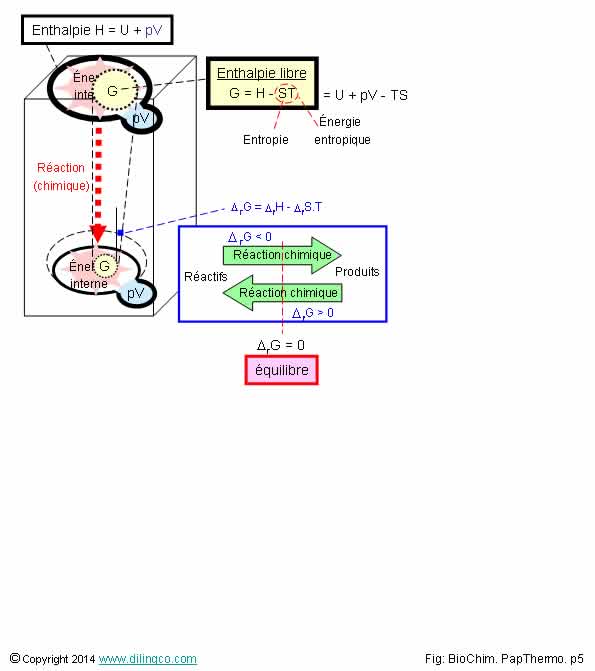
Enthalpie libre G
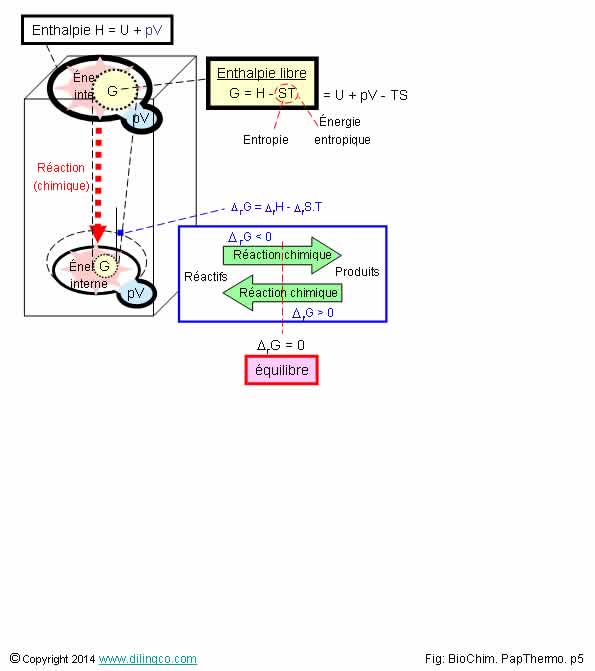
Sélectionner l’affirmation exacte :
1- Pour une réaction [réactifs ->produits], la variation
d'enthalpie libre est positive
2- Enthalpie libre G : partie de
l’enthalpie utilisable pour produire une transformation chimique ou électrique
3- L’enthalpie libre G= H – TS n’est pas liée au deuxième principe de
la thermodynamique (évolution et entropie)
4- L’enthalpie libre G n’est ni une fonction d’état ni une
variable extensive
L’affirmation
2 est exacte.
L’enthalpie libre G est traitée dans le chapitre
Physique/Thermodynamique
Enthalpie
libre
Affirmation 1
Non.
Réaction Réactifs -> Produits : variation d'enthalpie libre G diminue
(*DG < 0).
Le signe de l’enthalpie libre permet de prévoir le sens d’une
réaction.
(Voir pages suivantes)
Affirmation 2
Oui.
Enthalpie libre G : partie de l’enthalpie utilisable pour
produire une réaction chimique, électrique, ou un travail.
G : l’enthalpie libre G :
- introduite par Willard Gibbs,
- aussi appelé « énergie de Gibbs ».
Affirmation 3
Si.
L’enthalpie libre G= H – TS est liée au 2ème principe de la
thermodynamique par sa variable S, entropie.
2ème principe de la thermodynamique : évolution et
entropie.
Affirmation 4
Si.
La figure montre que l’enthalpie libre est liée à un état du
système.
C’est aussi une grandeur extensible, par sa composante H liée au
volume.
Enthalpie H = U + pV
Enthalpie libre
L’enthalpie
libre G, est aussi appelée « énergie libre de Gibbs »
G : Willard Gibbs.
G = H – TS
H :
enthalpie
T : température
en degrés absolus dans l’échelle Kelvin
S : entropie
L’enthalpie libre peut être
interprétée comme la partie de l’enthalpie utilisable pour produire une transformation chimique ou électrique
(À température et à pression constante).
Variation
d’enthalpie libre
Le système évolue vers son état de plus faible énergie.
Le signe
de variation de l’enthalpie libre détermine le sens de la réaction chimique.
Réactions « réactifs vers produits » :
*D GT,p(sys) = *D H sys – T *D Ssys < 0
Réactions « produits vers réactifs » :
*D G T,p(sys) = *D H sys – T *D Ssys > 0
Réaction à l’équilibre :
*D G T,p(sys) = 0 = La réaction s’arrête.
Page 6.
Résumé. Relations H, S, G
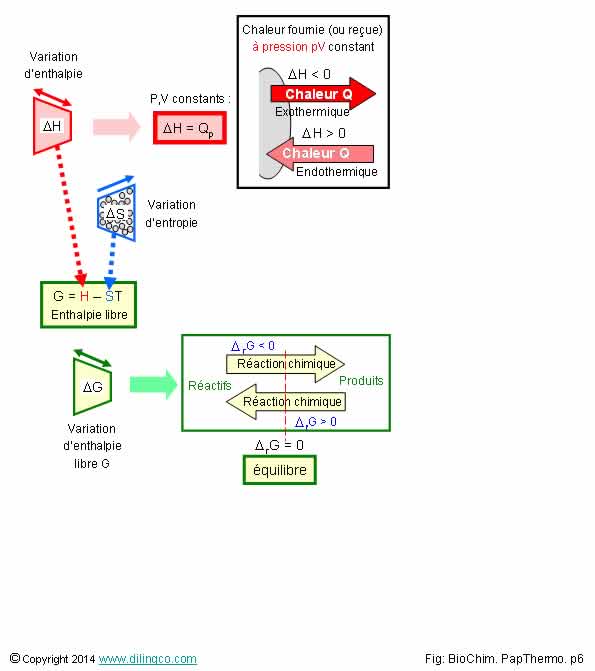
Sélectionner l’affirmation exacte :
1- À P,V constants, la variation d’enthalpie libre = chaleur
échangée
2- Dans un système isolé, l’entropie, mesure du désordre, peut
décroître
3- La variation d’entropie sert à calculer l’enthalpie libre
4- La valeur absolue de l’enthalpie libre sert à définir le sens
d’une réaction chimique
L’affirmation 3 est exacte.
Affirmation 1
Non ;
À P,V constants, la variation d’enthalpie = chaleur échangée
La variation d’enthalpie libre donne le sens de la réaction.
Affirmation
2
Non.
Système isolé :
- pas
d’échange avec le milieu extérieur,
- l’énergie y est constante, mais peut prendre des
formes différentes,
- Système isolé : l’entropie ne peut pas décroître.
Elle ne
peut qu’augmenter ou rester constante si l’état final est atteint.
Note :
Un système non isolé peut avoir une variation d’entropie négative s’il produit une
variation d’entropie positive en conséquence sur son environnement.
Affirmation 4
Non.
Le signe de la variation d’enthalpie libre sert à définir le sens
d’une réaction chimique.
Les QCM interactifs sont accessibles à partir de la page d’accueil
du coaching virtuel à accès gratuit dilingco.com
Page 1.
Systèmes ouverts, fermés, isolés

Sélectionner l’affirmation exacte :
1- Bouteille en plastique fermée : exemple de système thermodynamique isolé
2- [A]. En anatomie, une cellule est un système thermodynamique fermé
3- [B]. L’univers est un exemple de système thermodynamique isolé
4- Une pile électrique est un exemple de système ouvert
L’affirmation 3 est exacte.
Cette page provient de Physique/Thermodynamique
Principes de thermodynamique
Affirmation 1
Non.
Bouteille en plastique fermée : Système thermodynamique fermé.
Un système thermodynamique fermé peut échanger :
- un travail avec le milieu extérieur (la paroi est déformable),
- de la chaleur avec le milieu extérieur.
Un système fermé ne peut pas d’échange de matière avec le milieu extérieur.
Exemple de système isolé (aucun échange avec le milieu extérieur) :
Bouteille thermos fermée idéale ; pas d’échange de matière, pas d’échange d’énergie sous forme de chaleur, d’électricité, de travail (parois indéformables) etc.
Affirmation 2
Non.
Il y a des échanges d’énergie et de matière entre la cellule et son environnement : la cellule biologique est un système ouvert.
Les éléments qui composent les êtres vivants sont des systèmes ouverts.
Affirmation 3
Oui.
L’univers est, par principe, un système thermodynamique isolé
(Il n’y a pas de milieu extérieur).
Thermodynamique : l’énergie et la matière d’un système isolé se conservent.
Nota :
e=mc2
L’énergie et la masse sont liées
(À la célérité de la lumière près).
Affirmation 4
Non.
Une pile électrique est un exemple de système fermé.
Système fermé :
- échange d’énergie avec le milieu extérieur,
- pas d’échange de matière avec le milieu extérieur.
Thermodynamique
La thermodynamique est l’étude des phénomènes énergétiques (température, chaleur, transformations, évolutions, etc.), des systèmes.
Thermodynamique & vivant
La thermodynamique appliquée au vivant = biologie et biochimie vues sous le prisme de l’énergie.
Exemples :
- Une cellule a besoin d’extraire de l’énergie de son environnement pour réaliser certaines de ses fonctions.
- Comment et jusqu'à quel point une réaction biochimique peut se faire.
Système thermodynamique
Un système thermodynamique est une portion définie, de manière arbitraire ou non, d’un ensemble plus vaste en interaction avec lui.
Exemples :
Un être humain, un muscle, une bulle de gaz, une machine thermique, etc.
Notions de base
Les notions théoriques de base de la thermodynamique sont :
- La chaleur et la température,
- L’énergie, ses formes et ses transformations,
- L’entropie et l’enthalpie,
- L’évolution d’un état thermique dans le temps, l’équilibre, la réversibilité ou l’irréversibilité.
Exemple d’utilité de la thermodynamique :
Faut-il chauffer pour optimiser une réaction chimique ?
Page 2.
4 Principes de la thermodynamique

Sélectionner les deux affirmations exactes :
1- [A]. 1
et 2 en équilibre thermique, 2 et 3 en équilibre thermique = Les trois systèmes
sont en équilibre thermique entre eux
2- [B]. Q2=Q1. L’énergie se conserve mais peut prendre des formes différentes
3-
L’évolution d’une réaction dans un système isolé n’est jamais prédictible,
jamais irréversible, et ne dépend pas de considérations thermodynamiques
4- La thermodynamique s’intéresse aux processus de réactions chimiques, à la
vitesse de réaction, aux fonctions et durées d’évolutions
5- [C]. L’énergie d’un système fermé baisse : l’énergie du système isolé global qui le contient baisse aussi
Les affirmations 1 et 2 sont exactes.
Cette page provient de Physique/Thermodynamique
Principes de thermodynamique
Affirmation 1
Oui.
Principe 0 de la thermodynamique : Equilibre thermique.
Deux systèmes en équilibre thermique avec un troisième sont aussi en équilibre thermique entre eux.
Affirmation 2
Oui
Principe
1 : L’énergie
se conserve.
L’énergie peut prendre des formes différentes : agitation thermique
moléculaire, travail mécanique, etc.
Pour un système isolé :
Somme des différentes formes d’énergies en Q2 = somme des formes d’énergies en Q1.
Affirmation 3
Si.
Deuxième principe : principe d’évolution & d’entropie.
L’énergie passe irréversiblement de formes concentrées et potentielles, à des formes diffuses, désordonnées, et cinétiques.
Le
deuxième principe introduit la notion d’entropie.
L’entropie S est la mesure du désordre.
Dans un système isolé, l’entropie (le désordre) augmente de manière irréversible.
En thermodynamique classique, l’unité de l’entropie, quantité de chaleur échangée par un système, à température T, est le joule par kelvin.
Affirmation 5
Non.
L’énergie globale, celle du système isolé qui contient le système fermé, reste
constante.
Principe 1 : L’énergie se conserve.
Une perte en énergie du système interne va entraîner une augmentation d’énergie
dans son milieu extérieur pour rester conforme, globalement, au principe de la
thermodynamique.
Q interne baisse => Q environnement augmente
(L’énergie diffusée augmente l’énergie environnementale)
Q total = Q interne + Q environnement => augmente ou reste constante
- Reste constante si le système global est en équilibre ou ‘idéalement’ proche de l’équilibre,
- Q ne peut pas diminuer : principe de la conservation de l’énergie d’un système isolé.
Note :
Système fermé = permissible à l’énergie.
Principes de la thermodynamique
Quatre principes régissent la thermodynamique.
Le premier et le deuxième principe sont les plus importants.
- Principe 0 : équilibre thermique
- Premier principe : principe de conservation de l’énergie.
L’énergie d’un système isolé est constante ; Les formes de l’énergie peuvent varier (l’énergie se transforme)
- Deuxième principe : principe d’évolution de l’énergie & entropie.
L’énergie passe irréversiblement de formes : Concentrées et potentielles, à des formes, diffuses, désordonnées, et cinétiques.
Le deuxième principe introduit la notion « d’entropie ».
L’entropie est la mesure du désordre d’un système.
Le deuxième principe permet de prévoir le sens d’une réaction chimique et l’équilibre chimique d’une réaction.
- Troisième principe : un système qui descend vers son état quantique fondamental voit sa température s’approcher du zéro absolu
(O° Kelvin= - 273,15° C)
Page 3
Concept d’entropie

Sélectionner les deux affirmations exactes :
1- [A]. Entropie S : Variable d’état caractérisant le désordre des éléments d’un système à des instants t1, t2, ….
2- [A]. Entropie S est une fonction spécifique (et complexe), liée au temps, S = f(t)
3- [B]. La variation de l’entropie entre les deux états d’entropie a été négative
4- L’entropie d’un système isolé, le désordre de ses éléments, logiquement et statistiquement, augmente
5- [C]. L’entropie du système fermé suit la même évolution que l’entropie du système isolé dans lequel il est contenu
6- [C]. La variation d’entropie du système fermé ne peut pas être nulle si la variation d’entropie du système isolé qui le contient augmente
Les affirmations 1 et 4 sont exactes.
L’entropie est traitée dans le chapitre Physique/Thermodynamique
Evolution & équilibre.
Affirmation 2
Non.
[A]. Une variable d’état est une variable, pour un état du système à un instant donnée.
Par définition, elle ne dépend pas du chemin suivi entre les deux
états.
Elle ne peut pas être une fonction, même la plus compliquée possible, définie
pour une évolution.
Affirmation 3
Non.
[B]. à l’instant initial :
S = constante caractérisant le désordre = constante.
À l’instant final, le désordre est plus important.
S2 à une valeur plus importante que celle de S1.
On a *D S > 0.
Note :
*D : variation globale de S entre 2 états distincts.
d : petite variation, pas forcément à un rythme constant, sur un court instant, entre deux points proches.
Affirmation 4
Oui.
L’entropie d’un système isolé, le désordre de ses éléments, logiquement et statistiquement, augmente.
Exemple de système isolé : l’univers.
Les éléments qui le forment, les planètes, les hommes, les
molécules, les … varient constamment dans leurs nombres, leurs positions, leurs
constitutions … : le « désordre » ne peut que logiquement
s’accroître.
La probabilité d’un arrangement, ou même d’une stabilisation des éléments, sont
d’après les probabilités nulles.
L’entropie d’un système isolé ne peut qu’augmenter.
Notes :
- L’univers est, par principe, un système thermodynamique isolé
(Il n’y a pas de milieu extérieur).
Thermodynamique : l’énergie et la matière d’un système isolé se conservent.
- L’énergie et la masse sont liées. e=mc2
(À la célérité de la lumière près).
- Lavoisier
« Rien ne se perd, rien ne se crée, tout se transforme. »
Informations complémentaires : rechercher sur Internet « entropie mort de l’univers »
Affirmation 5
Non.
[C]. L’entropie d’un système fermé, la variation du désordre interne de ses éléments, n’a statistiquement aucune raison de suivre les mêmes variations des éléments du système isolé qui le contient.
Affirmation 6
Si.
[C]. Exemple : imaginer un système fermé « mort », dont les composants sont figés (pas de variation d’entropie), contenu dans un système « vivant ».
Note :
La variation d’entropie d’un système fermé peut être négative, dS<0, si l’entropie du milieu extérieur qui le contient augmente en conséquence.
Page 4.
Enthalpie & Chaleur

Sélectionner les deux affirmations exactes :
1- Pression et volume sont des grandeurs intensives
2- La variation d’enthalpie au cours d’une réaction ne peut pas être mesurée
3- La variation d’enthalpie lors d’une réaction ne dépend pas des conditions extérieures
4- Lors d’une réaction, une diminution de l’énergie du système = réaction exothermique
5- Variation d’enthalpie à pression constante = chaleur échangée => premier principe de la thermodynamique
6- Il faut apporter de la chaleur pour qu’une réaction exothermique (diminution de l’enthalpie) se fasse
Les affirmations 4 et 5 sont exactes.
L’enthalpie traitée dans le chapitre Physique/Thermodynamique
Energie/Enthalpie
Affirmation 1
Non
pV dépend du volume occupé par le
système, c’est une grandeur extensive.
pV représente le travail que le système doit fournir contre la pression extérieure pour garder son volume.
Voir Variables d’état. Extensives. Intensives
Affirmation 2
Si.
La variation d’enthalpie (zone soulignée en noir dans la figure) correspond aux variations de chaleur Q fournie, ou reçue, lors d’une réaction.
Mesurer la quantité de chaleur échangée lors de la réaction revient à mesurer l’enthalpie.
Affirmation 3
Si.
*DH dépend des conditions extérieures, de la pression ou de la température, par exemples.
Affirmation 4
Oui.
Exothermique : La réaction fournie de la chaleur.
Endothermique : La réaction reçoit de la chaleur.
Athermique : pas d’échange de chaleur
Isochore : à volume constant.
Isobare : à pression constante.
Isotherme : à température constante.
Affirmation 5
Oui.
*DH = Qp
Variation d’enthalpie = chaleur échangée (à pression constante)
Premier principe de la thermodynamique : L’énergie se conserve.
Affirmation 6
Non.
Il faut apporter de la chaleur pour qu’une réaction endothermique, qui consomme de l’énergie (variation d’enthalpie positive) se fasse.
Note :
Ceci illustre une des utilités de la thermodynamique : calculer l’enthalpie d’une réaction, permet de savoir s’il faut chauffer ou non pour qu’une réaction chimique se fasse.
A se rappeler
Enthalpie, du grec « chaleur interne » : chaleur (énergie) interne + travail de maintient de volume. H = U + pV.
U :
énergie interne emmagasinée par le système.
pV : travail pour maintenir le volume occupé par le système.
À pv constant, variation d’enthalpie = chaleur échangée.
L’enthalpie = énergie = dimension d’une énergie.
Unité : joule
Note :
La connaissance de l’enthalpie (liée à la chaleur), permet, par exemples, de choisir le gaz le mieux approprié pour chauffer un mélange, chauffer ou refroidir pour augmenter le rendement d’une réaction chimique, etc.
Page 5.
Enthalpie libre G

Sélectionner l’affirmation exacte :
1- Pour une réaction [réactifs ->produits], la variation d'enthalpie libre est positive
2- Enthalpie libre G : partie de l’enthalpie utilisable pour produire une transformation chimique ou électrique
3- L’enthalpie libre G= H – TS n’est pas liée au deuxième principe de la thermodynamique (évolution et entropie)
4- L’enthalpie libre G n’est ni une fonction d’état ni une variable extensive
L’affirmation 2 est exacte.
L’enthalpie libre G est traitée dans le chapitre Physique/Thermodynamique
Enthalpie libre
Affirmation 1
Non.
Réaction Réactifs -> Produits : variation d'enthalpie libre G diminue (*DG < 0).
Le signe de l’enthalpie libre permet de prévoir le sens d’une réaction.
(Voir pages suivantes)
Affirmation 2
Oui.
Enthalpie libre G : partie de l’enthalpie utilisable pour produire une réaction chimique, électrique, ou un travail.
G : l’enthalpie libre G :
- introduite par Willard Gibbs,
- aussi appelé « énergie de Gibbs ».
Affirmation 3
Si.
L’enthalpie libre G= H – TS est liée au 2ème principe de la thermodynamique par sa variable S, entropie.
2ème principe de la thermodynamique : évolution et entropie.
Affirmation 4
Si.
La figure montre que l’enthalpie libre est liée à un état du système.
C’est aussi une grandeur extensible, par sa composante H liée au volume.
Enthalpie H = U + pV
Enthalpie libre
L’enthalpie libre G, est aussi appelée « énergie libre de Gibbs »
G : Willard Gibbs.
G = H – TS
H : enthalpie
T : température en degrés absolus dans l’échelle Kelvin
S : entropie
L’enthalpie libre peut être interprétée comme la partie de l’enthalpie utilisable pour produire une transformation chimique ou électrique
(À température et à pression constante).
Variation d’enthalpie libre
Le système évolue vers son état de plus faible énergie.
Le signe de variation de l’enthalpie libre détermine le sens de la réaction chimique.
Réactions « réactifs vers produits » :
*D GT,p(sys) = *D H sys – T *D Ssys < 0
Réactions « produits vers réactifs » :
*D G T,p(sys) = *D H sys – T *D Ssys > 0
Réaction à l’équilibre :
*D G T,p(sys) = 0 = La réaction s’arrête.
Page 6.
Résumé. Relations H, S, G

Sélectionner l’affirmation exacte :
1- À P,V constants, la variation d’enthalpie libre = chaleur échangée
2- Dans un système isolé, l’entropie, mesure du désordre, peut décroître
3- La variation d’entropie sert à calculer l’enthalpie libre
4- La valeur absolue de l’enthalpie libre sert à définir le sens d’une réaction chimique
L’affirmation 3 est exacte.
Affirmation 1
Non ;
À P,V constants, la variation d’enthalpie = chaleur échangée
La variation d’enthalpie libre donne le sens de la réaction.
Affirmation 2
Non.
Système isolé :
- pas d’échange avec le milieu extérieur,
- l’énergie y est constante, mais peut prendre des formes différentes,
- Système isolé : l’entropie ne peut pas décroître.
Elle ne peut qu’augmenter ou rester constante si l’état final est atteint.
Note :
Un système non isolé peut avoir une variation d’entropie négative s’il produit une variation d’entropie positive en conséquence sur son environnement.
Affirmation 4
Non.
Le signe de la variation d’enthalpie libre sert à définir le sens d’une réaction chimique.